贝莱斯芽孢杆菌的生物学特性研究
宁豫昌 , 吴祖芳 , 龚 婷
(1. 河南牧业经济学院食品与生物工程学院 , 河南 郑州 450046 ; 2. 宁波大学食品与药学学院 , 浙江 宁波 315832)
贝莱斯芽孢杆菌(Bacillusvelezensis)最初由Ruiz-García 等[1]从位于西班牙马拉加省拖雷德尔马尔地区的贝莱斯河流的河口中分离出来,是芽孢杆菌属(Bacillus)的一个新种。此后,人们陆续从水、土壤、动物肠道、发酵食品等处分离得到该菌种[2-3],并发现贝莱斯芽孢杆菌能够产生多种生物活性物质,具有良好的生物学功能,尤其在促进植物生长和防治植物真菌病害方面具有重要作用。例如,贝莱斯芽孢杆菌FKM10 被证实可以通过增加生物量、促进养分吸收、改善土壤肥力、改变土壤微生物群落结构等促进湖北海棠的生长[4]。多花黄精内生贝莱斯芽胞杆菌ZJU-3发酵液中的脂肽粗提物可明显抑制尖孢镰刀菌菌丝的生长,抑制率达到51.6%,并且该菌株还可产生吲哚乙酸、激动素、玉米素、赤霉素等多种植物激素[5]。Kim等[6]将贝莱斯芽孢杆菌AK-0与商品化配方共同配制,可在田间条件下有效防制苹果炭疽病。
已有研究表明,贝莱斯芽孢杆菌具有作为人类或畜禽用益生菌的潜在开发价值。如,Bampidis等[7]研究表明,贝莱斯芽孢杆菌NRRL B-67257无耐药性基因、毒力基因以及产生氨基糖苷的能力,作为食品添加剂是安全的。唐萍等[8]通过小鼠试验证明,贝莱斯芽孢杆菌DJB5具有较高的生物安全性。此外,通过基因组挖掘发现贝莱斯芽孢杆菌可产生多种抗菌化合物,如杆菌素、表面蛋白活性剂、蜂毒素、淀粉环素和羊毛硫菌素等[9]。然而,目前贝莱斯芽孢杆菌的研究与应用仍是以生防细菌和微生物菌肥为主,关于该菌种益生性能的研究尚不多见。本实验室前期由鳀鱼自然发酵液中筛选到1株贝莱斯芽孢杆菌,将其命名为SW5菌株,研究表明,该菌株在高渗透压环境下能够高效地水解鱼蛋白[10]。本试验以该菌株为研究对象,对其在高浓度胆盐、高温、模拟胃液、模拟肠液下的芽孢存活率,产胞外水解酶的能力,对细菌的抑制能力,以及对常用抗生素的敏感性等进行了测试。初步判断贝莱斯芽孢杆菌SW5菌株在不良环境条件下具有良好的生长性能,能够产生多种水解酶,且具有良好的抑菌能力和抗生素敏感性,为今后将贝莱斯芽孢杆菌作为新型益生菌开发的候选菌种提供了参考数据。
1 材料与方法
1.1 试验用菌株 试验用贝莱斯芽孢杆菌SW5菌株,由宁波大学食品生物技术实验室分离保存。大肠埃希菌(GDMCC 1.1478)、金黄色葡萄球菌(GDMCC 1.142)、蜡样芽孢杆菌(GDMCC 802269)、枯草芽孢杆菌(GDMCC 1.255)和肠沙门菌(GDMCC 801272),均购自广东省微生物菌种保藏中心。
1.2 主要试剂 青霉素药敏片(10 μg/片)、头孢拉定药敏片(30 μg/片)、链霉素药敏片(10 μg/片)、新霉素药敏片(30 μg/片)、氯霉素药敏片(30 μg/片)、红霉素药敏片(15 μg/片)、四环素药敏片(30 μg/片)、多西环素药敏片(30 μg/片)、阿米卡星药敏片(30 μg/片) 和甲硝唑药敏片(5 μg/片),均购自杭州微生物试剂有限公司;胃蛋白酶(≥250 N.F.U/mg)、胰蛋白酶(250 N.F.U/mg)、可溶性淀粉、酪蛋白、β-葡聚糖(酵母,水溶,HPLC≥80.0%),均购自北京索莱宝科技有限公司;羟甲基纤维素钠(CMC-Na),购自上海浦东化学品有限公司;牛胆盐、蛋白胨、牛肉膏、琼脂粉、胰蛋白胨、大豆蛋白胨,均购自北京奥博星生物技术有限公司;其余化学试剂,均购自天津市致远化学试剂有限公司。
1.3 培养基配方 NB培养基:蛋白胨10.0 g、牛肉膏3.0 g、氯化钠(NaCl)5.0 g、蒸馏水1 000 mL、pH (7.0±0.2)。淀粉-NA培养基:可溶性淀粉4.0 g、蛋白胨10.0 g、牛肉膏 5.0 g、磷酸氢二钾(K2HPO4)1.0 g、NaCl 5.0 g、蒸馏水1 000 mL、pH (7.0±0.2)。三丁酸甘油酯培养基:蛋白胨10 g、酵母粉 5 g、 NaCl 10 g、三丁酸甘油酯 2 mL、蒸馏水1 000 mL、 pH (7.0±0.2)。CMC-Na刚果红培养基:K2HPO40.5 g、硫酸镁(MgSO4) 0.25 g、CMC-Na 2.0 g、刚果红0.2 g、蛋白胨2.0 g、蒸馏水1 000 mL、pH (7.0±0.2)。TSB培养基:胰蛋白胨15.0 g、大豆蛋白胨5.0 g、NaCl 5.0 g、蒸馏水1 000 mL、pH (7.0±0.2),以上均为液体培养基,相应固体培养基只需在液体培养基基础上添加16 g/L的琼脂粉。
1.4 菌株耐受性试验
1.4.1 芽孢悬浮液的制备 活化2次后的贝莱斯芽孢杆菌SW5菌株接种于NB培养基,于37 ℃、150 r/min 下振荡培养72 h,培养液置于80 ℃恒温水浴中保温15 min,8 000 r/min离心10 min后弃去上清液,菌体沉淀用无菌生理盐水洗涤2次,最后复溶于与初始培养基等体积的无菌生理盐水,即为芽孢悬浮液。
1.4.2 胆盐耐受试验 在无菌生理盐水中加入牛胆盐,使其质量分数分别为0.05%、0.10%、0.15%、0.20%、0.25%、0.30%,分装于100 mL三角瓶,每瓶30 mL,121 ℃灭菌30 min。将芽孢悬浮液以10%接种于新鲜NB培养基中,于37 ℃、150 r/min 下振荡培养3 h,分别在培养的第0小时和第3小时取样,采用平板菌落计数法测定芽孢存活率[11],后续试验中芽孢存活率的测定方法均相同。
1.4.3 模拟胃液耐受试验 用0.1 mol/L的HCl调节生理盐水pH至3.0,121 ℃灭菌15 min后,冷却至50 ℃以下,无菌添加胃蛋白酶,分别配制成胃蛋白酶含量为2.5、5.0 mg/mL和10.0 mg/mL的模拟胃液。将芽孢悬浮液以10%接入模拟胃液中,37 ℃、150 r/min培养3 h,分别在培养的第0小时和第3小时取样,采用平板菌落计数法测定芽孢存活率。
1.4.4 模拟肠液耐受试验 取KH2PO40.68 g加水100 mL溶解,用0.1 mol/L的NaOH调pH至6.8,121 ℃灭菌15 min,冷却至50 ℃以下,无菌添加胰蛋白酶,分别配制成胰蛋白酶含量为2.5、5.0 mg/mL和10.0 mg/mL的模拟肠液。将芽孢悬浮液以10%接入模拟肠液中,37 ℃、150 r/min培养3 h,分别在培养的第0小时和第3小时取样,采用平板菌落计数法测定芽孢存活率。
1.4.5 高温耐受试验 将芽孢悬浮液分别置于60、65、70、75、80、85、90、95 ℃和100 ℃的水浴中保温30 min,迅速用冷水冷却后,采用平板菌落计数法测定不同保温条件下悬浮液的芽孢存活率。
1.5 产水解酶试验 将SW5菌株的种子液分别点种在酪蛋白固体培养基(在NB固体培养基的基础上加入1%的酪蛋白)、淀粉-NA 固体培养基和CMC-Na刚果红固体培养基表面,以无菌操作将种子液划线接种于三丁酸甘油酯固体培养基表面,所有培养基于37 ℃下倒置培养24 h。培养结束后,通过直接观察固体培养基上的菌落周围是否形成水解圈判断菌株是否产生蛋白酶、纤维素酶和脂肪酶;取出淀粉-NA 固体平板并将0.04 g碘轻洒在培养皿盖上后,将培养皿底部倒置在培养皿盖上碘熏1 min,通过观察菌落周围是否形成淀粉水解圈判断菌株是否产生淀粉酶。将种子液以5%的比例分别接种于酪蛋白液体培养基、淀粉-NA液体培养基、不含刚果红的CMC-Na液体培养基以及添加橄榄油(10 mL/L) 的NB液体培养基中,于37 ℃、150 r/min下振荡培养48 h,然后将各发酵液在4 ℃进行离心(8 000 r/min、5 min),收集上清液用0.22 μm微孔滤膜过滤,即为待测粗酶液,分别检测各粗酶液中的蛋白酶、淀粉酶、纤维素酶、脂肪酶的活力。其中,粗酶液中蛋白酶活力的测定参照参考文献[12]的方法,蛋白酶活力定义:40 ℃和pH 7.2条件下,1 mL粗酶液在1 min内分解酪蛋白产生1 μg酪氨酸,即为1个蛋白酶的酶活力单位(U/mL);参照参考文献[13]的方法进行粗酶液中淀粉酶活力的测定,淀粉酶活力定义:40 ℃和pH 7.2条件下,1 mL粗酶液在1 min内液化1 mg可溶性淀粉,即为1个淀粉酶的酶活力单位(U/mL);参照参考文献[14]的方法测定粗酶液中纤维素酶的活力,纤维素酶活力定义:40 ℃和pH 7.2条件下,1 mL粗酶液在1 min内水解羧甲基纤维素产生1 μg葡萄糖,即为1个纤维素酶的酶活力单位(U/mL); 参照参考文献[15]的方法对粗酶液中脂肪酶的活力进行测定,脂肪酶活力定义:40 ℃和pH 7.2条件下,1 mL粗酶液在1 min内水解底物产生1 μmol可滴定的脂肪酸,即为1个脂肪酶的酶活力单位(U/mL)。
1.6 抑菌试验 将贝莱斯芽孢杆菌SW5、大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、蜡样芽胞杆菌和肠沙门菌菌株,分别以5%的接种量同时接种于10 mL TSB液体培养基中,37 ℃、150 r/min培养12 h。将大肠埃希菌、金黄色葡萄球菌、肠沙门菌、蜡样芽孢杆菌、枯草芽孢杆菌的液体培养物用无菌水分别稀释1 000倍后,各吸取0.1 mL至TSB固体培养基表面,并涂布均匀。SW5菌株的液体培养物在4 ℃、8 000 r/min离心5 min,分别收集发酵上清液和菌体沉淀(菌体沉淀再用适量无菌生理盐水悬浮)。在涂布有大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、蜡样芽胞杆菌和肠沙门菌的固体平板表面分别放置3个经过灭菌处理并干燥的牛津杯,用移液枪吸取SW5菌株的发酵液、发酵液上清、菌体沉淀,加到牛津杯中,每个牛津杯中加200 μL, 静置30 min后,在37 ℃下培养24 h,然后观察并测量抑菌圈直径。
1.7 抗生素敏感试验 将贝莱斯芽孢杆菌SW5菌株种子液接种于NB液体培养基,37 ℃、150 r/min培养12 h,然后将0.1 mL的SW5菌株发酵液加入到15 mL冷却至50 ℃的灭菌NB固体培养基,并充分混匀。混匀后的NB固体培养基立即倾倒入灭菌培养皿,冷却至完全凝固。将含有定量抗生素的各个药敏纸片和空白纸片分别放置在固体培养基表面,在37 ℃下倒置培养24 h后,测量各药敏片的抑菌圈直径。
2 结果
2.1 胆盐耐受试验 胆盐浓度对贝莱斯芽孢杆菌SW5菌株芽孢存活率的影响结果见图1。随着胆盐浓度逐渐由0.05%提高至0.30%,贝莱斯芽孢杆菌SW5菌株的芽孢存活率逐渐由92.94%下降至65.19%。说明胆盐可降低贝莱斯芽孢杆菌SW5菌株芽孢的存活率,但同时也说明,贝莱斯芽孢杆菌SW5菌株的芽孢对胆盐具有较好的抵抗能力。此外,由图1可知,当胆盐浓度为0.25%和0.30%时,贝莱斯芽孢杆菌SW5菌株的芽孢存活率分别为65.54%和65.19%,说明当胆盐浓度由0.25%提高至0.30%时,对该菌株芽孢的存活率无明显的影响。
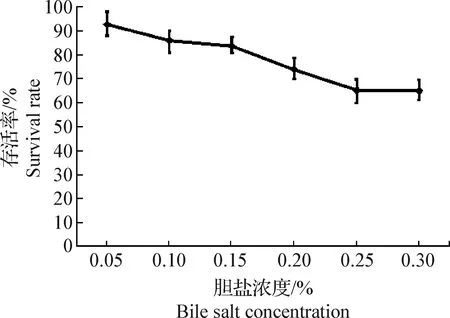
图1 胆盐浓度对贝莱斯芽孢杆菌芽孢存活率的影响Fig.1 Effect of bile salt concentration on the survival rate of Bacillus velezensis spores
2.2 模拟胃液和模拟肠液耐受试验 模拟胃液和模拟肠液对贝莱斯芽孢杆菌SW5菌株芽孢存活率的影响结果如表1和表2所示,在胃蛋白酶含量分别为2.5、5.0 mg/mL和10.0 mg/mL的模拟胃液中处理3 h后,贝莱斯芽孢杆菌SW5菌株的芽孢存活率分别为84.03%、75.48%和51.99%,而在胰蛋白酶含量分别为2.5、5.0 mg/mL和10.0 mg/mL的模拟肠液中处理3 h后,贝莱斯芽孢杆菌SW5菌株的芽孢存活率分别为68.06%、46.87%和31.91%。说明贝莱斯芽孢杆菌SW5菌株的芽孢无论对模拟胃液还是模拟肠液,都具有较好的耐受能力,该菌株芽孢能够经受胃肠道消化液的抑制而发挥作用。

表1 模拟胃液对贝莱斯芽孢杆菌芽孢存活率的影响Table 1 Effect of simulated gastric juice on the survival rate of Bacillus velezensis spores

表2 模拟肠液对贝莱斯芽孢杆菌芽孢存活率的影响Table 2 Effect of simulated intestinal juice on the survival rate of Bacillus velezensis spores
2.3 高温耐受试验 在不同高温条件下处理30 min 后,贝莱斯芽孢杆菌SW5菌株的芽孢存活率结果如图2所示,在60~80 ℃条件下,芽孢存活率由99.3%下降至93.5%,但均维持了90%以上的存活率,而从85~100 ℃时,芽孢存活率由72.8%快速下降至9.4%。说明80 ℃以下的高温处理对贝莱斯芽孢杆菌的芽孢存活率无明显影响。因此,该菌株芽孢在实际加工生产中能够很好地抵御80 ℃以下的高温条件,甚至在85 ℃的高温条件下,其芽孢存活率仍能维持在70%以上。

图2 温度对贝莱斯芽孢杆菌芽孢存活率的影响Fig.2 Effect of temperature on the survival rate of Bacillus velezensis spores
2.4 产水解酶试验 贝莱斯芽孢杆菌SW5菌株产水解酶的选择性平板定性试验结果如图3所示,该菌株在蛋白酶、脂肪酶、淀粉酶和纤维素酶的选择性平板上均可形成明显的水解圈。对该菌株发酵上清液分别进行上述4种水解酶的活力测定,结果如图4所示,贝莱斯芽孢杆菌SW5菌株的蛋白酶、脂肪酶、淀粉酶和纤维素酶的活力分别为53.90、10.30、67.80 U/mL和23.24 U/mL。
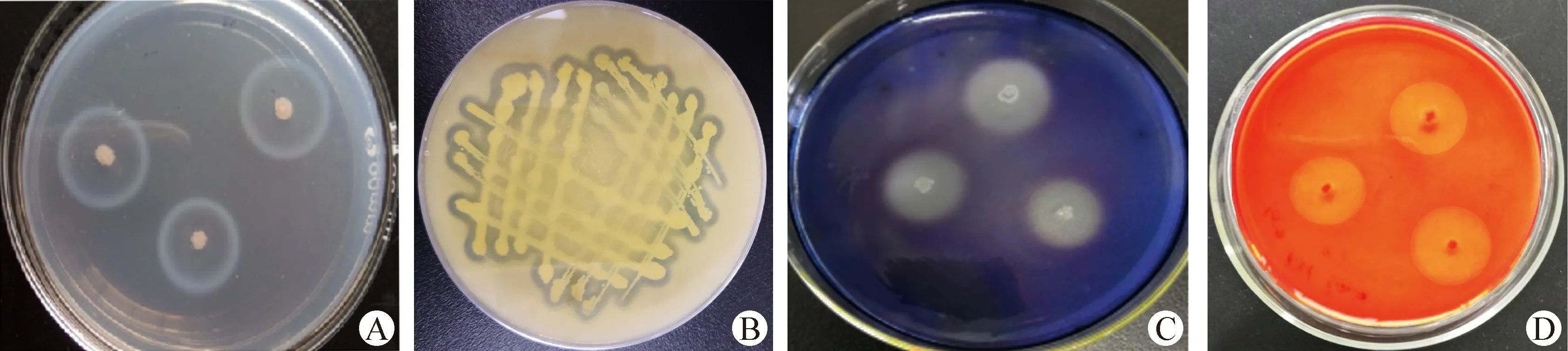
图3 贝莱斯芽孢杆菌产水解酶试验Fig.3 Hydrolase production test of Bacillus velezensisA:蛋白酶选择性平板; B:脂肪酶选择性平板; C:淀粉酶选择性平板; D:纤维素酶选择性平板A:Protease selective plate; B:Lipase selective plate; C:Amylase selective plate; D:Cellulase selective plate

图4 贝莱斯芽孢杆菌胞外水解酶活力Fig.4 Activity of extracellular hydrolase from Bacillus velezensis
2.5 抑菌试验 贝莱斯芽孢杆菌SW5菌株对几种常见细菌的抑菌试验结果如表3所示,贝莱斯芽孢杆菌SW5菌株的菌体悬浮液对所有抑制对象均无抑菌能力,而其发酵液和发酵上清液则对金黄色葡萄球菌、大肠埃希菌、肠沙门菌、蜡样芽孢杆菌、铜绿假单胞菌均具有抑制能力,其中,对金黄色葡萄球菌的抑菌能力最强,其次是大肠埃希菌。因此,贝莱斯芽孢杆菌SW5菌株对革兰阳性菌和阴性菌均具有抑制作用,并且对肠沙门菌、铜绿假单胞菌等都具有抑菌能力,因此,可考虑将贝莱斯芽孢杆菌SW5菌株应用于食品或饲料的防腐。

表3 贝莱斯芽孢杆菌抑菌试验Table 3 Antibacterial test of Bacillus velezensis
2.6 抗生素敏感试验 本试验选择了青霉素、四环素、新霉素、氯霉素和链霉素等10种常见的抗生素药敏片对贝莱斯芽孢杆菌SW5菌株进行抗生素敏感性测试。结果如图5和表4所示,贝莱斯芽孢杆菌SW5菌株对上述10种抗生素均敏感,其中对链霉素的敏感性最强,链霉素对贝莱斯芽孢杆菌的抑菌圈直径达36 mm。因此,推测贝莱斯芽孢杆菌SW5菌株未携带抗生素抗性基因,因此贝莱斯芽孢杆菌在实际应用中可以较好地避免抗药基因的转移,具有良好的生物安全性。

表4 不同抗生素对贝莱斯芽孢杆菌的抑菌圈直径Table 4 Diameter of inhibition zone of different antibiotics on Bacillus velezensis
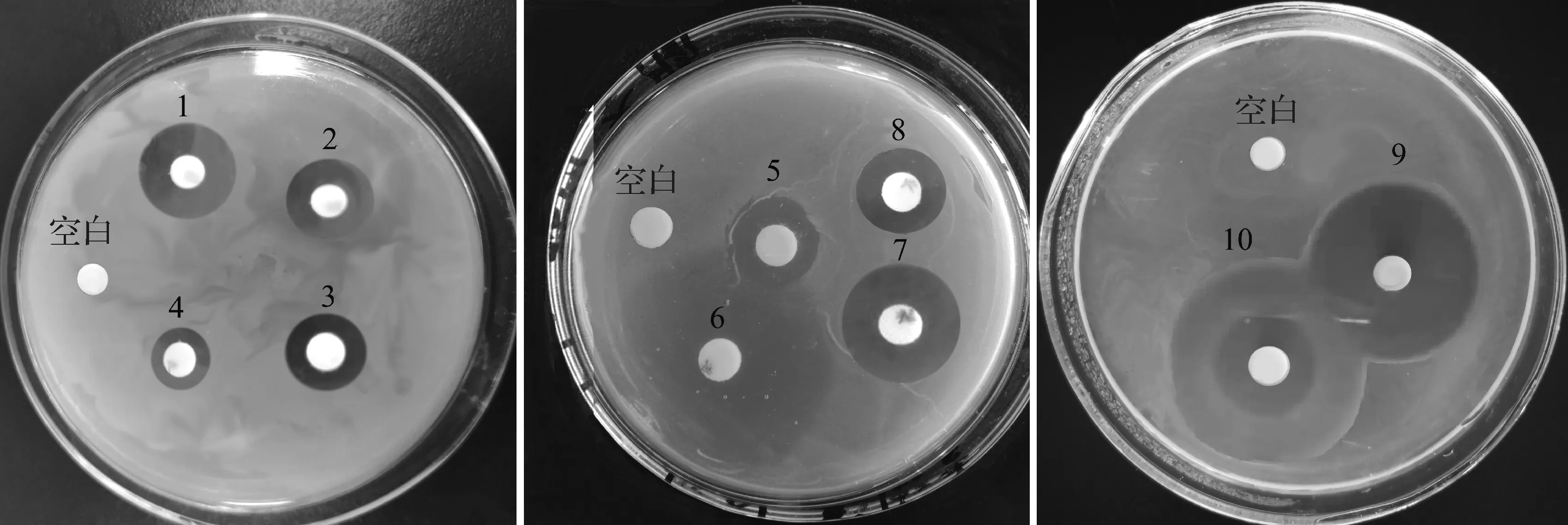
图5 贝莱斯芽孢杆菌的抗生素敏感性Fig.5 Sensitivity of Bacillus velezensis to antibiotics1~4:分别为青霉素、四环素、新霉素和甲硝唑; 5~8:分别为氯霉素、链霉素、多西环素和红霉素; 9~10:分别为头孢拉定和阿米卡星1-4:Penicillin,tetracycline,neomycin and metronidazol, respectively; 5-8:Chloramphenicol,streptomycin,doxycycline and erythromycin,respectively; 9-10:Cefradine and amikacin,respectively
3 讨论
益生菌通过动物胃肠道时会受到多种消化酶的抑制,从而降低益生菌的存活率,其中胃蛋白酶和胰蛋白酶对益生菌的影响最为显著[16]。白聪豪等[17]研究显示,在胃蛋白酶质量分数为0.5%的模拟胃液中处理3 h后,保加利亚乳杆菌的存活率下降至46.34%。焦苗苗等[18]研究了纳豆芽孢杆菌在胃肠道环境下的抗逆性,结果表明,纳豆芽孢杆菌在人工胃液中作用1~2 h时,活菌数下降了1个数量级。益生菌在肠道中需至少保持106CFU/mL的活菌数时方能较好地发挥其益生作用[19]。在本试验中,贝莱斯芽孢杆菌SW5菌株的芽孢在含有不同质量浓度胃蛋白酶和胰蛋白酶的模拟胃液和模拟肠液中处理3 h后,其菌落形成单位数均始终维持在108CFU/mL以上,显示了其良好的耐消化酶特性。胆盐是由肝细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而形成的钠盐或钾盐,它是胆汁中参与脂肪消化和吸收的主要成分,同时还可对穿过肠道的外源微生物发挥抑制作用。胆盐具有两亲性,一方面对细菌细胞膜具有较高的亲和力,另一方面通过发挥其表面活性剂作用,破坏细菌的细胞结构[20]。因此,能否抵抗一定浓度的胆盐,同样是选择益生菌的一个重要标准。动物肠道消化液中胆盐的质量浓度通常为0.03%~0.30%,贝莱斯芽孢杆菌SW5菌株的芽孢在0.30%的胆盐溶液中处理3 h后,其存活率仍可达到65.19%,显示了其对胆盐较强的抵抗力。骆海龙等[21]对细菌适应胆盐胁迫的机制进行了综述,认为细菌可通过形成生物膜、修复受损的蛋白质、调整能量代谢途径与方式、修复与维持细胞膜完整性,利用特定的泵出系统将进入细菌细胞内的胆盐成分排至胞外等产生对胆盐的抵抗能力。细菌芽孢较营养细胞具有更强的耐热性,因此,芽孢杆菌类益生菌的芽孢常可耐受较高的饲料加工温度。目前,饲料加工的常见温度是85 ℃ 左右,本试验中,贝莱斯芽孢杆菌的芽孢在85 ℃ 下处理30 min后,其存活率仍可保持在72.8%。刘超齐等[22]研究表明,枯草芽孢杆菌在80 ℃下处理30 min后,其存活率只有对照组的29%,当温度达到90 ℃,其存活率几乎为0,而在本试验中,芽孢存活率在100 ℃时仍能维持9.4%,推测是因为前者试验中所采用的试验对象以营养细胞为主,而本试验中所采用的则是细菌芽孢,芽孢的耐热性本就显著大于营养细胞,而芽孢杆菌类益生菌在加工和使用过程中,通常是以其芽孢为对象的。已有研究表明,贝莱斯芽孢杆菌作为益生菌可增强罗非鱼对病原菌的抵抗力,改善猪粪便菌群结构等[23-24],但是目前关于该菌种对胃肠道消化环境和高温的耐受能力尚未见相关报道。本试验结果表明,贝莱斯芽孢杆菌芽孢对模拟胃液、模拟肠液、高浓度胆盐、高温等环境均具有良好的抵抗能力,既可抵御较高的加工温度,又能以较高的存活率通过胃肠消化道。
通常,芽孢杆菌能够产生多种水解酶类,当它们在肠道定植后,通过分泌的各类水解酶帮助宿主消化吸收,从而提高营养物质消化率,促进动物生长发育。窦春萌等[25]从凡纳滨对虾肠道内筛选到11株芽孢杆菌,发现它们均有产蛋白酶、淀粉酶和脂肪酶的能力。Lin等[26]以产蛋白酶、淀粉酶等多种水解酶的枯草芽孢杆菌对牛蛙进行添加饲喂,结果发现,蛋白质、钙和磷的表观消化系数显著提高。孔庆娟等[27]的研究表明,日粮添加0.5×106CFU/g枯草芽孢杆菌和0.5×107CFU/g乳杆菌可以提高断奶仔兔肠道有益菌群数量、营养物质消化率、盲肠发酵、饲料效率和生长性能。目前已有研究表明,贝莱斯芽孢杆菌能够产生淀粉酶、脂肪酶、纤维素酶、蛋白酶等[28-29]。本试验中的定性和定量测定结果均表明贝莱斯芽孢杆菌SW5菌株能够产生淀粉酶、蛋白酶、纤维素酶和脂肪酶,其发酵上清液中上述4种粗酶活力分别为67.80、53.90、23.24 U/mL和10.30 U/mL,这与前人的研究结果相符。说明贝莱斯芽孢杆菌作为益生菌应用,将有望促进饲料中多种营养物质的消化吸收,提高饲料的消化利用率。
2002年联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)/联合国世界卫生组织(Worl Health Organization,WHO) 公布的《食品益生菌评价指南》中提出,益生菌代谢产物要有有效的抑菌活性[30]。目前,关于贝莱斯芽孢杆菌对病原微生物拮抗能力的报道,多数是以真菌作为拮抗对象,关于贝莱斯芽孢杆菌抑制细菌的相关报道尚不多见。张海林等[31]的研究表明,贝莱斯芽孢杆菌PL-2菌株可产生一种分子量大约10 kDa的细菌素,该细菌素对金黄色葡萄球菌、铜绿假单胞菌、痢疾志贺菌具有较好的抑制活性,而对大肠埃希菌则无抑菌活性。本试验结果则显示,贝莱斯芽孢杆菌SW5菌株对金黄色葡萄球菌、大肠埃希菌、肠沙门菌、枯草芽孢杆菌、蜡样芽孢杆菌、铜绿假单胞菌均具有抑制能力,这与张海林等[31]的研究结果有一定出入,或许是贝莱斯芽孢杆菌不同来源菌株之间的遗传差异所造成的,也可能是因为本试验与张海林等[31]的研究中所使用的大肠埃希菌的菌株差异造成的。但是,本试验和张海林等[31]的研究结果均表明,贝莱斯芽孢杆菌具有对金黄色葡萄球菌、铜绿假单胞菌的抑制能力。
优良的益生菌还应具有较好的生物安全性,例如不携带抗生素的抗性基因。本试验测试了贝莱斯芽孢杆菌SW5菌株对10种常见抗生素的敏感性,结果显示,该菌株对青霉素、四环素、新霉素、氯霉素、链霉素等10种常见的抗生素均敏感,因此,推测贝莱斯芽孢杆菌SW5菌株不存在抗生素抗性基因扩散的风险。高艳侠[23]研究表明,分离自健康罗非鱼肠道的贝莱斯芽孢杆菌对青霉素等27种抗生素敏感,仅对杆菌肽耐药。张小波等[32]的研究发现,分离自发病花边鸭内脏的贝莱斯芽孢杆菌对红霉素等18种常见抗生素敏感,对多黏菌素B、苯唑西林、氨苄西林、头孢他啶、青霉素、羧苄西林6种抗生素耐药。推测不同的贝莱斯芽孢杆菌菌株在抗生素敏感性方面的差异,可能与其不同的分离来源有关,这尚需更多试验数据的验证。
综上,贝莱斯芽孢杆菌的芽孢在高温、高浓度胆盐、模拟胃液和模拟肠液等不良环境下具有较高的存活率,因此推测可以在加工和使用过程中经受各种极端环境的压力,从而以较高的存活率到达肠道定植。定性和定量试验结果均表明,贝莱斯芽孢杆菌可产生淀粉酶、蛋白酶、脂肪酶、纤维素酶等多种水解酶,在使用中有望促进饲料在肠道中的消化和吸收。抑菌试验结果表明,贝莱斯芽孢杆菌对大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌等多种革兰阳性和阴性细菌具有拮抗能力。抗生素药敏试验结果表明,贝莱斯芽孢杆菌对多种常见抗生素均敏感,具有良好的生物安全性。因此,贝莱斯芽孢杆菌具有良好的益生特性,值得作为益生菌候选菌种加以进一步的深入研究。

