磁性微球免疫层析试纸快速检测牛奶中恩诺沙星和环丙沙星
刘 畅 , 杨琳燕 , 张 伟 , 宋翠平 , 赵思俊 , 李道稳 , 李留安 , 王宏宇 , 李 存
(1. 天津农学院动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室 , 天津 西青 300392 ;2. 中国动物卫生与流行病学中心 , 山东 青岛 266032)
恩诺沙星属于氟喹诺酮类药物,是动物专用的抗菌药,环丙沙星是恩诺沙星的主要代谢产物,二者的结构如图1所示[1-3]。恩诺沙星的抗菌谱广,在畜禽和水产养殖中应用广泛[4-5],但药物不规范使用造成的食品、环境中的药物残留可能引起消费者的胃肠道反应、过敏反应或其他毒性作用,而且会增强病原菌的耐药性,严重影响动物疾病的防治和食品的安全[6-9]。因此,亟需建立一种简便、准确的分析食品中恩诺沙星残留的方法。
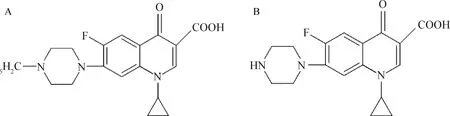
图1 恩诺沙星(A)和环丙沙星(B)的化学结构[1-3]Fig.1 Chemical structure of enrofloxacin (A) and ciprofloxacin (B)[1-3]
20世纪70年代,Faulk等开创了胶体金在免疫分析领域应用的先河,之后有学者将此方法应用到人绒毛膜促性腺激素(Human chorionic gonadotropin,HCG)的检测,胶体金免疫层析技术逐渐发展起来[10]。近年来,磁性微球作为一种新型标志物受到越来越广泛的关注。磁性微球常以Fe3O4作为磁性内核,但Fe3O4容易被氧化为Fe2O3,变为褐色或红棕色。氧化程度不同的磁性微球,其颜色存在差异。磁性微球具有理想标志物应有的许多特征,能够通过简单的手段与生物分子形成稳定的结合物,适用于多种待测物的分析检测,并且存在技术上的潜在革新。修饰后的磁性微球对待测物表现出良好的吸附性能,能够满足待测物的检测需要[11-12]。陈璐萍等[12]建立了一种磁性免疫层析试纸条,通过单纯的肉眼观察即可实现哈维弧菌的检测。
因此,本试验旨在以磁性微球为标志物,以竞争性反应原理为基础,建立一种磁性微球免疫层析试纸,用于快速检测牛奶中的恩诺沙星和环丙沙星。
1 材料与方法
1.1 材料与设备 恩诺沙星(98.5%)和环丙沙星(92.3%),均购自Dr. Ehrensorfer GmbH (Augsburg,Germany); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、蔗糖、海藻糖、聚乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP)、牛血清白蛋白(Bovine serum albumin,BSA)、吐温-20和BCA蛋白浓度测定试剂盒,均购自北京索莱宝科技有限公司(中国,北京);抗喹诺酮类单克隆抗体和山羊抗小鼠IgG,均购自北京维德维康生物科技有限公司(中国,北京);羧基化的磁性微球,购自佰迈格生物技术有限公司(中国,无锡)。
NC膜(Vivid 90)、共轭垫(GL-0194)、样品垫(GL-b02)、吸水垫和聚氯乙烯(Polyvinyl chloride,PVC)底板,均购自上海杰一生物科技有限公司(中国,上海);喷金划膜仪(HGS510)和可编程切条机(HGS201),均购自杭州峰航科技有限公司(中国,杭州)。
1.2 磁性微球标记抗体的制备 本试验选择了表面含有羧基的磁性微球,参照参考文献[13-14]中的方法用EDC活化并偶联抗体。分别使用10、20、40 μg和60 μg的抗体进行偶联,对抗体的用量进行优化。首先,取400 μL 磁性微球,用2-(N-吗啉)乙磺酸[2-(N-morpholine) ethanesulfonic acid,MES] 缓冲液洗涤3次,在外磁场的作用下分离,弃去上清液。加入5 mg/mL EDC和10 mg/mL NHS,在30 ℃ 180 r/min的条件下活化25 min。活化完成后,用磷酸钠溶液(0.15 mol/L,pH 7.2)洗涤2次,去除未反应的EDC和NHS。随后快速加入一定量的单抗,在30 ℃ 180 r/min的条件下反应,使抗体与磁性微球偶联。反应2~4 h后,将上清液转移到干净的离心管中用于计算偶联率,用终浓度2%的BSA封闭30 min,PBST(0.01 mol/L,pH 7.2,含0.05%吐温-20)洗涤3次,最后用PBS(0.01 mol/L,含0.3% BSA和0.01% NaN3)复溶,4 ℃保存备用。用BCA蛋白浓度测定试剂盒分别测定偶联前后单抗溶液的浓度,按公式(1)计算偶联率,从而确定单抗是否成功地与磁性微球偶联,并确定最适的抗体用量。

(1)
1.3 磁性微球免疫层析试纸的构建和条件优化 首先,对抗原的包被浓度进行优化。NC膜上羊抗鼠IgG的包被浓度固定为0.8 mg/mL,抗原的浓度分别为0.2、0.4、0.6、0.8 mg/mL和1.0 mg/mL,以1 μL/cm的速度分别划线,45 ℃鼓风干燥2 h。磁性微球标记抗体用BS缓冲液(0.05 mol/L,pH 9.0,含10%蔗糖、5%海藻糖、0.1%PVP、1%吐温-20和2%NaCl)稀释后分配到共轭垫上,25 ℃干燥30 min。样品垫用PB缓冲液(0.05 mol/L,pH 7.4,含0.1%PVP和4%吐温-20)浸泡处理1 h,37 ℃环境下干燥[15-18]。之后将NC膜、共轭垫、样品垫和吸水纸按照次序依次组装到PVC底板上。切成3 mm宽的条状,密封保存,备用。
随后,对羊抗鼠IgG的包被浓度进行优化。在最适的抗原包被浓度下,将羊抗鼠IgG的包被浓度分别设置为0.2、0.4、0.6、0.8 mg/mL和1.0 mg/mL,以1 μL/cm的速度分别划线,45 ℃干燥2 h。磁性微球标记抗体用BS缓冲液(0.05 mol/L,pH 9.0,含10%蔗糖、5%海藻糖、0.1%PVP、1%吐温-20和2%NaCl)稀释后分配到共轭垫上,25 ℃干燥30 min。样品垫用PB缓冲液(0.05 mol/L,pH 7.4,含0.1%PVP和4%吐温-20)浸泡处理1 h,37 ℃环境下干燥。之后将NC膜、共轭垫、样品垫和吸水纸按照次序依次组装到PVC底板上。切成3 mm宽的条状,密封保存,备用。通过上述方法选择最适的抗原和羊抗鼠IgG包被浓度,构建磁性微球免疫层析试纸并进行后续试验。
1.4 方法性能分析
1.4.1 灵敏度和基质耐受性分析 用0.02 mol/L PB缓冲液(pH 7.4)和基质添加标准溶液验证该方法的灵敏度和基质耐受性[19]。取10 mg的恩诺沙星和环丙沙星标准品,分别配成100 μg/mL的高浓度储备液,置于4 ℃保存。分析前用0.02 mol/L PB缓冲液(pH 7.4)将高浓度储备液依次稀释至0.5、1、2、5、10、20 ng/mL和50 ng/mL的工作浓度。
牛奶样品购自当地超市,经超高效液相色谱-串联质谱法(Ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)分析不含待测物。牛奶用4 mL酸化乙腈提取,8 000 g离心10 min,将上清液转移至干净的离心管中,加入4 mL正己烷除脂。50 ℃旋转蒸发至近干,少量乙腈复溶,用0.02 mol/L PB缓冲液(pH 7.4)稀释10倍[20]。在处理后的牛奶样品中分别添加终浓度为0.5、1、2、5、10、20 ng/mL和50 ng/mL的待测药物。
用磁性微球免疫层析试纸对上述2种溶液进行测定,用Image J软件(Version 1.52v)分析试纸颜色强度的变化,记录检测线(Test line,T线)和质控线(Control line,C线)的颜色强度的比值随待测药物浓度的变化趋势,并以T/C值为纵坐标,药物浓度的log函数为横坐标,拟合标准曲线,得到对应的线性方程[21]。计算阴性样本T/C信号的平均值加上2倍标准差对应的目标分析物的浓度,将该浓度定义为本方法的检测限[16]。
1.4.2 添加回收率的计算 在牛奶样品中分别添加一定量的恩诺沙星和环丙沙星,之后按照1.4.1中的方法,用酸化乙腈和正己烷进行预处理,并使稀释后恩诺沙星和环丙沙星的终浓度分别为2、5 ng/mL和10 ng/mL。用磁性微球免疫层析试纸进行分析,计算添加回收率。
1.4.3 交叉反应性分析 对氟甲喹、诺氟沙星、沙拉沙星进行分析,评价该方法对其他药物的交叉反应性。取上述药物的标准溶液,用0.02 mol/L PB缓冲液稀释至0.5、1、2、5、10、20 ng/mL和50 ng/mL,用磁性微球免疫层析试纸进行测定。根据颜色强度和浓度的关系,拟合标准曲线并计算各个药物的半抑制浓度(Half-inhibitory concentration,IC50),按公式(2)计算交叉反应率(Cross reactivity,CR)。
(2)
2 结果
2.1 磁性微球标记抗体的鉴定与抗体用量的优化 用BCA蛋白浓度测定试剂盒分别测定偶联前和偶联后单抗溶液的浓度,采用OriginPro 2017软件对数据进行统计学分析,与偶联前相比,偶联后的溶液中单抗含量显著降低(P<0.05),说明单抗已经偶联到磁性微球表面。
为了确定磁性微球与抗体的最佳投料比,本试验对比了抗体的用量为10、20、40 μg和60 μg时对应的偶联率和实际参与偶联的抗体的量,结果见图2。偶联率随单抗浓度的增加而下降;偶联到磁性微球表面的单抗的量在40 μg时达到最大,为24.73 μg,单抗的添加量增加至60 μg时,偶联到磁性微球表面的抗体反而减少,为19.97 μg。因此,在后续的试验中,添加40 μg抗体与磁性微球偶联。
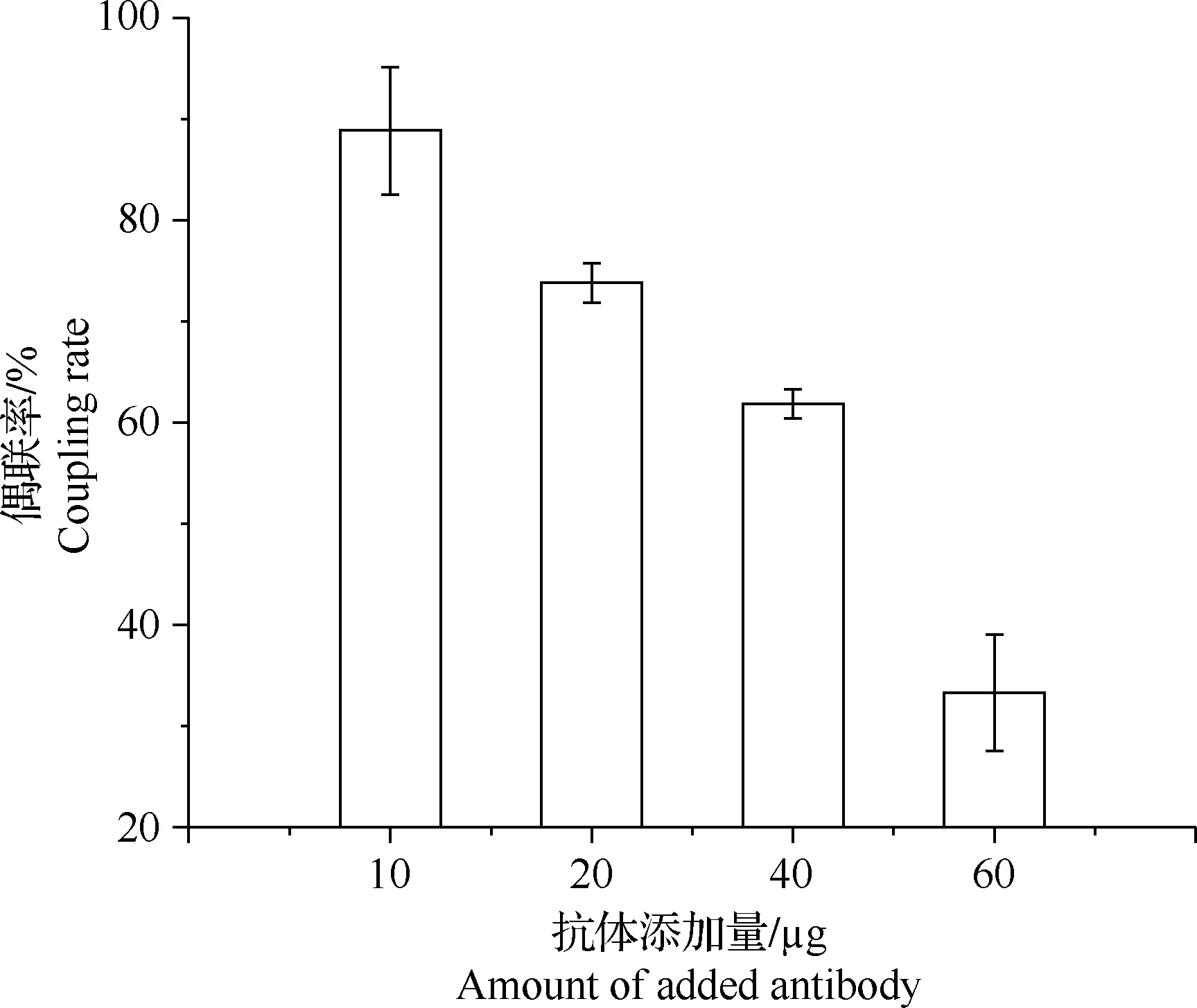
图2 单抗在磁性微球表面的偶联率与偶联抗体量的关系Fig.2 Relationship between quantity and coupling rate of monoclonal antibody to magnetic microspheres
2.2 磁性微球免疫层析试纸的构建和条件优化 NC膜上不同包被浓度的抗原对结果的影响见图3A。抗原浓度较低时,随着抗原浓度的增大,T线颜色逐渐加深,到0.8 mg/mL时T线颜色最深;继续增大抗原浓度至1 mg/mL,T线颜色不再加深。因此,确定0.8 mg/mL为最适的抗原包被浓度。
羊抗鼠IgG的包被浓度对结果的影响见图3B。随着羊抗鼠IgG浓度的增大,C线颜色逐渐加深,在0.8 mg/mL时C线与T线的颜色强度相当。如果C线上羊抗鼠IgG的包被浓度偏高,会抑制T线的显色。因此,确定0.8 mg/mL为最适的羊抗鼠IgG包被浓度。
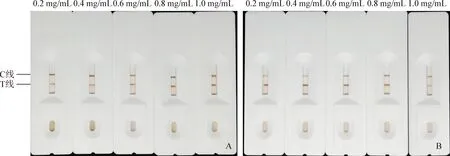
图3 免疫层析试纸条件优化Fig.3 Optimization of magnetic microsphere immunochromatography test strip conditionA:T线上抗原包被浓度的优化; B:C线上羊抗鼠IgG包被浓度的优化A: Optimization of antigen coating concentration on T line; B: Optimization of goat-anti-mouse coating concentration IgG on C line
2.3 方法性能分析
2.3.1 灵敏度和基质耐受性分析 恩诺沙星和环丙沙星的T/C值随浓度的变化趋势如图4A和图4B所示,曲线呈倒S形,T/C值随浓度的升高而降低。在0.5~20 ng/mL范围内,恩诺沙星和环丙沙星的T/C值与浓度的log函数之间表现出相关性,标准曲线见图4C,其中恩诺沙星的线性方程为y=1.122 9-0.791 1×log(c恩诺沙星+1),R2=0.998 2,环丙沙星的线性方程为y=1.135 1-0.883 0×log(c环丙沙星+1),R2=0.958 9。本试验将阴性样本T/C信号的平均值加上2倍标准差对应的目标分析物的浓度定义为方法的检测限。计算出恩诺沙星的检测限为0.37 ng/mL,环丙沙星的检测限为0.23 ng/mL。
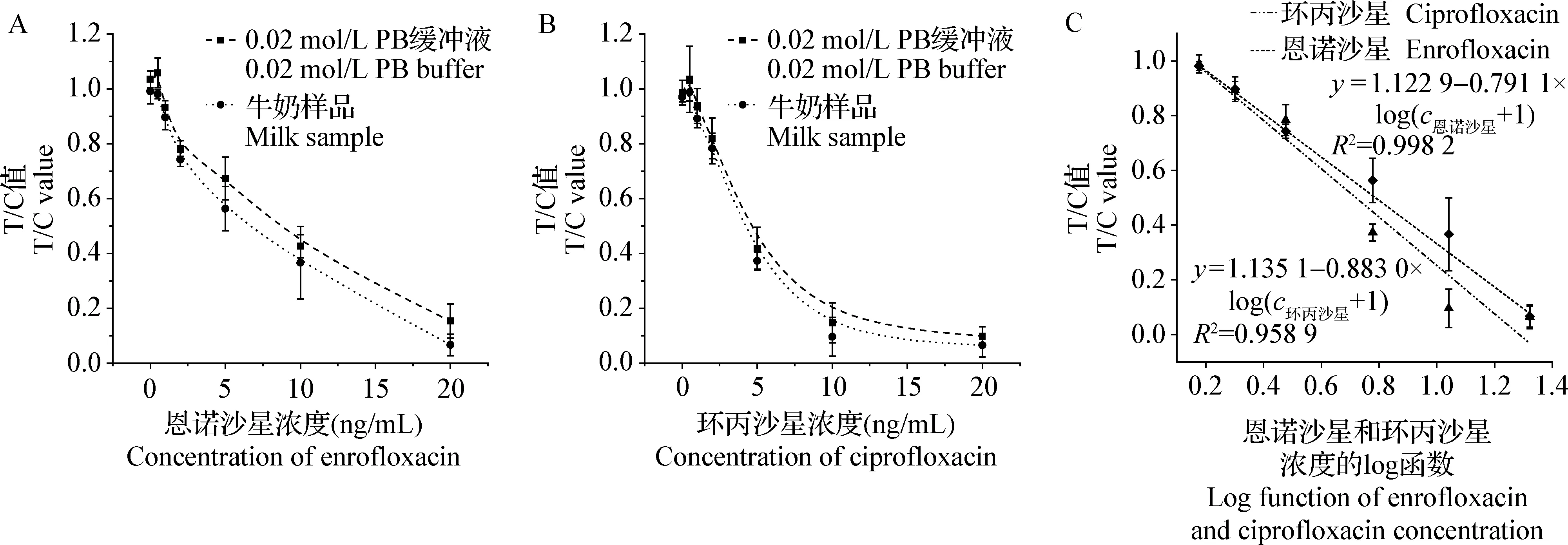
图4 恩诺沙星和环丙沙星的T/C值随浓度的变化曲线及标准曲线Fig.4 Tendency of T/C values with concentration and standard curves of enrofloxacin and ciprofloxacin
基质添加标准曲线与PB缓冲液稀释的标准曲线的相关性分析见图5,二者具有较好的相关性(恩诺沙星和环丙沙星对应的R2分别为0.995 1和0.999 9),说明该方法对基质的耐受性较好。

图5 PB缓冲液和基质添加标准溶液分析恩诺沙星(A)和环丙沙星(B)的相关性Fig.5 Correlation between PB buffer and matrix spiked standard solution of enrofloxacin (A) and ciprofloxacin (B)
2.3.2 添加回收率的计算 牛奶样品中成分复杂,有必要在检测前对牛奶样品进行预处理。分析前对样品进行恰当的预处理能帮助除去样品基质中的待测物,降低复杂成分对结果的干扰。本方法依次对低、中、高3个水平的药物进行了分析,添加回收率见表1。该方法对恩诺沙星的回收率为14.63%~30.56%,对环丙沙星的回收率在19.65%~49.81%。
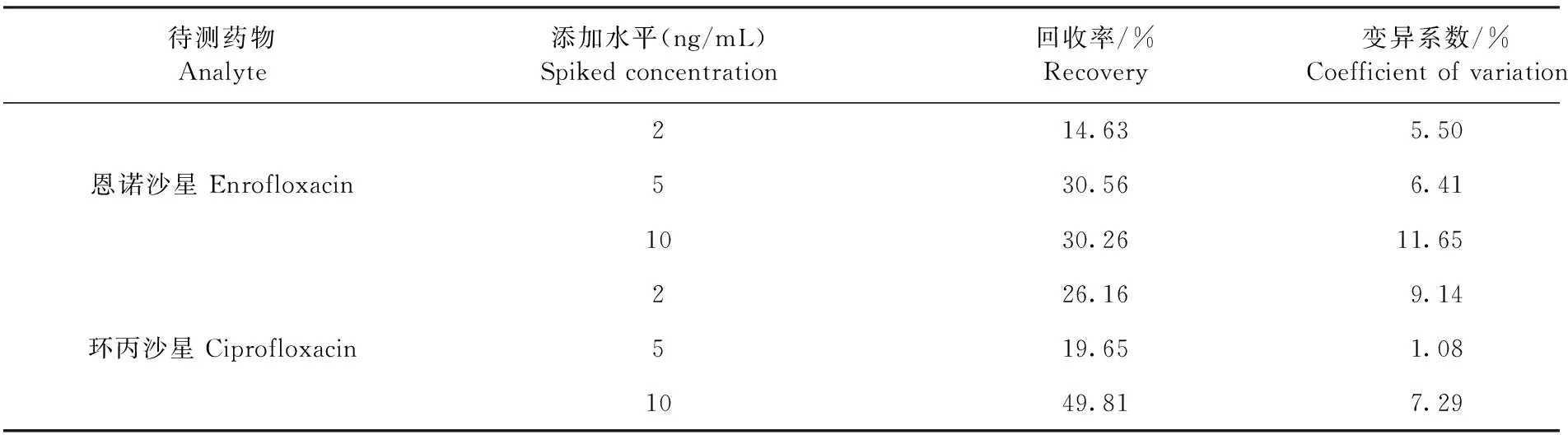
表1 磁性微球免疫层析试纸对恩诺沙星和环丙沙星的添加回收率Table 1 Spiked recovery of enrofloxacin and ciprofloxacin by magnetic immunochromatography test strip
2.3.3 交叉反应性分析 几种喹诺酮类药物的IC50和CR见表2。磁性微球免疫层析试纸对氟甲喹和诺氟沙星的IC50分别为3.03 ng/mL和3.33 ng/mL,CR分别为141.13%和128.66%。对于沙拉沙星的反应交叉率较低,仅为23.21%。

表2 磁性微球免疫层析试纸对几种喹诺酮类药物的交叉反应率Table 2 Cross reactivity of magnetic microsphere immunochromatographic test strip for several quinolones
3 讨论
本试验基于间接竞争的原理,将药物分子与NC膜上的包被抗原竞争结合标记抗体,因此NC膜上的信号强度与待测物含量成反比,通过记录NC膜表面的颜色强度并进行灰度分析,对溶液中的恩诺沙星或环丙沙星进行定量检测。这种方法比肉眼观察更灵敏,结果更客观,但基于可见光的分析方法一般只能采集NC膜表面(约10 μm厚)的信号。另一方面,该磁性微球免疫层析试纸还可以根据磁信号进行分析,磁信号属于穿透信号,磁信号分析设备可以处理整个NC膜厚度的磁信号[19],能够满足高灵敏度和定量检测的需求。但目前商品化的磁信号分析设备仍不普遍,磁信号分析设备的便携性和成本限制了定量设备的推广和应用;而且免疫层析方法的变异系数较大,这也给定量分析增加了难度。
本试验用磁性微球作为信号标志物构建了一种免疫层析快速检测试纸,该试纸能够对喹诺酮类药物进行定性,或者对某种已知的喹诺酮类药物进行定量分析。该方法对于牛奶中恩诺沙星和环丙沙星的检测限分别为0.37 ng/mL和0.23 ng/mL。同时该方法表现出较好的基质耐受性,基质添加溶液与标准溶液具有较高的相关性,添加回收率的范围在14.63%~49.81%。该磁性微球免疫层析试纸可推广到动物性食品中其他兽药、毒素或致病菌的测定,为食品质量安全提供有力的技术支撑。

