陈皮-半夏药对治疗高脂血症作用机制的网络药理学分析与实验研究
张 理
高脂血症(hyperlipidemia)是一种常见病,是人体内脂蛋白代谢异常进而引起一系列症状的疾病[1]。血脂异常会增加血液黏稠度,引起动脉粥样硬化,危害冠状动脉及脑血管,对心、脑、肾等器官有巨大危害,临床上常引起冠状动脉性心脏病、脑梗死、高血压、脂肪肝等疾病[2-3]。2012年—2015年在我国东中西部年龄≥35岁人群血脂异常患病率为 34.7%,高三酰甘油血症、高总胆固醇血症、低高密度脂蛋白胆固醇血症、高低密度脂蛋白胆固醇血症的患病率分别为 14.1%、7.5%、19.2%和6.0%,并且这一数据呈现逐年上升趋势,而血脂异常知晓率、治疗率和控制率均较低,故血脂异常的防治工作亟待加强[4]。目前西医治疗常用的降血脂药物有5 类,分别为他汀类、贝特类、烟酸类、胆酸螯合剂和胆固醇吸收抑制剂等[5]。西药在控制血脂异常上具有很大的局限性,如由于他汀类药物不耐受常引起肌溶解和肝损伤事件[6]。故向传统医药中寻求治疗高脂血症的安全而有效的药物越来越受到重视[7]。中医药学中并无高脂血症这一病名,《灵枢·五癃津液别》云:“五谷之津液和合而为膏者,内渗入于骨空,补益脑髓,而下流于阴股”,此处所言膏脂即与现代医学所言“脂质”类似,故一般将其归属于“眩晕”“胸痹”“痰浊”“血瘀”的范畴[8]。中医体质学辨识研究表明,血脂异常与痰湿体质密切相关[9]。陈皮、半夏是经典方剂二陈汤的主要组成部分,具有燥湿化痰、理气和中之功效,是临床治疗高脂血症的常用药对。研究表明,以陈皮、半夏为主要组成的方剂能够有效改善脂肪酸的代谢,起到降低血脂的作用[10-11]。由于中药成分的复杂性及作用靶点的不确定性,目前针对陈皮-半夏药对治疗高脂血症的确切机制尚不清楚。因此,本研究借助网络药理学的方法,从整体策略出发以探讨陈皮-半夏药对治疗高脂血症的作用机制,并采用分子对接技术对相关结果进行验证,为后续中医药治疗及基础研究提供一定帮助。
1 资料与方法
1.1 核心药物有效成分及靶点获取 将陈皮、半夏逐次输入到中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcms-pw.com/tcmsp.php)[12],根据ADME原则[13],设置口服生物利用度(OB)≥30%,类药性(DL)≥0.18 进行筛选,得到核心药物有效成分及作用靶点。得到靶点的同时,在TCMSP中检索并得到有效成分的结构式,以MOL2格式保存。将上述靶点导入到UniProt[14]网站(https://www.uniprot.org/)进行基因映射(Gene Mapping)以获取相应靶点的基因组。
1.2 疾病-药物共同靶基因的获取 在人类基因数据库 GeneCards[15-16](https://genecards.weizmann.ac.il/v3/)和MalaCards[17](https://www.malacards.org/)中以“hyperlipidemia”为关键词进行检索,获取冠心病的靶基因,将上述药物靶基因与疾病靶基因导入到Draw Venn Diagram网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)中绘制韦恩图,并得到疾病-药物共同靶基因。
1.3 关键靶点蛋白-蛋白相互作用(PPI)网络的构建 将上述疾病-药物共同靶基因导入到STRING网站[18](https://string—db.org/)中,选取物种为“Homo sapiens”,得到靶点蛋白之间的相互作用关系。导出蛋白质互作网络文件后,利用Cytoscape软件[19]优化图形,并根据度值获取PPI网络[20]中排名前10位的关键基因(Hub Gene)。
1.4 基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析 将疾病-药物共同基因导入到David数据库中,选择物种为“Homo sapiens”进行GO富集分析[21]与KEGG信号通路富集分析[22]。并获取与高脂血症密切相关的信号通路作用路径图。将上述结果分别导入到“微生信”网站(http://www.bioinformatics.com.cn)进行相关结果及数据的可视化操作。
1.6 分子对接验证 Discovery Studio(DS,V2016)是新一代的分子模拟软件,采用CDOCKER模块的动力学方法随机搜索小分子构象,随后采用模拟退火的方法将各个构象在受体活性位点区域进行优化[23-24]。在国内外高脂血症的专家共识或指南中,他汀类药物[3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂]都被推荐为一线治疗药物[25-26]。因此,本研究利用Discovery Studio(DS,V2016)对陈皮-半夏有效成分与HMG-CoA还原酶(HMG-CoA reductase)进行分子对接实验,并以瑞舒伐他汀(rosuvastatin)作为对照。具体方法:①在DrugBank网站(https://www.drugbank.ca/)上以关键词“rosuvastatin”进行检索以获取瑞舒伐他汀的结构式,保存为MOL2格式,与1.1中的药物有效成分一起导入到Open Babel GUI软件中转换为一个MOL2文件集。②在RCSB PDB网站(https://www.rcsb.org/search)上以“HMG-CoA reductase”进行检索,分别获取β1受体与β2受体的PDB结构式。③将上述配体导入到DS软件中,利用“prepare ligands”功能进行配体准备。同时对受体进行去除Water、Lagands Groups以及无关的侧链等,点击Receptor-Ligand Interactions>Define and Edit Binding Site >From Receptor Cavities在蛋白空腔中寻找有潜力的活性位点。④利用CDOCKER功能进行分子对接,并根据-CDOCKER _ INTERACTION _ ENERGY(负分子对接结合能)获取每组对接分子中得分最好的分子构象并进行排名。分子对接构象的负分子对接结合能越大,则结合构想越稳定,反映受体分子与配体之间结合的可能性越大。
1.7 动物实验验证
1.7.1 实验药物及试剂 陈皮、半夏购自河南中医药大学第一附属医院中药饮片室,经科室专业人员鉴定为合格药品。陈皮、半夏等比例混合并在100 ℃下煎煮30 min,取过滤液,配制成1 mL含生药2 g的浓缩液。总 胆 固 醇 ( total cholesterol,TC)、三 酰 甘 油 (triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)生化检测试剂均购自中生北控生物科技股份有限公司;蛋白激酶B1(AKT1)、丝裂原活化蛋白激酶3(MAPK3)、肿瘤抑制蛋白p53(TP53)、Jun原癌基因(JUN)、血管内皮生长因子A(VEGFA)、过氧化物酶体激活受体γ(PPARG)、丝裂原活化蛋白激酶8(MAPK8)、前列腺素内过氧化物合酶2(PTGS2)、胱天蛋白酶3(CASP3)、过氧化氢酶(CAT)蛋白抗体均购自广州左克生物科技发展有限公司。
1.7.2 实验动物分组及干预 无特定病原体(SPF)级雄性大鼠30只,体质量(200±20)g,适应性饲养1周后随机分为对照组、模型组、药物组,每组10只。实验动物供清洁自来水和标准饲料,自由进食和饮水,室内环境温度为22~24 ℃,湿度为50%~60%,12 h明暗交替循环(07:00~19:00)。除对照组外,其余两组按照参考文献中方法给予高脂饲料喂养8周后转化为高脂血症大鼠模型。各组给药干预,对照组和模型组分别灌胃等剂量的生理盐水,剂量为 10 mL/kg,按人体表面积计算,药物组灌胃10 g/kg 陈皮-半夏汤剂,干预1周。 末次灌胃给药后12 h,取10%水合氯醛按腹腔注射麻醉大鼠,称取大鼠体脂量行内眦静脉丛取血,并分离肝脏,用于检测。本研究方案已通过河南中医药大学实验动物伦理委员会审核并批准,并在实验过程中严格遵守动物伦理学3R原则。
1.7.3 肝脏指数测定及病理变化比较 分离仓鼠的肝脏后称取质量,按公式计算肝脏指数:肝脏指数=肝脏质量/体质量×100%。取新鲜肝脏组织切片,行苏木精-伊红(HE)染色以观察不同组间肝脏组织病理学变化。
1.7.4 生化检测 内眦静脉丛血以3 000 r/min离心10 min后取上清液,以全自动化仪检测血清TG、TC、HDL-C、LDL-C水平。检测过程中严格按照试剂盒说明书操作。
1.7.5 蛋白质免疫印迹法(Western Blot)检测相关蛋白 取肝组织于冰上剪碎后、裂解,蛋白质定量(BCA)法测定蛋白浓度,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电压设置为80 V、30 min和110 V、60 min,根据Maker的移动情况,终止电泳。用醋纤维素转膜,加入稀释一抗,4 ℃孵育过夜,TBST洗膜3次后加入辣根过氧化物酶(HRP)标记的二抗中反应2 h,再用 TBST 洗膜3次,加增强型化学发光试剂(ECL)显示剂显色,暗室胶片曝光。使用Western Blot法检测肝脏组织中蛋白表达情况,初步验证富集分析结果。使用Image J软件对蛋白条带进行量化处理,目标蛋白表达量通过β-actin校正。
浮选尾矿熔炼合金100 g,熔炼中还原剂配比为尾矿干基20%,真空度为102 Pa,温度1 000~1 100 ℃,蒸馏45~90 min,浮选尾矿熔炼合金各组分分析结果见表3,试验结果见表4。

2 结 果
2.1 核心药物的有效成分及靶标 从TCMSP网站共得到陈皮有效成分5个、半夏有效成分13个,详见表1。再将上述有效成分分别输入到TCMSP网站再次检索,得到有效成分作用靶点,去重后共计123个,然后再将这些靶点导入到UniProt网站转化为相应的基因Symbol。

表1 陈皮-半夏药对有效成分
2.2 疾病-药物共同靶基因 从GeneCards网站获取到高血压病靶基因1 389个,将疾病与药物靶点导入到Draw Venn Diagram网站进行韦恩图分析,得到疾病-药物共同靶基因69个。详见图1。
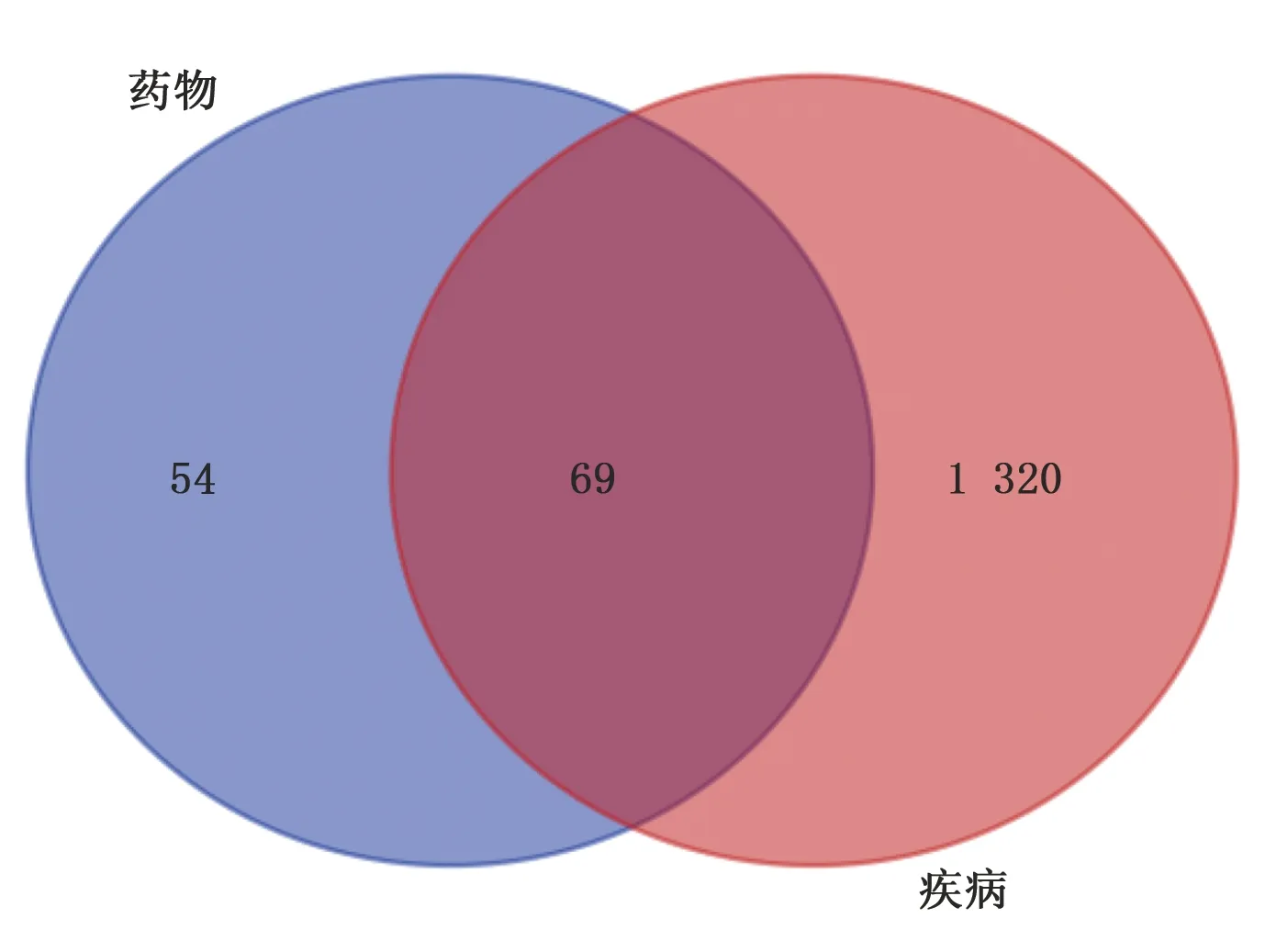
图1 陈皮-半夏药对与高脂血症交集基因Venn图
2.3 关键靶点PPI网络 将上述69个共同基因导入到STRING数据库后得到关键PPI网络图(见图2)。在PPI网络中,靶点以节点显示,以边相连接,关键靶点的边更加密集,节点也就越大,表示在PPI网络所起到的作用就越重要。将PPI网络以TSV格式保存后,利用Cytoscape软件中的Hub插件,根据度值得到排名前10位的Hub基因(核心基因),详见图3。
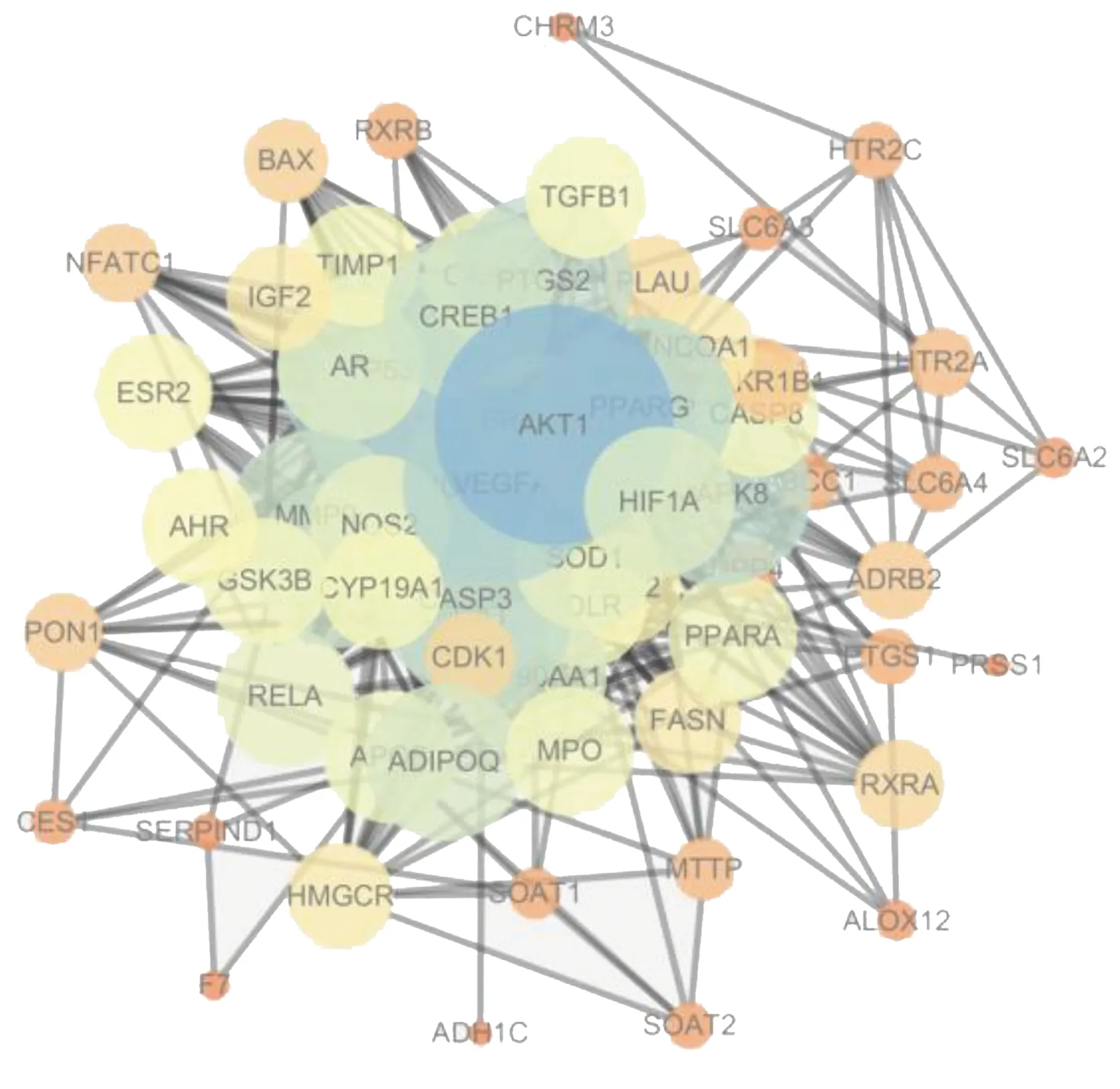
图2 疾病-药物交集基因PPI网络
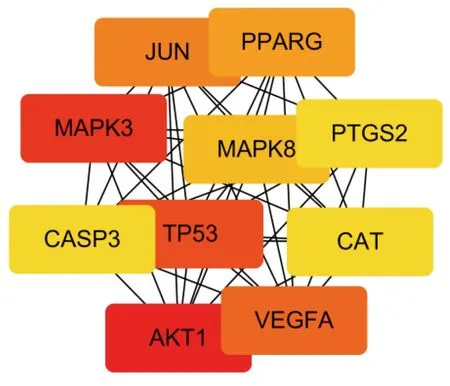
图3 根据PPI网络得到的Hub基因
2.4 GO富集分析与KEGG通路富集分析 将上述疾病-药物交集靶基因导入到David数据库进行GO富集分析,包括3个方面,即生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF),详见图4。KEGG富集分析主要涉及癌症相关信号通路(pathways in cancer)、乙型肝炎信号通路(hepatitis B)、非酒精性脂肪肝信号通路(non-alcoholic fatty liver disease,NAFLD)、肿瘤坏死因子(TNF)信号通路(TNF signaling pathway)、甲状腺激素信号通路(thyroid hormone signaling pathway)、脂肪细胞因子信号通路(adipocytokine signaling pathway)等,详见图5。其中与高脂血症密切相关的非酒精性脂肪肝信号通路作用路径详见图6,图中红色五角星代表药物靶点。
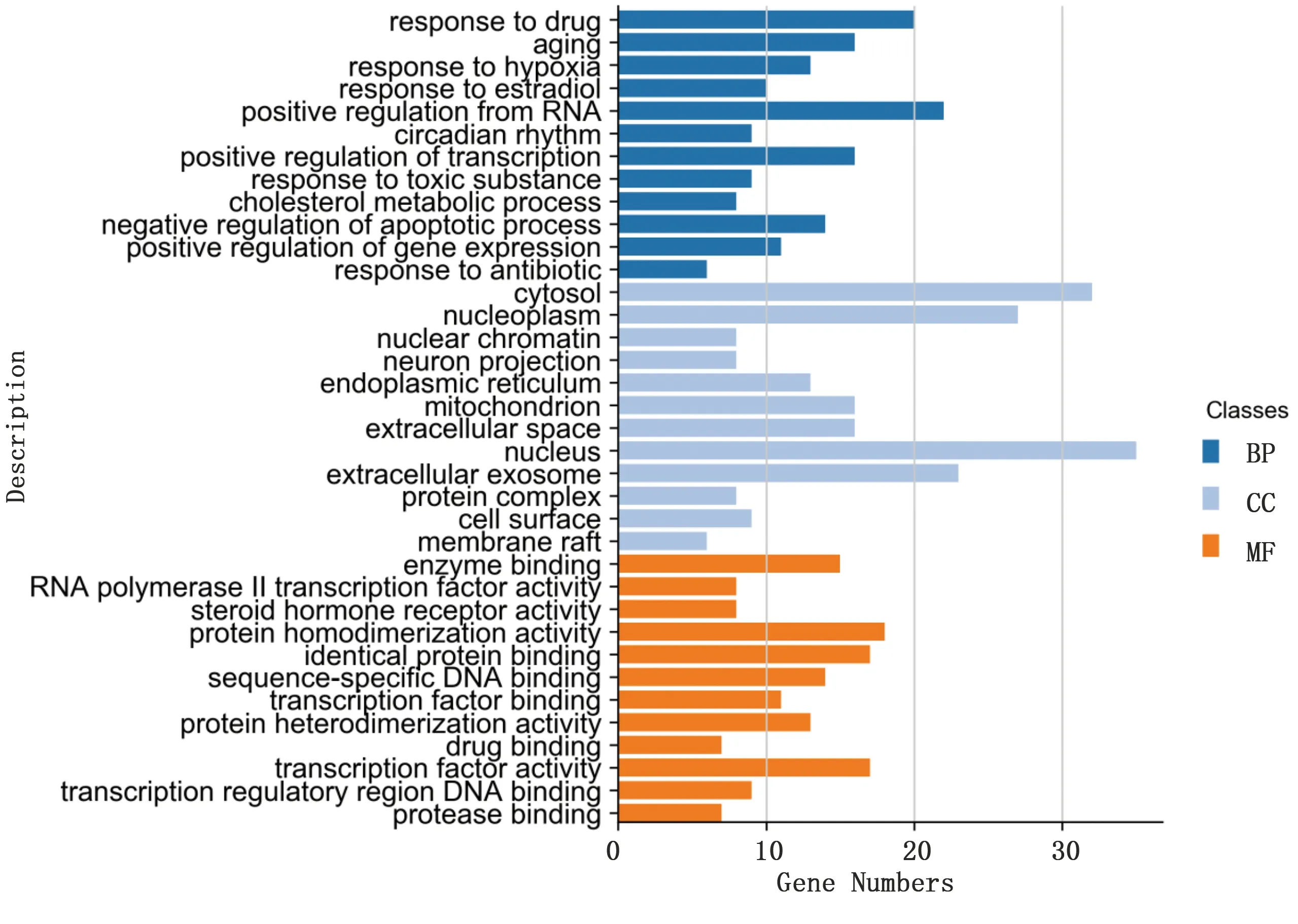
图4 GO富集分析结果
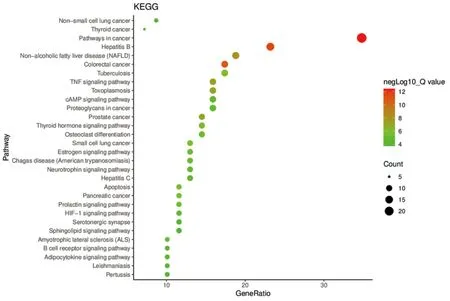
图5 KEGG信号通路富集分析结果
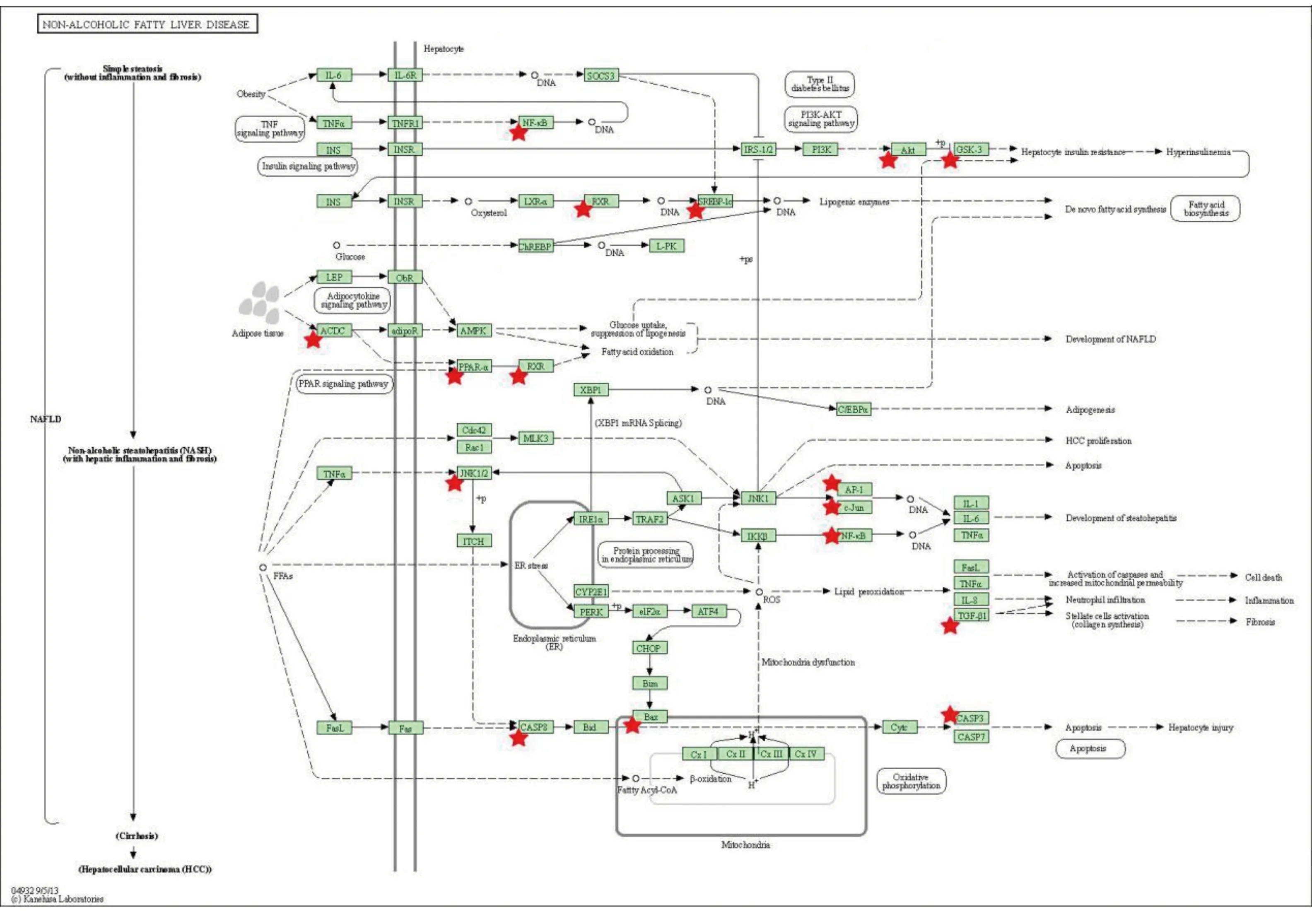
图6 非酒精性脂肪肝信号通路作用图
2.5 陈皮-半夏药对成分-靶点-通路网络分析 为了更清晰地展现陈皮-半夏药对成分、靶点与通路之间的关系,使用 Cytoscape 软件构建通路-活性成分-核心靶点网络(见图 7)。网络图包含节点与边,白色节点代表药物有效成分,绿色节点代表中药名称,黄色节点代表靶基因,红色节点代表信号通路。网络图可以直观展示出陈皮-半夏具有通过多成分、多靶点、多通路相互协调作用于高脂血症的特点。
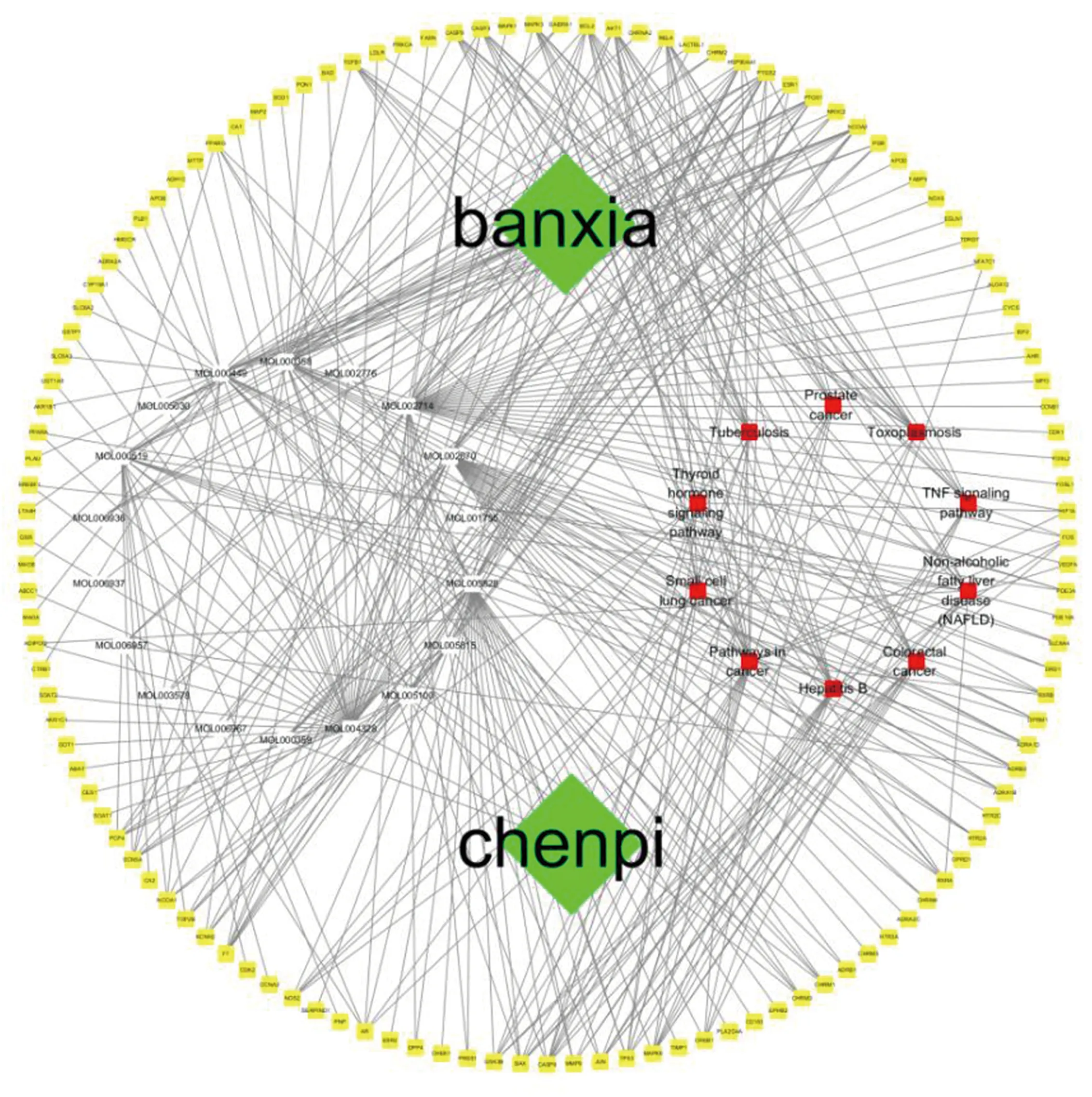
图7 陈皮-半夏药对成分-靶点-信号通路网络图
2.6 分子对接验证结果 根据分子对接方法进行分子验证,得到HMG-CoA还原酶分子对接构象180个。每组分子对接结果取负分子对接结合能分值最高的,共得到18个对接结果,排名前10位的包括MOL005828、MOL002776、MOL006937、MOL005815、446157(rosuvastatin)、MOL000359、MOL003578、MOL005030、MOL000358、MOL001755。对结果进行可视化,得到分析热图(Heatmap),详见图8。其中排名前6位的结合构象以3D图及2D图展示(见图9)。在3D图中可见配体与靶蛋白结合的具体位置关系,而在2D图中可见配体与靶蛋白形成的作用力类型及结合位点(氨基酸、残基等)。
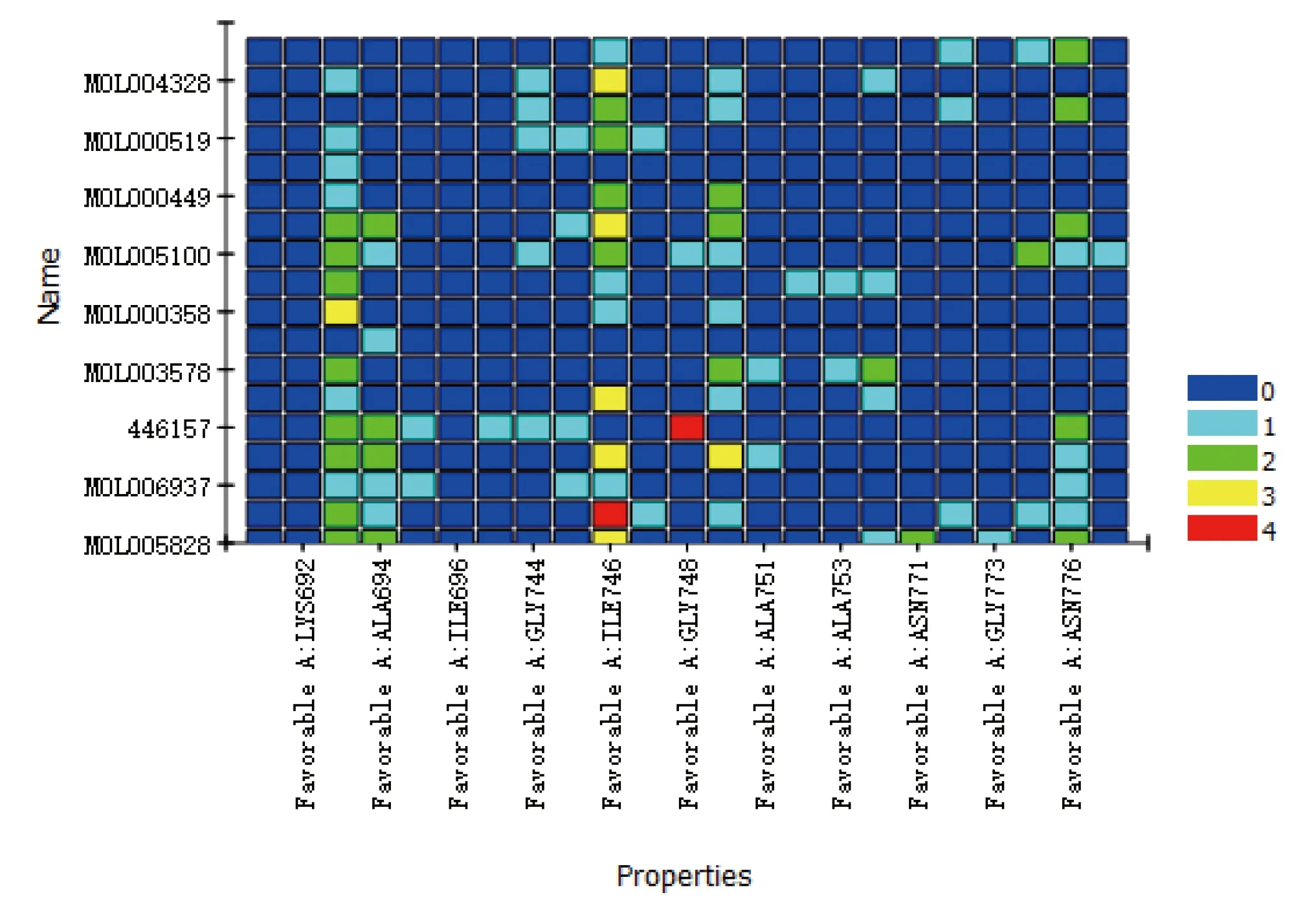
图8 全部分子对接结果热图分析

图9 配体-靶蛋白对接模式3D图及2D图(A&a为MOL005828与HMG-CoA还原酶对接结果;B&b为 MOL002776与HMG-CoA还原酶对接结果;C&c为MOL006937与HMG-CoA还原酶对接结果;D&d为 MOL005815与HMG-CoA还原酶对接结果;E&e为瑞舒伐他汀与HMG-CoA还原酶对接结果;F&f为MOL000359与HMG-CoA还原酶对接结果)
2.7 动物实验结果
2.7.1 陈皮-半夏对大鼠体质量及肝脏指数影响 3组小鼠基础体质量一致,造模后,模型组大鼠体态较对照组臃肿,行动迟缓且不喜活动,体质量及肝脏指数明显偏大,差异均有统计学意义(P<0.05)。药物组体质量、肝脏指数较模型组明显降低,差异均有统计学意义(P<0.05)。详见表2。
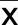
表2 3组大鼠体质量及肝脏指数比较(±s)
2.7.2 3组大鼠肝脏组织病理学变化比较 对照组可见肝细胞排列整齐,结构正常,无炎性浸润和坏死;模型组可见肝细胞排列紊乱,脂肪细胞空泡样变性及脂质沉积,出现明显炎性浸润和坏死灶;药物组可见脂肪浸润和少量脂肪细胞空泡,肝细胞炎性浸润和坏死灶显著减轻。详见图10。
图10 各组大鼠肝组织病理学变化
2.7.3 陈皮-半夏对血脂水平影响 模型组TG、TC、LDL-C较对照组明显升高,HDL-C较对照组明显降低,差异均有统计学意义(P<0.05);药物组TG、TC、LDL-C较模型组明显降低,HDL-C较模型组明显升高,差异均有统计学意义(P<0.05)。提示陈皮-半夏药对可以有效降低高脂血症大鼠血液TG、TC、LDL-C水平,升高HDL-C水平。详见图11。

*与对照组比较,P<0.05;#与模型组比较,P<0.05。图11 3组血清TG、TC、HDL-C、LDL-C水平比较
2.7.4 陈皮-半夏对目标基因蛋白表达量的影响 与对照组比较,模型组肝脏组织中AKT1、VEGFA、PPARG蛋白表达量明显降低,而MAPK3、TP53、JUN、MAPK8、PTGS2、CASP3蛋白表达量明显升高,差异均有统计学意义(P<0.05)。与模型组比较,药物组肝脏组织中AKT1、VEGFA、PPARG蛋白表达量明显升高,而MAPK3、TP53、JUN、MAPK8、PTGS2、CASP3蛋白表达量明显降低,差异均有统计学意义(P<0.05)。动物实验结果与网络药理学分析结果基本吻合。详见表3、图12。
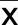
表3 3组Hub基因蛋白表达量比较(±s)
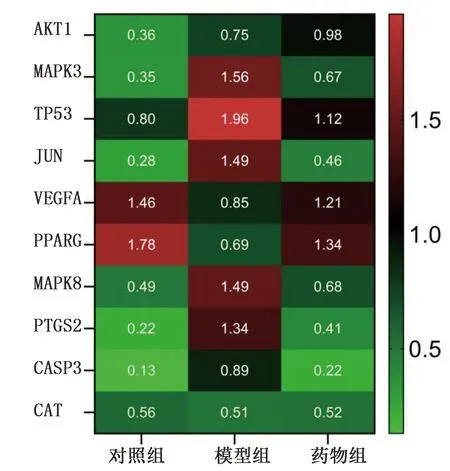
图12 各组大鼠肝脏Hub基因蛋白表达量热图
3 讨 论
基于整体观念,中医药在复杂疾病的治疗中具有一定的优势,然而中药治疗疾病具有多成分、多靶点、多通路的作用机制,限制了其进一步的发展与推广[27]。目前的还原主义研究策略仍然难以揭开这种整体医学的面纱[28]。网络药理学可以基于靶分子、生物功能和生物活性化合物生成复杂的相互作用网络,符合中医药的天然特性,并能从分子水平方面系统地阐明中医药的作用机制,逐渐成为中医药研究的一个具有光明前景的整体策略[29-30]。另外,在中药有效成分中发现,基于网络药理学的方法有望突破对跨多个信息层的药物作用的理解。网络药理学在细胞或表型网络的背景下考虑药物反应,是传统还原论研究方法的替代补充[31]。这种方法有效地弥合了现代医学与中医药之间的鸿沟,极大地促进了中医药协同作用的研究[32]。
TCMSP是中国药科大学基于中草药系统药理学框架建立的一种中药系统药理数据库和分析平台。通过ADME原则筛选,可以得到中药的有效成分及对应的靶点。陈皮与半夏中主要包含谷甾醇(sitosterol)、柠檬酸(citromitin)、川陈皮素(nobiletin)、黄芩苷(baicalin)、黄芩素(baicalein)等有效成分。研究表明谷甾醇在内的植物甾醇能够有效降低低密度脂蛋白含量,能有利改变脂质谱,达到抗血脂药物的功效,并具有良好的人体耐受性和安全性[33-34]。川陈皮素是具有重要生物学特性的多酚化合物,主要通过抑制肝脂肪酸合成和增加脂肪酸氧化来预防肝脏脂肪变性,从而起到降低血脂作用,同时还具有胰岛素增敏、降血压、抗炎及抑制动脉粥样硬化的特性[35]。动物实验表明,川陈皮素可以通过调节大鼠AdipoR1和gp91(phox)表达来减轻高脂饮食诱导的非酒精性脂肪肝疾病,也可以改善肥胖低密度脂蛋白受体基因敲除(LDLR-/-)小鼠的代谢综合征和动脉粥样硬化,干预甚至逆转肥胖症[36-37]。黄芩苷最早从中药黄芩中发现,可改善高脂饮食诱导的肠道微生态和异常代谢,减少由肠道菌群通过膳食纤维的发酵而产生短链脂肪酸,还可以调节SirT1 / STAT3途径并抑制肝葡萄糖过多产生[38-39]。可见,陈皮-半夏药对中的多种成分对血脂代谢有作用。
PPI网络主要考察靶蛋白之间的相互作用关系,在PPI网络中根据连接度值得到排名前10位的Hub基因为AKT1、MAPK3、TP53、JUN、VEGFA、PPARG、MAPK8、PTGS2、CASP3、CAT。AKT1的激活诱导细胞脂肪酸以及细胞膜磷酸甘油酯的浓度增加,还参与胰岛素介导的作用,例如脂肪生成、葡萄糖摄取以及葡萄糖转化为脂肪酸和胆固醇等过程,并具有明显抗动脉粥样硬化作用[40-41]。Heinonen等[42]通过比较腺病毒VEGFA基因转移对载脂蛋白E基因敲除(ApoE-/-)、LDLR-/-小鼠的动脉粥样硬化和脂蛋白的影响,发现VEGFA基因转移在所有模型中均引起脂蛋白分布的动脉粥样硬化改变。VEGFA转移还降低了脂蛋白脂肪酶(LPL)活性,这可能是所观察到的脂质分布变化的基础。长期以来,脂肪组织的生长被认为是有血管生成依赖性的,正常脂肪组织的功能依靠与血管在细胞因子、外泌体等方面的正常互动,而血管生成潜力不足被认定为脂肪组织功能障碍的“不祥三联征”之一[43]。Cardona 等[44]通过对74例代谢综合征病人口服60 g脂肪超负荷,然后测定TC、TG、HDL-C、载脂蛋白A1、载脂蛋白B、尿酸和尿酸排泄的基线浓度,发现代谢综合征病人中Pro12Ala PPARG序列变异体与餐后高脂血症的风险相关,表明PPARG与脂蛋白清除率的调节密切相关。
GO分析是基于分子效团的生物信息学工具,使用本体论代表生物学知识来提供有关基因产物功能的信息,并以结构化的方式用核心实体来表示生物学功能[45]。GO富集分析结果显示陈皮-半夏药对具有酶结合、RNA聚合酶Ⅱ转录因子调控、配体激活序列特异性DNA结合、类固醇激素受体结合等生物功能,主要涉及胞浆、核质、核染色质、内质网、线粒体等细胞组分,从而参与对药物的反应、老化、缺氧反应、胆固醇代谢过程、凋亡过程的负调控等生物过程。GO富集分析结果提示陈皮-半夏药对中能够从分子、细胞等多个层面干预血脂的代谢。KEGG是系统分析基因功能与基因组信息的数据库,整合了基因组学、生物化学和系统功能组学的信息,有助于研究者将基因及表达信息的过程作为一个网络进行整体研究。KEGG富集分析结果显示,陈皮-半夏药对除了可以直接通过非酒精性脂肪肝信号通路以外,还可以通过多个信号通路对血脂代谢起到协同作用。在非酒精性脂肪肝信号通路路径中,主要涉及ACDC、JUK、Akt、CASP3、CASP8等靶点,并与PI3K-AKT等信号通路形成交互关系,对血脂异常、血糖代谢障碍等在内的代谢综合征具有多路径干预作用,还可以介导细胞凋亡,以及协调免疫细胞浸润而起到抗炎作用。肝脏是人体脂质重要的代谢器官,肝炎发生常伴随脂质等物质的代谢异常,也会导致炎性因子等失衡。相反,陈皮-半夏药对有效成分也可能通过调节乙型肝炎信号通路来间接影响肝细胞的代谢状态,从而促进脂质代谢[46]。研究表明,巨噬细胞引起的代谢炎症和脂肪细胞-巨噬细胞相互作用在肥胖症中具有首要的重要性。脂肪细胞和巨噬细胞之间涉及游离脂肪酸和肿瘤坏死因子-α(TNF-α)旁分泌建立的恶性循环,加剧了脂肪组织中的炎症反应。此外,缺氧以及较高浓度的游离脂肪酸会加剧肥胖症中巨噬细胞介导的炎症反应。故陈皮-半夏药对有效成分很有可能通过TNF信号通路降低巨噬细胞介导的脂肪组织炎症反应,从而减少脂肪在人体局部的堆积[47]。另外,炎症、纤维化和血管生成受损被认定为脂肪组织功能障碍的“不祥三联征”。炎症和血管生成、重塑不当都可以驱动纤维化,进而促进免疫细胞向脂肪贮库的迁移,并阻碍进一步的血管生成[48]。如前所述,陈皮-半夏药对有效成分对炎症及血管生成均具有调节作用,故可以认为在TNF信号通路与血管内皮生长因子信号通路方面具有协同作用。大量临床观测及研究显示,人体甲状腺激素缺乏时常导致肥胖症及代谢综合征等[49]。目前,对于甲状腺激素的认识方面也早已转为治疗方面。相关研究表明谷甾醇可以刺激甲状腺激素的释放,而β-谷甾醇早已被相关指南推荐为治疗高脂血症的药物[50]。另外,陈皮-半夏药对的多种成分还可以通过多个靶点直接参与到脂肪细胞因子信号通路,对人体脂质的摄取、分布、代谢、排泄起到重要作用[51]。
分子对接技术是应用计算机模拟程序,通过定义结合位点来预测配体与目标蛋白质结合的可能性及空间构象[52-53]。基于分子对接技术,可以对成分-靶点-信号通路网络图中的有效成分与目标靶点进行模拟对接,并通过对相关结合参数及结合构象的分析,有助于具有临床潜力的有效成分发现及药物设计、前导优化等[54]。通过将陈皮-半夏有效成分与HMG-CoA还原酶进行分子对接,发现多种成分的对接构象优于或类似于瑞舒伐他汀,如川陈皮素、黄芩苷等。在结合位点上主要集中在TLE746、GLY748等,而作用力主要是以范德华力、氢键为主。分子对接结果证明陈皮-半夏药对有效成分能够通过与HMG-CoA还原酶结合,从而起到降低血脂的作用。
动物实验显示,陈皮-半夏药对可有效改善高脂血症大鼠血脂代谢情况,能明显降低其体质量及肝脏指数。肝脏组织病理切片观察结果显示,应用陈皮-半夏药对煎煮剂灌服后,大鼠肝脏组织炎症浸润及脂质沉积情况明显好转。Western Blot 实验显示陈皮-半夏能够明显升高AKT1、VEGFA、PPARG等蛋白表达量,并明显降低MAPK3、TP53、JUN、MAPK8、PTGS2、CASP3等蛋白表达量。表明陈皮-半夏药对可以通过降低相关炎性因子的表达,并促进脂代谢正调控蛋白的表达,从而起到降血脂作用,这与生物富集结果基本一致。
4 小 结
本研究通过网络药理学的方法探讨了陈皮-半夏药对中多种活性成分通过多靶点、多通路协同作用于高脂血症的网络机制,分子对接显示部分有效成分与HMG-CoA还原酶对接良好,发现陈皮-半夏药对中的川陈皮素、黄芩苷等有效成分是其发挥降脂作用的潜在分子基础。动物实验表明,陈皮-半夏对高脂血症小鼠血脂代谢有明显改善效果,并能有效调控大鼠肝脏相关基因的表达量。本项研究将为后续的中医药治疗及进一步的基础研究提供一定帮助。

