美罗培南不同给药途径对颅脑损伤术后颅内感染患者的影响
李 涛
(永城市人民医院神经外科,河南 永城 476600)
临床颅脑损伤患病率随着高能量创伤患者增加呈增加趋势发展,已成为神经外科常见创伤类型。颅内感染为该类病患常见且多发的严重并发症,可严重影响术后恢复效果,甚至会危及患者生命安全[1-2]。有数据显示,开颅术后颅内感染发生率为2.6%~30%,且症状较为复杂,是导致临床颅脑损伤患者死亡的主要危险因素[3]。临床主要通过药物进行抗感染治疗,有研究指出,美罗培南鞘内注射、静脉滴注能有效治疗颅脑外伤术后颅内感染,效果显著,且无严重不良反应[4]。基于此,本研究回顾性选取我院76例颅脑损伤术后颅内感染患者,旨在分析美罗培南双途径给药辅助治疗的效果,现报告如下。
1 资料与方法
1.1 一般资料:2017年10月至2020年4月回顾性选取我院76例颅脑损伤术后颅内感染患者,根据治疗方案不同进行分组,将接受美罗培南静脉滴注治疗的作为对照组(37例),将接受美罗培南静脉滴注联合脑室内注射治疗的作为观察组(39例)。对照组女15例,男22例,年龄23~66岁,平均(44.61±10.23)岁,急性生理与慢性健康评分(APACHEⅡ评分)10~18分,平均(14.23±1.69)分,格拉斯哥昏迷量表(GCS)评分7~14分,平均(10.36±1.58)分;观察组女17例,男22例,年龄23~66岁,平均(45.36±9.84)岁,APACHEⅡ评分10~18分,平均(14.81±1.54)分,GCS评分7~14分,平均(10.57±1.46)分。两组一般资料均衡可比(P>0.05)。
1.2 纳入及排除标准:纳入标准:均具有颅脑损伤史;均经脑脊液细菌培养确诊为颅内感染;颅内压>200mmH2O;脑膜刺激征呈阳性;术后均出现发热、呕吐、意识障碍等症状;无严重慢性器质性病变;药敏试验表明对美罗培南敏感。排除标准:脑室外未留置引流管;血流动力学不稳定;严重脏器功能障碍;合并晚期脑疝;本研究药物过敏;不能配合治疗或中途死亡。
1.3 方法
1.3.1 对照组:接受美罗培南静脉滴注治疗。1g美罗培南+0.9%氯化钠溶液100mL,经输液泵静脉滴注,每间隔6~8h给药1次。
1.3.2 观察组:接受美罗培南静脉滴注联合脑室内注射治疗。在对照组基础上,将20mg美罗培南+0.9%氯化钠溶液20mL经脑室外引流管泵入,1h内注入完毕,之后夹闭引流管,2h后开放,1~2次/d。
1.4 疗效评估标准:治愈:治疗3~7d后,体温恢复正常,脑膜刺激征呈阴性,脑脊液细菌培养呈阴性,生化指标检查恢复至正常参考范围;显效:治疗3~7d后,病情好转,脑膜刺激征呈阴性,脑脊液生化指标检查有1项未恢复至参考范围;有效:治疗3~7d后,病情改善,脑脊液生化指标检查至少有2项未恢复至参考范围;无效:未达到上述标准。总有效包括治愈、显效、有效。
1.5 观察指标:①比较两组疗效;②比较两组临床治疗情况,包括静脉用药时间、用药总量、脑室外引流管留置时间;③比较两组治疗前、治疗3d、5d、7d脑脊液生化指标水平,包括蛋白含量、白细胞计数、葡萄糖含量;④比较两组不良反应。
1.6 统计学分析:运用SPSS22.0软件对数据进行分析,计量资料以(±s)表示,采用t检验,计数资料[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 疗效:与对照组对比,观察组治疗总有效率较高(χ2=4.906,P=0.027),详见表1。
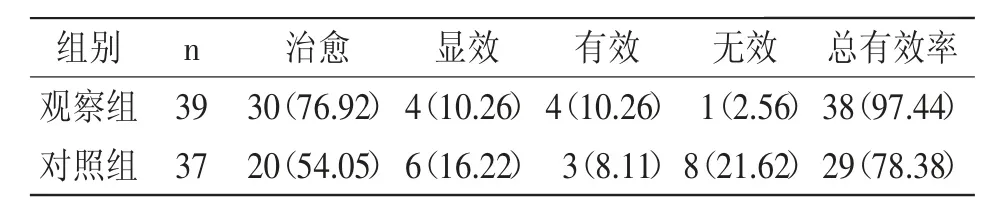
表1 两组疗效对比[n(%)]
2.2 临床治疗情况:观察组静脉用药及脑室外引流管留置时间较对照组短,用药总量较对照组少(P<0.05),详见表2。
表2 两组临床治疗情况对比(±s)
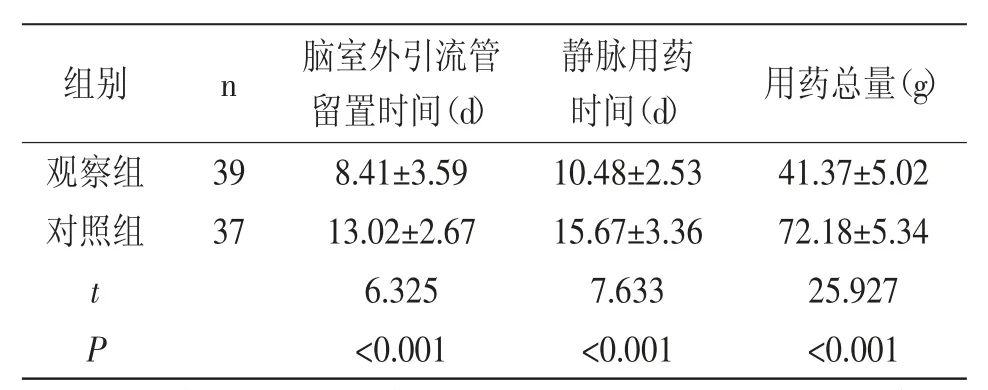
表2 两组临床治疗情况对比(±s)
组别 n 脑室外引流管留置时间(d)静脉用药时间(d) 用药总量(g)观察组 398.41±3.5910.48±2.5341.37±5.02对照组 3713.02±2.6715.67±3.3672.18±5.34 t 6.3257.63325.927 P<0.001 <0.001 <0.001
2.3 脑脊液生化指标水平:治疗3d、5d、7d,观察组蛋白含量、白细胞计数均较对照组低,葡萄糖含量均较对照组高(P<0.05),详见表3。
表3 两组脑脊液生化指标水平对比(±s)
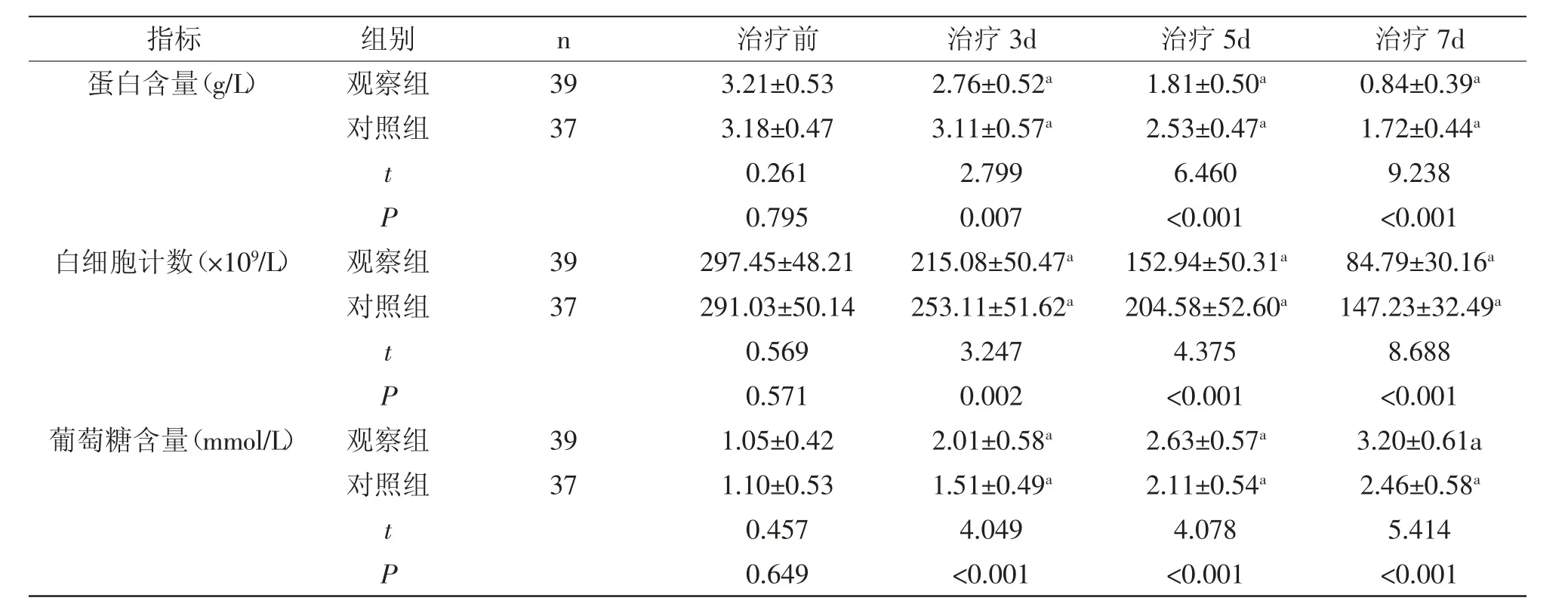
表3 两组脑脊液生化指标水平对比(±s)
注:与治疗前比较,aP<0.05
指标 组别 n 治疗前 治疗3d 治疗5d 治疗7d蛋白含量(g/L) 观察组 393.21±0.532.76±0.52a 1.81±0.50a 0.84±0.39a对照组 373.18±0.473.11±0.57a 2.53±0.47a 1.72±0.44a t 0.2612.7996.4609.238 P 0.7950.007 <0.001 <0.001白细胞计数(×109/L) 观察组 39297.45±48.21215.08±50.47a 152.94±50.31a 84.79±30.16a对照组 37291.03±50.14253.11±51.62a 204.58±52.60a 147.23±32.49a t 0.5693.2474.3758.688 P 0.5710.002 <0.001 <0.001葡萄糖含量(mmol/L) 观察组 391.05±0.422.01±0.58a 2.63±0.57a 3.20±0.61a对照组 371.10±0.531.51±0.49a 2.11±0.54a 2.46±0.58a 0.4574.0494.0785.414 P 0.649 <0.001 <0.001 <0.001 t
2.4 不良反应:对照组出现2例腹泻、2例皮疹、1例血小板计数减少,不良反应发生率为13.51%;观察组出现2例腹泻,不良反应发生率为5.13%。两组不良反应发生率对比差异无统计学意义(χ2=0.751,P=0.386)。
3 讨论
颅内感染为神经外科术后3~7d常见严重并发症,可严重降低手术预后效果。研究显示,革兰阳性菌为颅内感染常见细菌类型,主要包括金葡菌、肠球菌、表皮金葡菌等,且及时使用广谱性强的抗生素进行治疗是降低感染率的主要方法[5]。作为第二代人工合成类抗生素,美罗培南可抑制需氧革兰阳性菌等多种细菌,还能通过抑制细菌细胞壁合成,发挥抗菌效果。
想要药物发挥治疗作用,药物浓度在脑脊液中需达到致病菌最小抑菌浓度的50~100倍,而美罗培南静脉滴注后,不易透过血-脑脊液屏障,其透过率仅为6.4%,难以达到有效杀菌浓度,导致临床治疗效果欠佳。本研究在药敏试验后选取对美罗培南敏感的患者进行研究,结果显示观察组治疗总有效率高于对照组,且静脉用药及脑室外引流管留置时间短于对照组,用药总量少于对照组。在脑室内注射美罗培南可避免药物穿透血-脑脊液屏障的过程,直接、迅速作用于脑脊液中,且可在短期内有效达到血药浓度,产生杀菌作用,并配合静脉给药,能有效保持脑脊液药物浓度持续时间、血药稳定性,在提高治疗效果的基础上还能缩短治疗时间,减少药物使用剂量[6-8]。因此,颅脑损伤术后颅内感染患者接受美罗培南静脉滴注联合脑室内注射治疗,效果显著,能有效减少用药剂量,缩短静脉用药及脑室外引流管留置时间。
脑脊液中补体、抗体水平较低,免疫功能较弱,易出现病原菌入侵并定植于脑组织,引起颅内感染,且其富含多种营养物质,可造成致病菌大量繁殖,加重感染[9-10]。本研究数据结果还显示,观察组治疗3d、5d、7d的蛋白含量、白细胞计数均较对照组低,葡萄糖含量均较对照组高,表明颅脑损伤术后颅内感染患者接受美罗培南静脉滴注联合脑室内注射治疗,能调节脑脊液生化指标水平。另外,本研究还发现,两组不良反应发生率对比差异无统计学意义,说明美罗培南静脉滴注联合脑室内注射治疗颅脑损伤术后颅内感染,不会增加患者不良反应,安全性好。
综上所述,颅脑损伤术后颅内感染患者接受美罗培南静脉滴注联合脑室内注射治疗,效果显著,能有效减少用药剂量,缩短静脉用药及脑室外引流管留置时间,调节脑脊液生化指标水平,且不会增加不良反应。

