阿托伐他汀治疗改善脑出血患者近期神经功能的临床研究
孙一彤,任思颖,王丽琨,宋安军,毛远红,秦冠南,胡晓纯,李颖慧,李琦,伍国锋*
脑出血(intracerebral ihemorrhage,ICH)是脑卒中的第二大重要类型,是致命和难治的神经系统疾病[1,2]。ICH 占所有脑卒中的10%~30%,有着极高的致死率和致残率,其30 d死亡率约为30%~50%[3],只有不到20%的患者能够独立生活,因此改善ICH 患者的预后有重要的临床意义。ICH后继发性脑损伤是造成神经功能缺损的重要因素,但其损伤机制尚不完全明确,炎症反应可能是这一过程中的重要环节。因个体化差异,目前ICH急性期的治疗仍缺乏统一标准,关于治疗药物的研究也主要集中在止血和降压上,临床上缺乏有效的神经保护性药物[4]。他汀类药物是20世纪80年代后期研发的调脂类药物,近年来研究发现其除有调脂作用外,还有抗炎、抗氧化应激、改善内皮细胞功能、抑制血管平滑肌细胞增殖、抗血小板聚集、抑制血栓形成、减少心肌缺血和再灌注损伤、促进新生血管形成、稳定动脉粥样硬化斑块等作用,在缺血性脑血管病中具有神经保护作用[5,6]。他汀类药物的多效性,如抑制炎症和保护血脑屏障(blood-brain barrier,BBB),可改善急性出血性卒中患者的预后[7]。对于急性ICH 患者予以阿托伐他汀治疗,能有效改善临床症状,可抑制ICH脑水肿的形成,这与BBB 开放、降低基质金属蛋白酶(matrix metalloproteinase,MMP)水平有关[8],从而保护血管[9]。本研究观察阿托伐他汀对ICH患者血肿量及临床预后的影响,从而探讨ICH的有效治疗方案。
1 资料与方法
1.1 一般资料
纳入2018年8月1日至2019年1月31日于贵州医科大学附属医院急诊神经科住院的自发性ICH 患者,见图1。纳入标准:年龄≥18岁,根据临床表现和头颅CT诊断为自发性ICH;入院后24 h内给予阿托伐他汀治疗;ICH 前2 周未服用抗凝药物;无凝血功能障碍。记录患者的格拉斯哥昏迷量表(Glasgow coma scale,GCS)、美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、改良Rankin 量表评分(modified Rankin scale,mRS)。参照2015年脑出血诊治指南制定排除标准:继发性ICH:肿瘤、动静脉畸形(arteriovenous malformation,AVM)、脑梗死后出血性转化或动脉瘤;颅内血肿与外伤有关;抗凝剂相关的ICH;血小板计数<50×109/L;他汀类药物禁忌证、已知的不耐受或过敏;患者或家属拒绝使用。本研究已获得伦理委员会批准,患者参与前均由本人或其直系亲属知情同意。研究药物从我院急诊药房获得,本实验的设计、开展以及资料分析均与药物生产商无关。本研究的临床评分及影像学检查均为盲评,评估医师均经过标准化培训且不直接参与该临床试验。
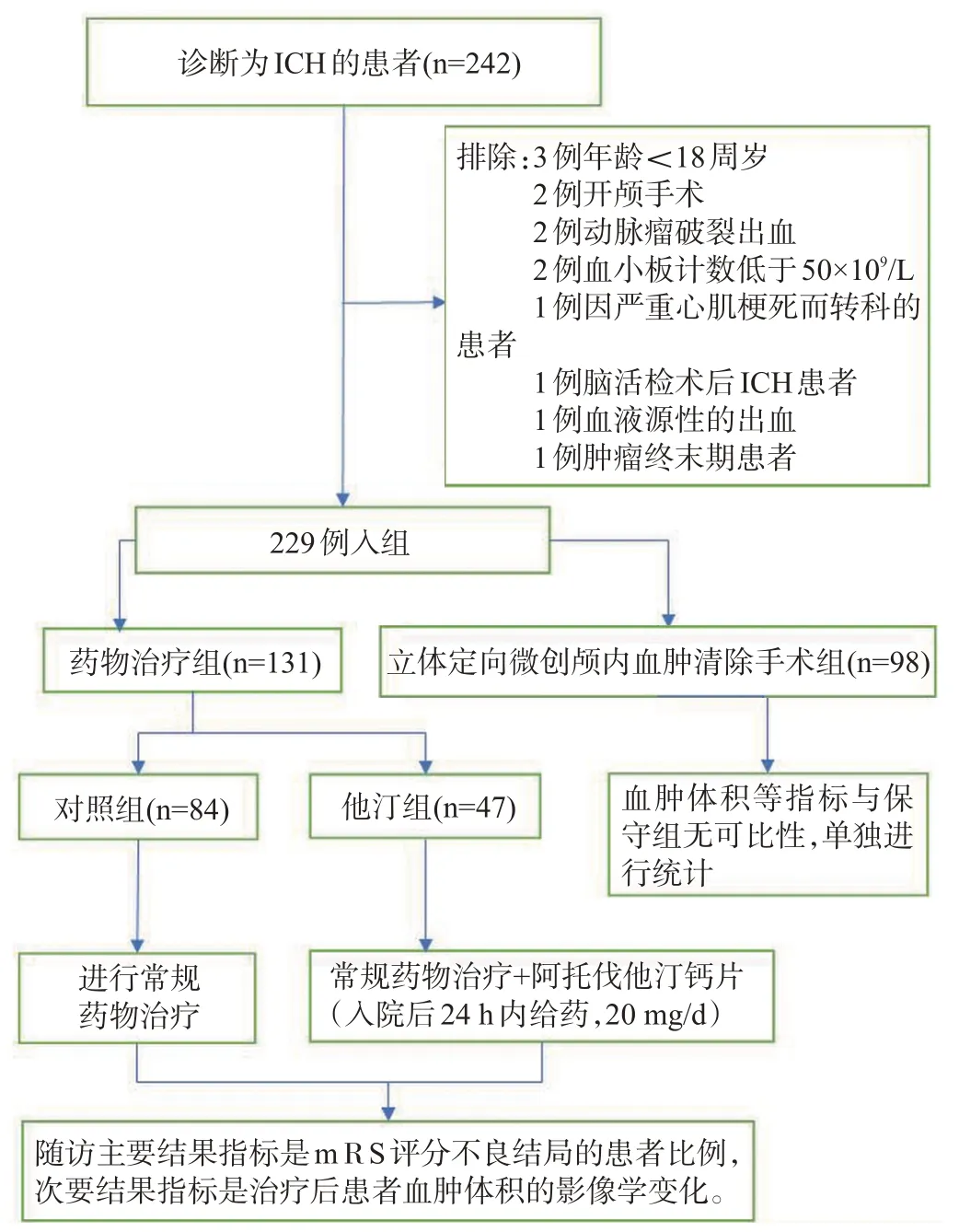
图1 根据纳入标准和排除标准的患者选择流程
1.2 方法
1.2.1 患者分组 纳入选择保守治疗的ICH 患者131例,分为对照组84例和他汀组47例。2组间基线资料比较,差异均无统计学意义(P>0.05),见表1。

表1 2组基线资料比较

表1 2组基线资料比较(续)
1.2.2 给药方法 根据以色列最大的医疗保健服务提供的数据库,使用阿托伐他汀平均每日剂量(the average atorvastatin equivalent daily dose,AAEDD)评估ICH 和他汀类药物之间的剂量-反应关系,AAEDD<10 mg/d 组 ICH 年发病率为 46.1/100 000,AAEDD 10~19.9 mg/d 组年发病率为 31.1/100 000,AAEDD≥20 mg/d 组年发病率为27.3/100 000,说明随着阿托伐他汀使用的增加,ICH的发病率降低[10]。阿托伐他汀说明书提示,用药剂量为10、20、40和80 mg的患者转氨酶异常的发生率分别为0.2%、0.2%、0.6%和2.3%。2006年具有里程碑意义的卒中预防及强化降脂治疗研究(Stroke Prevention by Aggressive Reduction in Cholesterol Levels,SPARCL)发现,强化他汀降脂治疗(阿托伐他汀80 mg/d)可导致ICH 发病的增加[11]。因此,本研究在尽可能保证安全性的前提下兼顾药物的有效性,将阿托伐他汀的剂量选择为20 mg/d。他汀组于ICH 入院后24 h 内开始予以阿托伐他汀钙片(辉瑞制药公司生产,商品名为“立普妥”,规格20 mg/片)20 mg治疗,此后按20 mg/d剂量继续服用阿托伐他汀治疗90 d;对照组发病后未予他汀治疗。所有患者同时予以控制血压和血糖等其他对症常规治疗,2组其他联合用药的种类、剂量、给药途径无差异。
1.3 观察指标及随访
患者均于入院后进行血常规、肝肾功能、随机血糖、电解质、凝血系列等实验室检查,记录人口统计学和临床特征。住院期间临床评分包括入院时GCS 评分、NIHSS 评分及发病前mRS 评分。入院进行头颅CT 扫描以诊断ICH,除死亡患者,尽量完善随访治疗后1周、2周、出院时的头颅CT。于发病90 d进行电话随访,观察并记录2 组mRS 评分评估患者残疾情况。同时随访观察各组药物的不良反应例如肝酶升高、过敏、肌酶升高、肌肉疼痛、横纹肌溶解等情况。
1.3.1 临床结局 采用mRS 评分评定发病后的神经功能缺损症状,主要结局指标是随机化后90 d mRS评分的序贯分析及不良结局的患者比例,不良结局定义为死亡(mRS 评分6 分)或重大残疾(mRS 评分3~5分)。mRS≤2分认为临床结局良好。次要结局指标是治疗后的患者血肿体积的影像学变化。CT计算血肿:血肿长径×血肿宽径×高度/2,其中血肿长径取CT片上血肿面积最大的层面中血肿的长径,血肿宽径为与血肿长径垂直的最大宽径,血肿高度以CT 层面计算,我院CT为3 mm一个层面,乘以层数,即为高度。
1.3.2 安全性 患者在试验期间如果出现由于服用阿托伐他汀而引起的肌痛、乏力,肌酶升高≥10倍,或肝酶升高≥3倍,或出现由药物引起的严重胃肠道反应,应立即停药并进行相关处理。
1.4 统计学处理
采用SPSS13.0 统计软件分析数据,对连续变量均进行正态性检验和方差齐性检验,符合正态分布及方差齐性则以(均数±标准差)表示,进行t检验,否以中位数(IQR)表示,进行非参数检验(Mann-Whitney U检验);计数资料以率(%)表示,χ2检验。对2组治疗后不同时间点的评分及血肿体积变化采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
治疗1周时,2组的GCS评分差异无统计学意义(t=-0.578,P=0.282);治疗2 周时,他汀组的GCS 评分明显高于对照组,有显著性差异(t=3.209,P<0.001);出院时,2 组的GCS 评分差异无统计学意义(t=-1.332,P=0.093)。比较2组治疗后1周、2周、出院时的NIHSS评分,治疗1 周时,2 组的NIHSS 评分差异无统计学意义(t=0.068,P=0.946);治疗2周时,他汀组的NIHSS评分低于对照组,差异有统计学意义(t=-1.999,P=0.048);出院时,2 组的 NIHSS 评分差异无统计学意义(t=-0.134,P=0.447)。治疗后1 周、2 周、出院时,2 组的血肿体积差异均无统计学意义(均P>0.05),见表2。
表2 治疗后的相关指标变化()
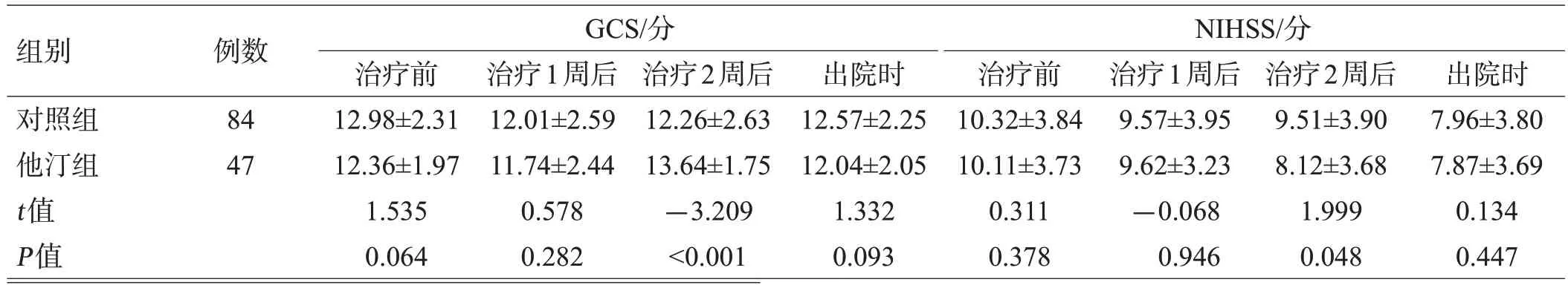
表2 治疗后的相关指标变化()
组别对照组他汀组t值P值例数84 47 GCS/分NIHSS/分治疗前12.98±2.31 12.36±1.97 1.535 0.064治疗1周后12.01±2.59 11.74±2.44 0.578 0.282治疗2周后12.26±2.63 13.64±1.75-3.209<0.001出院时12.57±2.25 12.04±2.05 1.332 0.093治疗前10.32±3.84 10.11±3.73 0.311 0.378治疗1周后9.57±3.95 9.62±3.23-0.068 0.946治疗2周后9.51±3.90 8.12±3.68 1.999 0.048出院时7.96±3.80 7.87±3.69 0.134 0.447
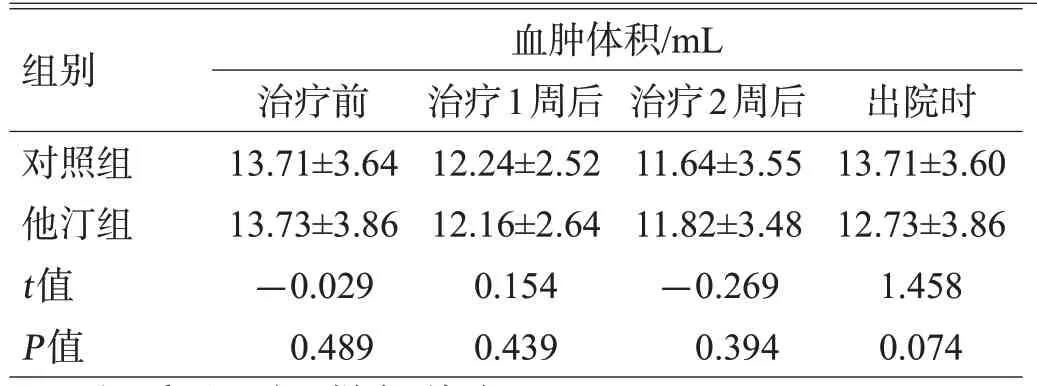
注:采用两独立样本t检验
2.2 2组预后比较
出院后随访观察90 d,记录主要结果指标mRS 评分,对照组结局良好31 例(36.90%),预后不良16 例(34.04%);他汀组结局良好31 例(65.96%),预后不良53例(63.10%),二者有显著性差异(P=0.001)。对照组死亡27 例(32.14%),他汀组死亡6 例(12.77%),他汀组的死亡率低于对照组,差异有统计学意义(P=0.014);2 组随访出现肝功能损害、再次出血、呼吸衰竭、植物状态、继发性癫痫的情况差异无统计学意义(P>0.05),见表3。 对2 组患者进行生存分析,绘制K-M曲线,见图2,他汀组至终点90 d时的存活率明显高于对照组(χ2=6.069,P=0.014)。
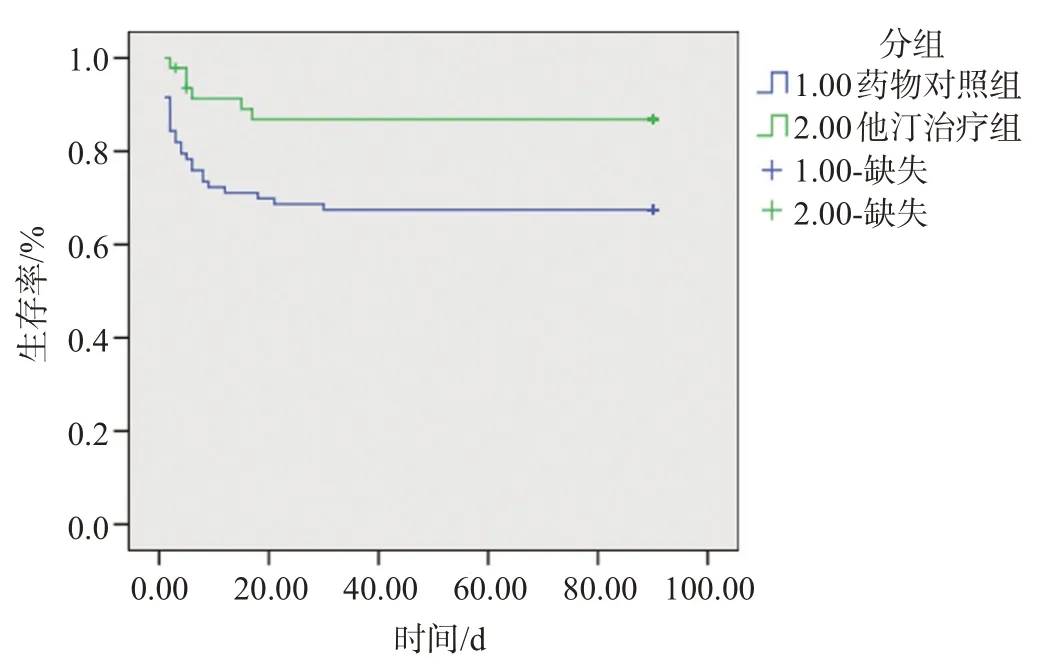
图2 生存分析曲线(K-M曲线)
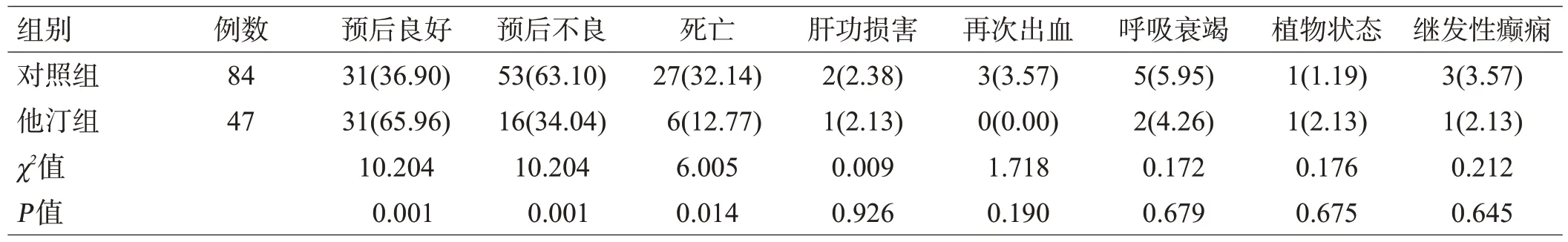
表3 2组随访3月终点时临床预后分析[例(%)]
对2组老年患者(年龄≥60岁)进行预后分析,对照组中老年患者47例(55.95%),他汀组中老年患者30例(63.83%),2 组老年患者占比差异无统计学意义(χ2=0.772,P=0.460)。2 组入院前和入院时(即发病后)mRS≥3 分的例数差异无统计学意义(P>0.05);待到出院时及90 d 终点,他汀组的预后不良比例显著低于对照组(P<0.001);90 d终点时,他汀组的死亡率低于对照组,差异有统计学意义(P=0.014),见表4。
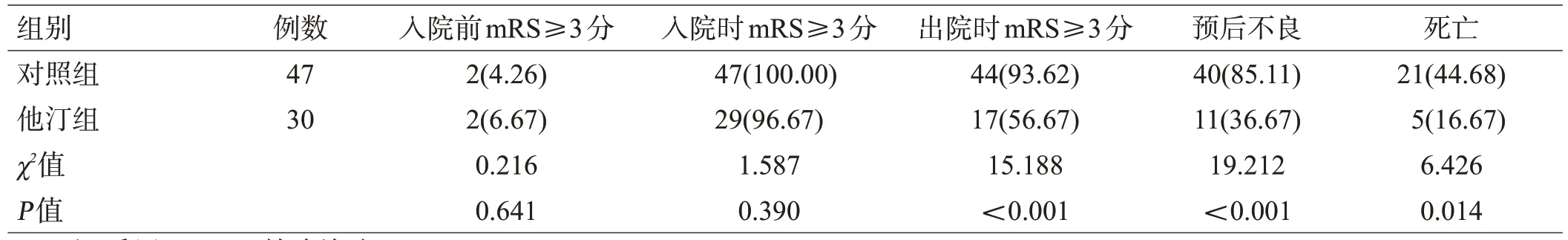
表4 2组老年患者预后分析[例(%)]
2.3 2组安全性比较
随访期间他汀组有2例出现消化道反应,症状轻微并于继续服药后好转;他汀组有出现轻微肝酶升高的情况,但由于<正常值的3 倍,复查后未达到停药标准;他汀组未出现过敏反应、肌酶升高、肌肉疼痛和肌肉溶解的现象。
3 讨论
研究结果提示,治疗2周时,他汀组的GCS评分较对照组提高,NIHSS评分降低,说明他汀组神经功能恢复较好;他汀组预后良好比例高于对照组,死亡率低于对照组,老年患者结果与之一致;2组预后、并发症差异无统计学意义,没有因为明显不良反应而需要停药的患者,说明阿托伐他汀可改善保守治疗患者的神经功能情况,减少不良结局比例、降低死亡率,且未增加肝功能损害以及颅内再出血的风险,安全性良好。他汀类药物可通过BBB发挥其抑制炎症等多效性,可改善急性出血性卒中患者的预后[7]。目前越来越多的研究表明脑卒中急性期使用他汀具有保护神经的作用,可改善患者神经功能以及预后情况。研究发现他汀可减少住院期间病情恶化进展的程度[12],然而只有少数中国ICH 患者在住院期间使用他汀类药物(6.8%),明显低于西方国家患者的使用率(14%~44%)[13-15]。
2011年发表的荟萃分析明确提出他汀类药物不会增加ICH 的风险[16],类似的结论也包含在2012 年的后期荟萃分析中[17]。此外,ICH 后他汀类药物的应用与ICH复发的风险增加也无相关性[18]。几项观察性研究报道脑卒中前后尽早使用他汀类药物可减少死亡率,且改善神经功能[19]。在对前瞻性收集的多中心登记数据的回顾性分析中发现,急性ICH 患者在住院期间使用他汀类药物与3 月和1 年时有利的功能结果和较低的死亡率相关[20]。另一项较小的队列研究显示相似的结果,ICH 患者住院后使用他汀类药物治疗与12 月时死亡或致残的几率降低有关[15]。来自加拿大卒中网络登记处的报告(n=2 466)表明,在住院期间服用他汀类药物的ICH 患者在出院时具有更好的功能结果。然而,一旦在48 h 内死亡或出院或姑息治疗的患者被排除[13],这种结果就会不同。年龄和卒中严重程度变量是不良预后的独立危险因素,意味着年龄较小、NIHSS评分较低、GCS评分较高、血肿体积较小的患者与良好的预后相关[20]。需要注意的是,高剂量他汀类药物治疗可能与ICH 的高风险相关[11]。然而,这种相关性在最近的31 项随机对照试验的荟萃分析中并不显著[13]。一项包括17 872例缺血性卒中患者的回顾性队列研究发现,他汀类药物使用与ICH之间无剂量反应关联,他汀类药物治疗与亚组特征(包括年龄和性别)之间也没有相互作用[21]。
在动物模型中,阿托伐他汀表现出使血管内皮生长因子(vascular endothelial growth factor,VEGF)显著增加、内源性细胞增殖和突触蛋白(突触素)水平增加的趋势,这些数据表明,阿托伐他汀可诱导大脑可塑性并具有神经修复活性[22]。ICH后阿托伐他汀可促进突触的发生并降低神经功能缺损的严重程度[23]。他汀类药物可促进新生血管生成,改善侧支循环及脑灌注[24-26],可促进神经再生,减少自由基生成并保护神经元免受细胞毒性的损害[22]。阿托伐他汀可通过增加微血管的开放性和完整性[27],减轻重组组织型纤溶酶原激活剂(recombinant tissue-type plasminogen activator,rt-PA)诱导的炎症反应,减少MMP-9表达上调,减轻因BBB 被破坏而导致的ICH。另外,他汀还能降低促炎症细胞因子的表达。因此他汀改善ICH预后的机制可能与上述作用有关,但这需要进一步证实。继发性脑损伤在ICH 后数小时即可发生,而且在动物模型中ICH后的炎症反应将持续数周[28-30]。ICH发病后(超急性期或ICH 后1 周)脑损伤不同阶段开始他汀类药物治疗可能导致不同的效果。目前尚不清楚他汀类药物推荐使用的维持时间,并且不能排除长期使用该药物的潜在风险。
近两年很多地区都有关于ICH和他汀类药物关系的研究报道,例如,为阐明他汀类药物对发生ICH风险的影响,对韩国高脂血症患者的研究结果显示他汀类药物治疗与降低ICH风险和改善缺血性心脑血管疾病预后相关[31]。以色列一项大型的全国性队列研究中,研究剂量依赖性他汀类药物使用与ICH 之间的关系,该研究证实,ICH 的风险随着胆固醇水平的升高而降低,但表明他汀类药物的使用可能与ICH 风险的降低有关[10]。为了探讨ICH和卒中后癫痫发作(post-stroke epilepsy,PSE)前后状态之间的联系,了解他汀类药物对PSE 的潜在保护作用机制,从台湾健康保险研究数据库中纳入7 435例ICH患者,有709例患者发生PSE;接受中度至高强度他汀类药物治疗的患者发生PSE的风险更低;亲脂性和亲水性他汀类药物与降低PSE 风险的相关性相似[32]。然而另一项台湾的研究表明,中度他汀类药物和高强度他汀类药物在卒中和全因死亡率方面没有差异:继续他汀类药物治疗的患者与未接受他汀类药物治疗的患者相比,尤其是接受亲水性他汀类药物治疗的患者,ICH 发生全因死亡率的风险较低[33]。ICH前使用他汀类药物的患者并未改善临床结局,但是,在住院期间使用他汀类药物可显著降低ICH后的死亡率,住院期间他汀类药物治疗可能对ICH 患者有益[34]。不论卒中亚型如何,他汀类药物对未来ICH 的发生趋势均无统计学意义[35]。总之,他汀类药物的使用与死亡率和残疾率降低有关,而对出血的发生没有影响。2017年有国外研究发现他汀药物使用与改善ICH 患者预后相关,尤其是对连续使用和近期使用他汀的患者[36]。这与本研究结果不谋而合。
综上所述,本研究是国内首次报道阿托伐他汀治疗ICH 患者的初步探索性研究,阿托伐他汀具有良好的安全性,并且可以改善ICH 患者神经功能情况以及发病3月的预后情况,结果值得借鉴,但确切的临床疗效和安全性有待更大规模的、多中心的临床实验来证实。经计算,对研究中mRS预后良好比例进行双侧检验,显著性水准α=0.05,把握度=0.90时,所需总样本量为133,而本研究样本量为131,把握度达到了90.08%,证明该结论可靠。本研究的不足之处在于未对ICH患者进行详细的亚组分类,从而对各亚组的变化进行比较和分析;其次,经治疗后2组间血肿体积差异无统计学意义,可能需要更多的客观的预后指标进一步研究。
