VDR启动子DNA甲基化在EAE神经损伤中的作用研究
朱俊羽,楚兰,徐竹,高子丹,邵冰,丹珍卓玛
多发性硬化(Multiple Sclerosis,MS)是一种以中枢神经系统炎性脱髓鞘为主要特点的免疫性疾病,病损主要累及皮质、近皮质、脑室周围、视神经、小脑、脑干和脊髓[1]。以20~40岁的青壮年多发,女性更常见,病因不明;约80%~85%的MS患者最初表现为复发-缓解病程,随着每次的复发,患者可能会遗留不同程度的肢体功能障碍和(或)感觉障碍[2]。MS发病机制复杂,临床上具有异质性,并由复杂的遗传背景与环境因素相互作用,而环境因素可通过表观遗传造成基因的错误表达或功能异常,导致疾病的发生[3]。表观遗传修饰指在不改变基因序列的前提下,通过改变基因组的修饰影响基因表达水平变化,对蛋白翻译产生影响[4],其中DNA甲基化是基因组DNA的一种主要表观遗传修饰形式之一,也是调节基因组功能的重要方式[5]。DNA甲基化的改变可导致异常的基因表达和基因组完整性的破坏,从而导致疾病的发生和进展[6,7]。DNA甲基化是在DNA甲基化酶的催化作用下,以S-腺苷甲硫氨酸作为甲基供体,在基因组中的CpG二核苷酸的胞嘧啶5'碳位共价键结合一个甲基基团。DNA甲基化主要发生在位于基因的启动子区域的CpG岛上,可以调控基因的表达,高甲基化可以抑制基因的转录,低甲基化激活基因转录[5]。
维生素D受体(Vitamin D Receptor,VDR)是一种多功能的核激素受体,通过阻断NF-κB的激活和抑制促炎细胞因子的产生而具有强大的抗炎活性[8],VDR主要由维生素D在体内两次羟化后的活性代谢产物1,25-二羟维生素D(1,25(OH)2D3)激活,并通过细胞内信号转导调节细胞的基因转录程序,激活靶基因,分泌各种细胞因子,调节免疫功能[9]。VDR的表达对疾病有保护作用,研究显示克罗恩病、溃疡性结肠炎和结肠癌都与VDR水平的降低有关[10,11]。狼疮患者外周血单个核细胞中VDR的表达与疾病活动和炎症呈负相关[8]。无论是作为维生素D在体内的活性形式1,25(OH)2D3的关键受体参与免疫调节,还是对炎症的作用,VDR在体内的状态都值得研究。
本研究运用MOG-35-55建立MS经典动物模型——实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)[12],首次对EAE小鼠按疾病严重程度进行分组,拟通过检测各组小鼠脊髓腰段中VDR的表达情况和VDR启动子DNA甲基化的水平,初步探索VDR表达与EAE病程的关系,以及VDR基因的甲基化对EAE神经损害的影响,期望从中找到预测EAE进展的指标和其治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 根据MS女性多发的流行病学特点,选择8~10周龄的C57BL/6雌性小鼠,体质量18~20 g,由贵州医科大学实验动物中心统一购买于北京斯贝福生物技术有限公司,许可证号:SCXK(京)2016-0002。小鼠饲养于室温(24±2)℃的环境中,维持光-暗12 h循环交替。4~5只小鼠一笼,饲养期间小鼠在笼内有足够空间自由活动,同时给予其足够的食料和洁净饮水。本研究经由贵州医科大学实验动物伦理委员会审查通过(编号:1901081)。
1.1.2 主要试剂与设备MOG35-55多肽(购于上海楚肽生物公司),弗式完全佐剂(complete Freund’s adjuvant,CFA)(购于美国Sigma公司),佐剂用卡介苗(购于石家庄开创生化公司),注射用百日咳毒素(购于美国Listbio公司),兔抗VDR(购于美国Affinity公司),兔抗GAPDH(购于杭州贤至公司),山羊抗兔IgG(H+L)(购于武汉普美克公司),逆转录试剂盒、T-Vector PMD19载体(购于日本TAKARA公司),Maxima SYBR Green/ROX qPCR Master Mix试剂盒(购于美国Thermo Scientific公司),Methylation-Gold试剂盒(购于美国Zymo Research公司)。
1.2 方法
1.2.1 建立EAE动物模型[13]利用随机数字表将小鼠分为对照组(n=12)和EAE组(n=48,实验需根据小鼠神经功能评分进行亚组分组,故该组预设只数大于各亚组实际只数总和)。MOG35-55溶液与含卡介苗的CFA等体积混匀制成抗原乳剂。用4%水合氯醛腹腔注射麻醉EAE组小鼠后,在小鼠脊柱两侧以250 μg/只的剂量多点皮内注射抗原乳剂。分别在免疫当天(即第0天)和免疫第2天对EAE组小鼠经腹腔注射百日咳毒素稀释液200 ng/只。对照组不予任何处理。每日观察并记录小鼠饮食、活动及体重变化,连续21 d。
1.2.2 评分及分组 根据Weaver’s 15分法[14]对小鼠进行神经功能评分:尾巴可正常抬高,无无力症状为0分;尾巴张力减低或尾巴远端瘫痪为1分;尾巴全瘫为2分;四肢无无力症状或步态异常为0分;单个肢体步态不稳、跛行为1分,单个肢体轻瘫,行走有拖拽为2分,单个肢体全瘫(脚掌上翻)为3分。尾巴和每个肢体累加得出总分,死亡记为15分,其中有无力症状表现,但程度不到1分的记为0.5分。评分由两名实验员分别完成并记录。实验以21 d为终点,免疫第21天根据EAE组小鼠表现出的不同的肢体运动障碍,按神经功能评分又分为三亚组:评分>0分且<6分,为低分亚组(n=10);评分≥6分,为高分亚组(n=10);未表现出明显的尾部无力或肢体运动障碍,评分为0分,为0分亚组(n=10)。因在本课题组前期的研究中,EAE 0分亚组小鼠虽然神经功能评分为0分,但在其脑组织中观察到了炎性脱髓鞘病变[15],故本研究设置该亚组。
1.2.3 透射电镜观察脊髓组织髓鞘结构 处死小鼠后取部分脊髓组织,3%戊二醛固定,脱水处理后,经高纯化铅液染色处理后在透射电子显微镜(FEI Tecrai G2 Spirit)下对髓鞘结构进行观察。
1.2.4 Western blotting检测脊髓腰段组织中VDR蛋白表达情况 取EAE各亚组和对照组脊髓腰段组织提蛋白,SDS-PAGE凝胶电泳检测各组织VDR蛋白表达情况。VDR(1∶1 000),GAPDH(1∶1 000)一抗4℃过夜,山羊抗兔IgG(1∶2 000)二抗室温孵育2 h,Bio-Rad凝胶成像系统对条带显影后Image J统计分析结果。
1.2.5 QPCR检测脊髓腰段组织VDR mRNA表达情况 取EAE各亚组和对照组脊髓腰段组织提总RNA,检测DNMT-1的mRNA表达水平。通过PubMed检索VDR的Gene ID,进入引物Bank搜索得到以下引物,以40个循环,95℃持续15 s,57℃持续60 s进行。引物(5’→3’):VDR(F):ACCCTGGTGACTTTGACCG;VDR(R):GGCAATCTCCATTGAAGGGG;GAPDH(F):AGGTCGGTGTGAACGGATTTG;GAPDH(R):TGTAGACCATGTAGTTGAGGTCA。
1.2.6 亚硫酸氢盐测序法BSP(Bisulfite Sequencing PCR) 定量检测小鼠脊髓腰段组织中VDR启动子DNA甲基化水平。BSP引物(5’→3’):左GAGAAAT TTATTTGAGGTTTTTTATT;右:TAATTCTACCCAAT CTACTATAAAC。取200~500 ng DNA用Methylation-Golcd Kit进行亚硫氢酸盐处理,以40个循环(95℃持续30 s,55℃持续30 s,72℃持续30 s)进行扩增。扩增后的PCR产物与T-Vector PMD19载体连接后转入DH50α感受态细胞中进行克隆,每个样本挑选10个阳性克隆子进行测序。测序由武汉金开瑞生物工程有限公司完成。
1.3 统计学处理
采用Graphpad Prism5软件进行统计分析,符合正态分布的计量资料以(均数±标准差)表示,两组比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠神经功能评分变化
EAE组小鼠在造模后可能出现不同程度的精神萎靡,懒动,皮毛粗糙无光泽,偶有寒颤、体温稍高症状。其中,EAE高分亚组和低分亚组小鼠免疫后第12天开始出现尾巴无力,远端下垂,后逐渐累及双后肢和前肢,造成明显运动障碍,小鼠神经功能评分逐渐增加,到免疫第18天,低分亚组小鼠神经功能评分开始降低,高分亚组小鼠评分持续增加,到免疫第21天未继续增加;0分亚组和对照组未出现明显的肢体运动障碍,神经功能评分均为0分,见图1、图2。
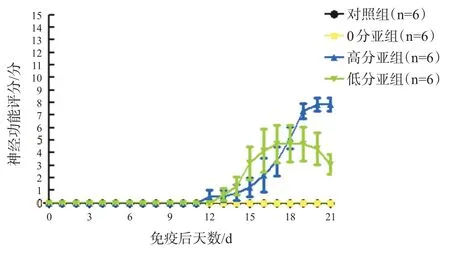
图1 各组小鼠神经功能评分变化
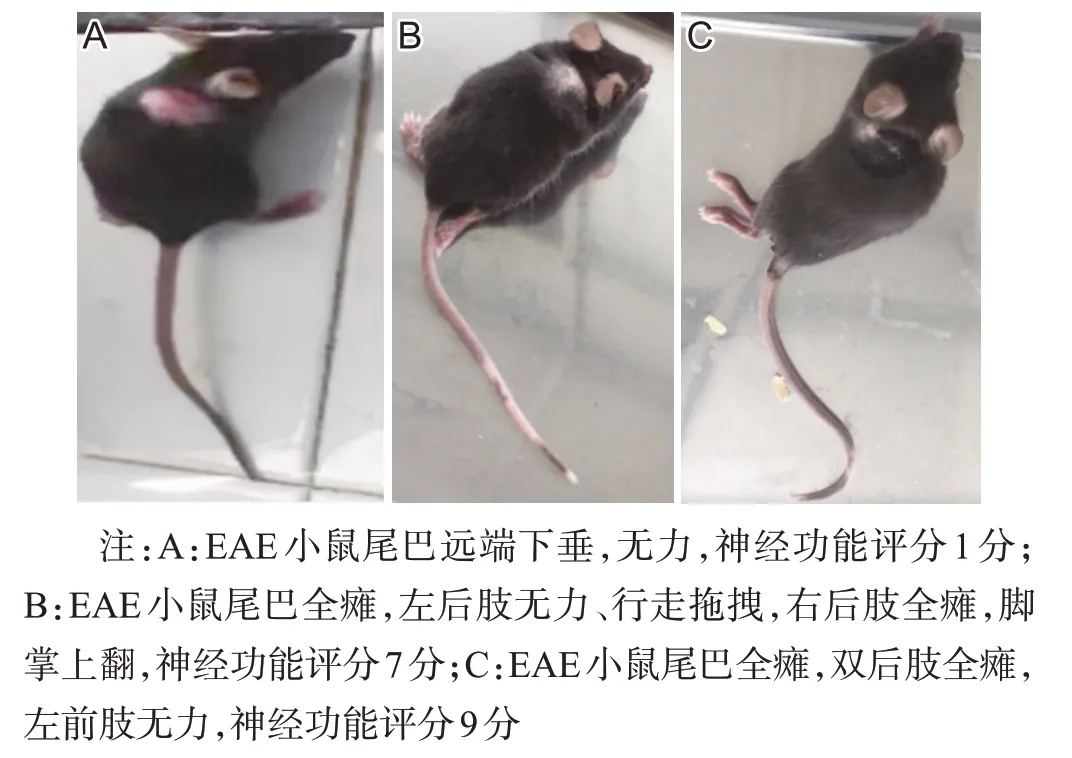
图2 EAE组小鼠神经功能评分情况
2.2 各组小鼠脊髓髓鞘结构变化
在电镜下,对照组小鼠脊髓髓鞘横截面呈黑色环形,形态结构连续,无空泡、增粗和分层等损伤表现;EAE 0分亚组小鼠部分髓鞘结构呈断裂、分层、空泡变性;EAE高分亚组小鼠髓鞘损害严重,环形结构不完整;EAE低分亚组小鼠髓鞘虽然完整,但有明显增粗、分层样改变,见图3。
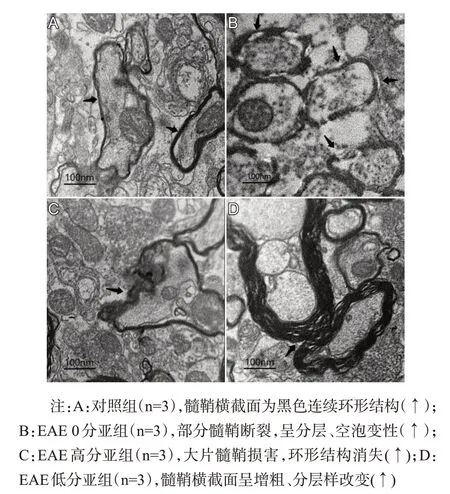
图3 各组小鼠电镜下髓鞘变化
2.3 各组小鼠脊髓腰段组织中VDR蛋白的表达均呈不同程度降低
Western Blotting结果显示,与对照组相比,EAE各组VDR均呈下降趋势。对照组、0分亚组、高分亚组、低分亚组的VDR蛋白表达分别为:(0.60±0.02)、(0.36±0.07)、(0.34±0.09)、(0.11±0.01),见图4。
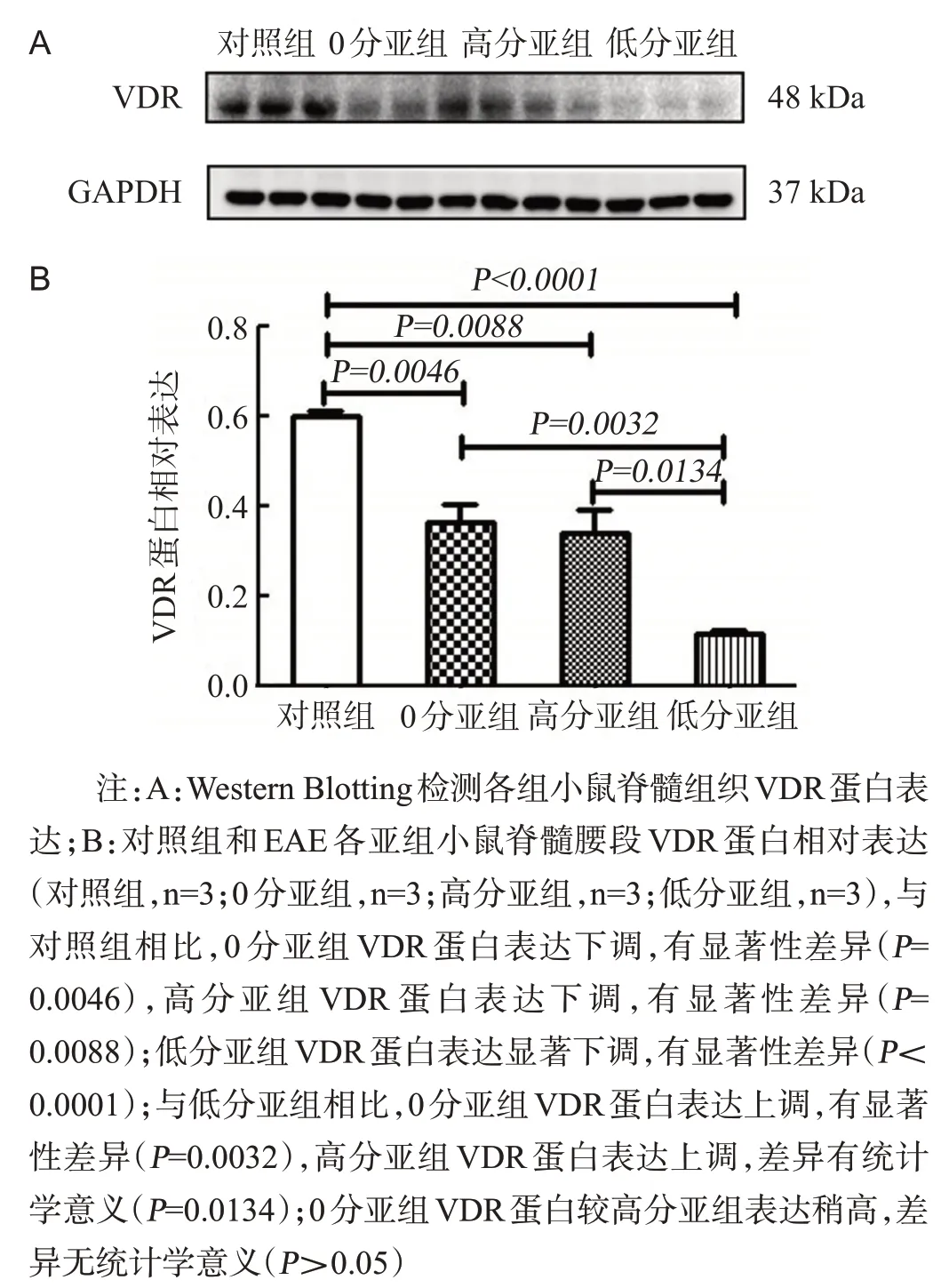
图4 各组小鼠脊髓腰段组织VDR蛋白表达情况
2.4 各组小鼠脊髓腰段组织中VDR mRNA的表达均呈不同程度降低
QPCR结果显示,与对照组相比,EAE各亚组VDR呈下降趋势。对照组、0分亚组、高分亚组、低分亚组VDR mRNA表达水平分别为:(1.31±0.97)、(0.89±0.31)、(0.49±0.36)、(0.44±0.25),见图5。
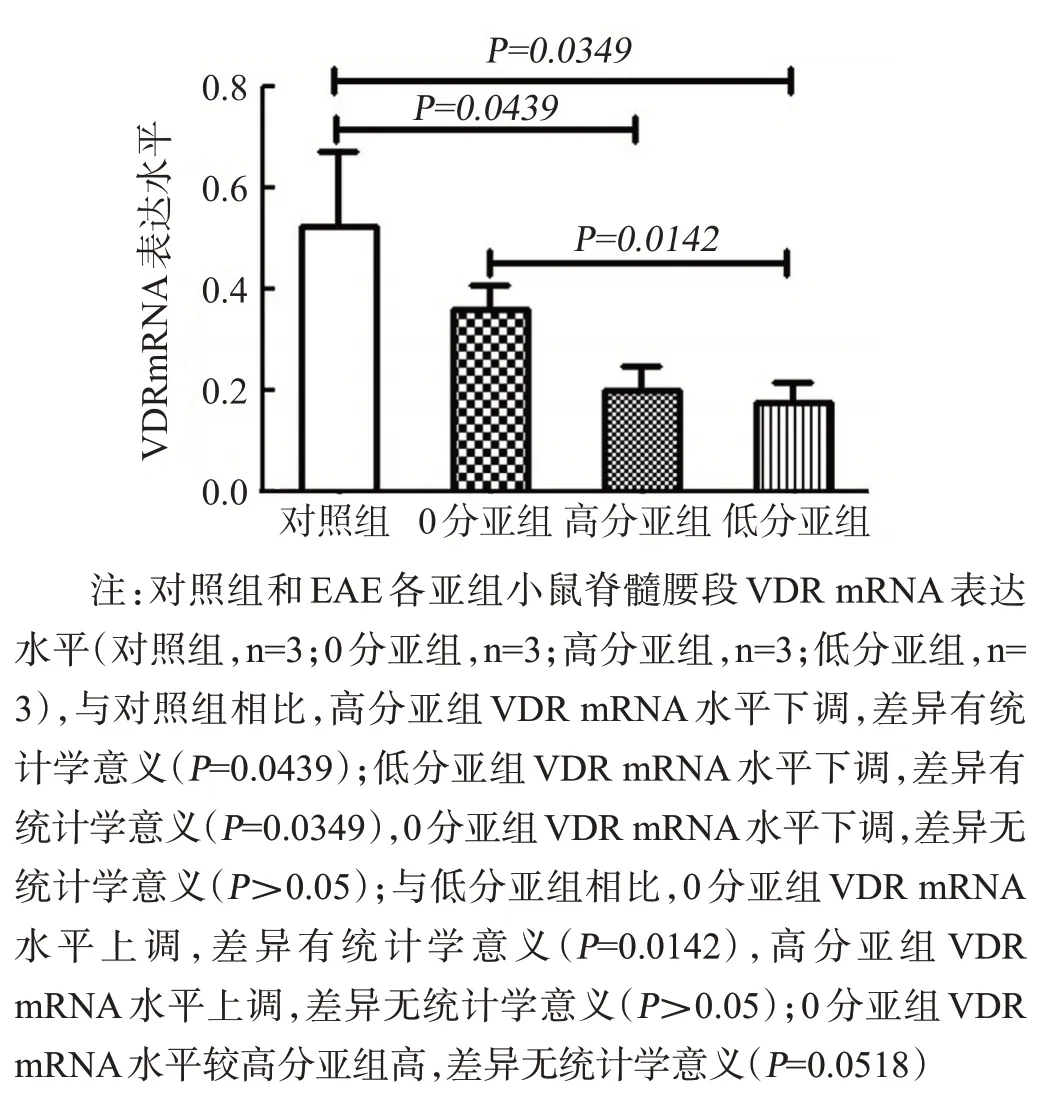
图5 各组小鼠脊髓腰段组织VDR mRNA表达情况
2.5 各组小鼠脊髓腰段VDR启动子DNA甲基化率比较
用BSP分别检测各组小鼠脊髓腰段的VDR启动子DNA甲基化率,分别为:对照组(2.68±1.25)%,EAE 0分亚组(1.84±1.29)%,高分亚组(1.43±0.58)%,低分亚组(2.55±1.42)%,各组均呈低甲基化率,见图6。
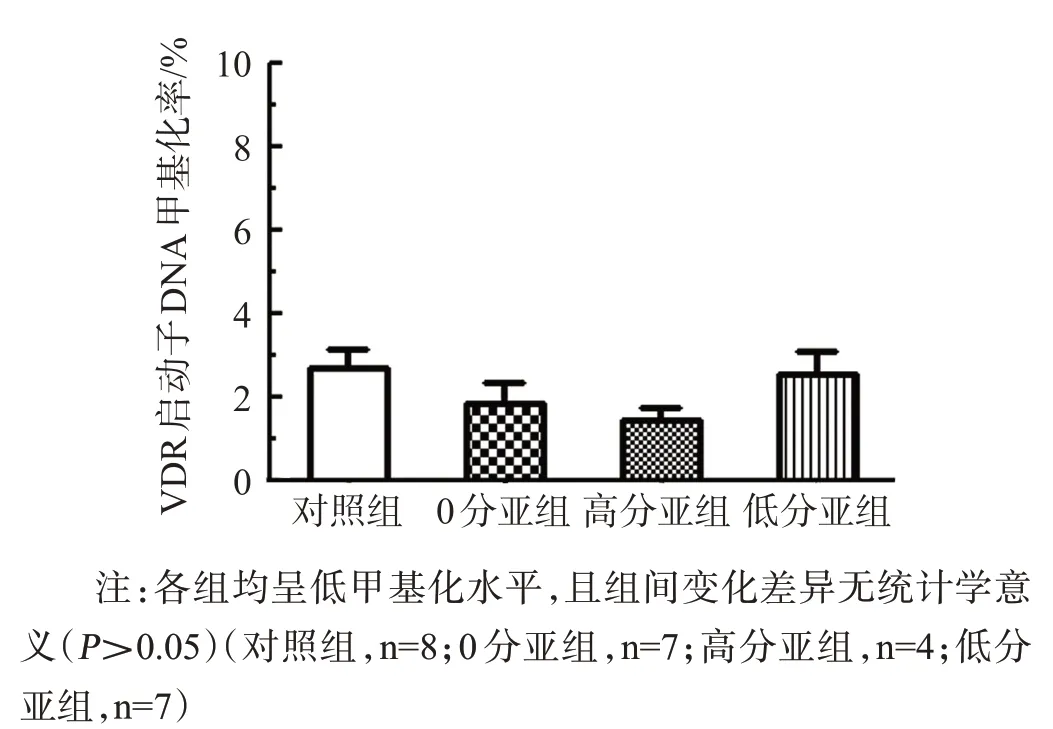
图6 各组小鼠脊髓腰段VDR启动子DNA甲基化率
3 讨论
临床上最常使用扩展残疾状态量表(expanded disability status scale,EDSS)对MS患者的功能和运动情况进行综合评价,以评估患者疾病严重程度和指导后续治疗方案[16]。本实验根据Weaver’s 15分法[14]对小鼠进行神经功能评分,将表现出不同程度神经功能损害的EAE小鼠进一步分组。EAE小鼠表现为由尾巴无力向四肢累及的发病特点,当没有运动障碍时,评分为0 分,值得注意的是,虽然没有在0 分亚组中观察到典型的发病症状,但在电镜下观察到0 分亚组髓鞘出现断裂、空泡改变。本研究中部分0 分亚组小鼠存在易激惹、尿失禁症状,由此笔者猜测0分亚组也许发生了运动功能障碍之外的其他功能损害,但是需更多实验数据支持。EAE 作为研究MS 的经典动物模型,其功能评估多针对运动功能[17-20],而MS临床症状包括肢体无力、感觉异常、视力下降、精神症状、膀胱功能障碍等[2],单单只靠运动功能鉴别EAE 的发病与否可能还欠完善。以MOG35-55 为抗原诱导的EAE 表现为复发-缓解病程[21,22],低分亚组小鼠最早在发病第3~4 天出现运动功能障碍明显缓解,结合该组整体神经功能评分在免疫后第18 天降低的表现,推测该组更接近EAE的缓解状态,而这可能是其电镜下髓鞘明显增粗、分层但结构尚完整的原因。
本研究检测了VDR mRNA 和蛋白在各组小鼠脊髓腰段中的表达,相较对照组而言,EAE 各亚组小鼠VDR表达呈不同程度减少,这与其他相关研究结论相符合,即疾病的发生与VDR 表达水平降低相关。在EAE 组间,0 分亚组和高分亚组的VDR 表达均高于症状已经缓解的低分亚组,对于在疾病发生后,VDR 表达水平的相应变化是原因还是结果仍不能解释。虽然有研究报道在VDR敲除小鼠中,EAE发病时间延迟且严重程度下降[23]。但是,EAE是由一系列复杂的病理事件介导,它的复杂性有时会使结果的解释变得困难[24]。应用基因敲除动物研究EAE 所呈现的结果需要更深入地研究才能解释现象背后可能涉及的机制[25]。在D-前列腺素受体1(D-prostanoid Receptor 1,PTGDR)的研究中也存在相似的矛盾,已知前列腺素D2通过结合PTGDR参与神经保护,而在PTGDR敲除小鼠中,EAE严重程度下降。但是接下来的研究发现,PTGDR敲除的EAE 小鼠通过增加T 细胞凋亡,减少自身反应性T细胞,从而减轻神经炎症。其中在EAE野生型小鼠中起致病作用的白细胞介素-1β在PTGDR敲除小鼠中起到了保护作用[26]。VDR 敲除的EAE 小鼠发病症状减轻的现象背后是否也发生了类似PTGDR 敲除的EAE小鼠这样一系列的免疫调控需要深入研究。
DNA甲基化在癌症领域研究较多,癌组织或癌细胞出现相关基因的异常甲基化往往既是病因也是治疗靶点。早期的研究报道,乳腺癌患者的癌组织中VDR基因启动子异常高甲基化,在使用去甲基化药物治疗后,VDR 的表达和对维生素D3 治疗的敏感性得到恢复。本研究VDR 启动子区DNA 甲基化率的结果显示,无论VDR 基因水平和蛋白水平表达情况如何,CpG岛甲基化率都较低,均低于4%。因此,得出结论,VDR启动子区的DNA甲基化可能并不参与调控EAE不同神经功能损害组的脊髓VDR 表达降低。小鼠的VDR 基因5’UTR 区域,包含两个外显子和一个启动子[27,28],用软件预测的启动子区域找到一个CpG 岛,其中包含14个CpG位点,但是在笔者预测的CpG岛附近仍然有散在的CpG位点,这些位点的存在会不会是调控VDR 基因的关键点仍需实验证明。而实验中各组神经功能损害程度不同的EAE 小鼠表现出的VDR 不同程度减少的现象背后的机制需要深入研究。
