化学发光免疫分析仪校准和质量控制探讨
杨红玮
(深圳迈瑞生物医疗电子股份有限公司,广东深圳 518000)
0 引言
化学发光免疫分析技术是继放射免疫、酶联免疫、荧光免疫分析技术后,广泛应用由于临床疾病诊断的一项新兴免疫检测技术。全自动化学发光免疫分析仪以其检测速度快、灵敏度高、特异性好、线性范围宽、结果准确等优势,逐步替代传统免疫产品,成为医院主流检验设备。其检测项目覆盖多种疾病的诊疗,包括肿瘤、甲状腺、激素、心肌、糖尿病、传染病、贫血等疾病,可以为更多的临床科室提供完整的检测方案。化学发光免疫分析仪结构复杂,同时免疫抗原抗体反应影响因素也非常多,对保证检测结果的准确性提出了巨大的挑战。本文将对全自动化学发光免疫分析仪溯源校准和质量控制进行深入的探讨。
1 免疫溯源的发展和困难
溯源是保障检验结果准确可靠的有效途径,也为医院间检验结果互认打下了坚实的基础。免疫项目的溯源近些年发展的比较快,IFCC 也专业成立了几个工作组,如C-STFT 甲状腺标准化工作组、WG-PCT-降钙素原标准化工作组等。溯源类型主要分为参考方法、参考物质、一致化方案,以及厂家标准。参考方法是溯源标准的最佳选择,目前有参考方法的免疫项目还比较少,均为同位素稀释质谱法(ID/MS),如E2、E3、T3、T4、Cortisol等。参考物质因互换性的限制,在免疫项目中应用情况并不理想[1]。为此2010 年AACC 提出了一致化方案,并成立了ICHCLR国际临床实验室结果一致性联合会,以推动全球检测结果一致性的发展。被测量的定义、常规测量过程的特异性及参考物质的互换性,是溯源面临的三大挑战。
1.1 被测量的定义
为保证溯源有效传递、各溯源层级的被测量相同,在建立溯源链之前,首先应根据预期用途定义被测量。但很多测量没有充分定义有临床意义的被测量,在溯源过程中受分析物异构体问题的影响,这些测量在对临床诊断重要的分子成分被清晰地定义前,结果一致化难以达到,如肌钙蛋白I 和HCG 在不同临床条件下有不同的分子形式。
1.2 常规测量程序的分析特异性
常规测量程序分析特异,其被测量与参考方法被测量一致,是溯源有效传递的前提。然而,由于人新鲜血液中被测物质的复杂性,有些分析物定义不充分,在许多免疫反应中做到真正意义上的特异非常困难。有些常规测量程序甚至还作于被测物质以外的其他物质,其特异性问题则更为严重。这些测量在更特异性方法发现前,结果一致化是难以达到的。如不同测量过程作用于同一被测物的不同抗原决定簇,可能给出不同测量结果。
1.3 参考物质的互换性
互换性是参考物质的重要属性,当参考物质用于制造商溯源程序为产品校准品定值时,必须具有互换性[1]。如果产品校准品溯源至没有互换性的参考物质,将导致不同常规程序测量病人样本没有可比性。
2 溯源的具体实施
迈瑞的溯源团队积极参与到国际的标准化项目中,与全球标准化发展保持同步。制造商在检测结果标准化中扮演着极其重要的角色。迈瑞的溯源团队经过近20 年的摸索实践,拥有了成熟的溯源技术平台。迈瑞内部溯源传递从采用的最高计量参考标准开始,通过不间断的比较链传递至产品校准品的定值为止(图1)[2]。
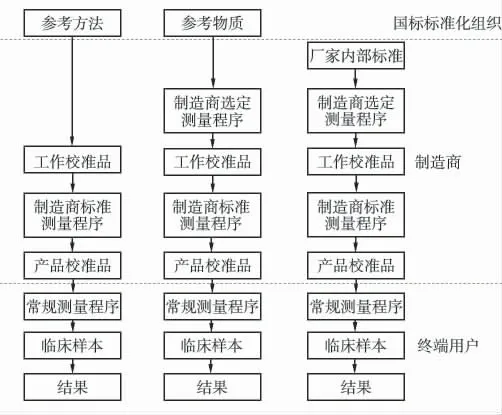
图1 溯源至参考方法、参考物质、厂家内部标准的溯源量值
2.1 参考标准的选择
最高计量参考标准通常优先采用JCTLM 批准发布的参考方法,并必须评估与临床预期用途相适应。同时建有独立的参考测量实验室,执行参考方法的溯源。
当没有推荐的参考方法时,采用适用的有证参考物质。此参考物质必须提前验证是否具有互换性,如果校准品溯源至没有互换性的参考物质,将导致临床病人样本结果与真实结果之间存在明显偏离,影响临床诊断和治疗。如果只能使用没有互换性的参考物质,但其已被证明在其他多个测量程序中是有互换性时,可以修正互换性偏差后再使用。具体方案可参考IFCC 互换性工作组推荐的技术指南,修正没有互换性的偏差,并记录使用和验证的详细过程。溯源至参考物质的结果受参考物质自身质量、稀释准备以及测量的仪器和试剂的影响,因此溯源至参考方法优于溯源至参考物质的方法。
当没有参考方法也没有参考物质时,必须建立厂家内部标准,同时也要建立完备的质量控制方案,预防标准发生偏离的风险。
2.2 工作校准品
由于参考物质常常是有限的,参考方法运行对设备人员等要求高,且测试速度慢、成本高。因此,根据需要在实际溯源传递过程中会设立工作校准品,用于产品校准品批与批的定值。工作校准品理想情况下为一组人源血清组最佳,尽量覆盖全部测量范围。其由多个混和血清,经离心、过滤等处理后,各个混和血清分装成小包装、-80 ℃保存。实践证明,-80 ℃保存的血清稳定性良好,且复融后性能和新鲜血清相似。当人源血清不易获得时,也可以是具有基质的物质。但应验证互换性影响,必要时修正互换性偏差。执行过程中,可根据需要同时设立两个工作校准品。工作校准品由选择的参考方法进行定值,或使用参考物质、厂家内部标准校准制造商选定测量程序后进行定值,并评估测量不确定度。
2.3 产品校准品
使用工作校准品校准制造商标准测量程序,产品校准品通过重复测量,计算平均值得到靶值,并评估测量不确定度。产品校准品的不确定度应包括所有较高计量水平的测量程序和参考标准的不确定度分量总和。
产品校准品如果需要给多个型号的检测系统定值,应该分别在每个检测系统上给产品校准品定值。如果证明不同型号的检测系统上定值结果一致,则各检测系统可以共用同一个的校准品靶值。
为了确保产品校准品定值过程在连续的质量控制下,在每批定值的同时,一般同时测定2 类趋势性质控品组成监视系统,用于监控定值的变化趋势和漂移情况:一类趋势性控制品是与产品校准品在原料要求和加工制备工艺一样,存储条件为-80 ℃;另一类趋势性控制品是冰冻临床血清,其制备与制造商内部参考物质类似,存储条件为-80 ℃。
产品校准品的定值过程必须在完善的质量体系管理下,由专业人员执行,并严格对标准机、试剂、工作校准品、趋势性质控品进行管理,确保产品校准品在不同仪器、试剂批次、校准品批次的任意组合下,测试同一临床样本结果一致。
3 对制造商在仪器、试剂、校准品和质控品的要求和挑战
化学发光免疫分析分析特异,其被测量与参考方法被测量一致,是溯源能有效传递的前提。而此分析测量程序通常是由仪器、试剂、校准品和质控品组成的检测系统,这就要求仪器、试剂、校准品和质控品在开发设计和生产过程中,充分考虑相互之间的协同,并保持测量程序的分析特异。试剂批号批次问题一直是临床应用中的重要影响因素。试剂生产中由于抗原抗体原料的标准化困难,以及使用的磁珠、酶标工艺的复杂性,对采用的校准品、质控品的互换性提出了巨大的挑战。目前市面上使用的商业校准品和质控品,以及EQA 室间质评样本,基本上无法做到使用纯天然的人源样本,大部分是使用人血清基质的经过处理的校准品和质控品,尽量减少基质效应的影响。人血清基质样本的使用,在生化领域得到了较好的实践,但在免疫项目中却经常存在不同试剂批次下互换性缺乏的问题。有报道,对于大量分析物和测量程序,即使使用人血清的质控物质,但在不同试剂批次下却没有互换性。为杜绝这种差异对临床结果的影响,校准品的溯源必须按照试剂批次分别进行定值。虽然能确保临床结果准确性,但还是给用户在内部质量控制和外部质量控制还是带来的非常大的困扰。因此,迈瑞在试剂生产过程中,通过抗原抗体来料控制,生产工艺标准化提升等努力,对试剂批次的一致性进行严格管控。
4 临床实验室校准和质量控制
由于抗原抗体反应特征,化学发光免疫分析仪采用多点曲线校准。多点校准不仅增加人力、时间成本,而且免疫试剂价格高昂,同时也带来了费用的大幅增加。迈瑞充分考虑了用户端使用痛点,在开发过程中对校准模型、选择的拟合程序,以及校准品浓度的选择均进行了大量研究和优化,以获得最有效的校准过程、最准确的测量结果。为简化用户端校准过程,降低了人力、时间、费用成本,提升实验室的工作效率。迈瑞提供了对多点校准模型进行两点再校准的方案。试剂生产阶段,每个试剂批测试10~12 个多点校准主曲线,通过电子条码传递至用户端,用户端结合当前实验室2 点校准品测试值,完成仪器的再校准过程,此校准计算过程中在仪器校准界面提供自动计算。此方案已经过充分验证,能够反映仪器和试剂的具体测量条件,可通过更新校准曲线、调整测量信号来实现再校准过程,并且与传统的多点校准方案效果相同。
化学发光免疫分析仪检测结果准确性受分析前、分析中、分析后各个环节的影响,迈瑞在检测系统开发设计时,即充分考虑了这些影响。通过全自动进样和样本条码扫描设计避免样本进样错误,设计了专门的维护保养程序、故障提示等维持仪器的最佳使用状态,而专用的质控界面让质控测试、质控数据统计、绘制质控图、失控判断等活动更便捷。同时也严格控制仪器试剂生产一致性,减少用户在内部质量控制和外部质量控制问题的出现。
5 结束语
虽然目前化学发光免疫分析技术在临床疾病的诊断方面发展迅猛,但其距离全球结果互认、测试结果标准化的目标还有一定距离,这需要国际标准化组织、制造商和全体检验人员的共同协作。为此,迈瑞作为制造商,将致力于检测系统的溯源校准和质量控制的研究,为全球检验人员的共同目标而努力。

