SMI评价颈动脉斑块中IPN形成及发生ACI的危险因素分析
王文峰, 常 叶, 牟荣骥
哈励逊国际和平医院超声科, 河北 衡水 053000
急性脑梗死(ACI)指的是由于脑血供不足造成的脑组织坏死性疾病,其具有发病急骤,易复发、死亡率高的特点[1]。临床已经证实[2],如果斑块内IPN壁不完整,血管的脆性和渗透性高,斑块易发生破裂,可增加血栓的发生风险。既往研究表明[3],颈动脉易损斑块与ACI的发生相关,在评估颈动脉易损斑块中可以用斑块内新生血管(IPN)形成这一指标。超声血管造影(CEUS)可以检测斑块内新生血管,检查中使用的造影剂能支持对比增强的超声检查,然而CEUS检查具有耗时、费用高、有过敏风险等缺点,限制了它在临床的批量使用[4,5]。超微血管成像(SMI)技术可用来评估组织微血管情况,其具有无创、灵敏、伪像少、高分辨率等优点,与CEUS检查相比,SMI不需要使用造影剂,能够快速获取微血管及低速血流等信号[6]。除动脉粥样硬化影响新生血管形成外,临床上一些治疗会对新生血管的形成过程造成影响,IPN形成可诱发斑块破裂出血,是斑块不稳定性最有力的独立预测因子[7,8],因此,及时观察到斑块内新生血管的生成并采取积极治疗,可显著降低斑块破裂的发生风险,减少ACI的发生率。SMI已被用作甲状腺、乳腺及关节炎等疾病的诊断方法[9,10],本研究旨在探究SMI与CEUS检查在评估颈动脉粥样硬化斑块IPN形成结果的一致性,并分析发生ACI的危险因素。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年1月我院60例ACI伴颈动脉粥样硬化斑块形成的患者作为ACI组,另外60例同样发现颈动脉斑块形成但是未发生ACI的患者作为对照组。本研究获得患者及其家属对知情同意并经我院医学伦理专家委员会批准。纳入标准:患者年龄50~79岁;ACI患者的诊断参考《中国急性缺血性脑卒中诊治指南2018》[11]中相关标准;颈动脉斑块的诊断标准为颈动脉内中膜局限性增厚超过1.5 mm[12];两组患者均在本院接受SMI、CEUS检查。排除标准:重度肺动脉高压患者;既往接受颈动脉手术治疗的患者;心源性脑卒中、出血性脑血管疾病患者;恶性肿瘤患者;近3个月患者具有溶栓或取栓病史;合并其他系统的严重疾病患者。
1.2 方法
采用ibshibaApli0500型彩色多普勒超声诊断仪进行检查,设置探头频率为4~9 MHz,患者平卧,将检测部位充分暴露,先进行常规颈动脉超声扫查,观察斑块回声,测量斑块厚度,将斑块最厚处放大,在患者平静呼吸的状态下,切换成SMI模式,调整速度为1.3~1.5 cm/s,检查并观察30 min,记录颈动脉IPN情况,保存、分析图像,并根据分级标准进行评分[13]。SMI检查后行CEUS检查,应用SonoVue(BraccoS.p.A.,米兰,意大利)和谐波成像软件进行颈动脉超声检查。采用六氟化硫(SF6)微泡作为超声造影剂SonoVueTM。使用前将其溶解于5 mL生理盐水中,振荡混匀后用团注法以1.2 mL/s的速度经肘正中静脉注射,然后再注入生理盐水5 mL,视情况重复上述操作,并实时关注目标斑块内微气泡灌注情况,记录、保存图像,并根据分级标准进行评分[14]。
1.3 统计学处理
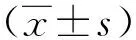
2 结果
2.1 SMI诊断ACI患者颈动脉斑块内部IPN形成与CEUS结果的一致性分析
60例ACI患者中CEUS方法共检出120例颈动脉斑块,SMI与CEUS诊断颈动脉斑块内部IPN形成的一致性Kappa值为0.723,P=0.000,二者具有高度的一致性。见表1。

表1 SMI诊断ACI患者颈动脉斑块内部IPN形成与CEUS结果的一致性
2.2 SMI诊断对照组患者颈动脉斑块内部IPN形成与CEUS结果的一致性分析
60例对照组患者,CEUS共计检出127例颈动脉斑块,SMI与CEUS诊断颈动脉斑块内部IPN形成的一致性Kappa值为0.537,P=0.000,二者具有较高的一致性。见表2。

表2 SMI诊断对照组患者颈动脉斑块内部IPN形成与CEUS结果的一致性
2.3 ACI组与对照组各项基线资料的单因素分析
ACI组和对照组的年龄、体质量指数(BMI)、血清TC、性别、个人生活史比较,差异无统计学意义(P>0.05);ACI组与对照组的血清TG、HDL-C、LDL-C、合并高血压、合并糖尿病、合并冠心病的情况比较,差异具有统计学意义(P<0.05)。见表3。

表3 ACI组与对照组各项基线资料的单因素分析
2.4 多因素分析
以单因素分析具有统计学意义的血清TG、HDL-C、LDL-C、高血压、糖尿病、冠心病、颈动脉斑块内部IPN形成作为自变量,患者是否发生ACI作为因变量,建立Logistic模型分析:患者血清TG、LDL-C升高、合并糖尿病、合并高血压、颈动脉斑块内IPN形成是患者发生ACI的独立危险因素(P<0.05)。见表4。

表4 Logistic多因素分析
3 讨论
颈动脉斑块的产生会导致脑血管疾病的发生,新生血管的形成能够加速血管形成,进而引发ACI,严重影响患者生命健康。斑块内IPN的检测常用CEUS,CEUS与组织病理学检测具有良好的一致性。SMI技术可通过自适应算法识别和消除组织运动伪影,提高捕捉低速血流的敏感性,有研究报道[15],SMI具有检测斑块内新生血管的能力,本研究以CEUS为参照标准,基于SMI的诊断效能,以期为临床提供一种更加灵活的诊断方式。
斑块内新生血管生成时,颈动脉斑块造影增强密度升高。本研究结果显示,SMI与CEUS在诊断颈动脉斑块内部IPN形成中具有高度一致性。斑块分级越高的脑梗死程度越大,ACI发生风险较大,患者预后越差,利用CEUS评估颈动脉斑块,可以对斑块分级及梗死病灶体积做出诊断[16],同样,SMI评分越高说明斑块越不稳定,患者发生ACI的概率越高[17]。CEUS可以显示血管的丰度,但是对微血管的显示能力不佳,易受到运动伪影的干扰,而SMI技术具有自适应识别技术,能够消除上述伪影,血流信息显示清晰,对于0.1 mm直径以下的微血管也具有较高的分辨率,SMI弥补了CDFI的缺陷,这也是SMI技术能用于检测斑块内新生血管的重要原因[18],另有研究采用SMI技术对颈动脉斑块形态进行量化分析,为斑块危险分层提供了重要信息[19]。结合本文结果分析原因,SMI技术采用新算法将组织内杂乱的运动信号规避掉,并兼顾高低信号的检查,增加了显示血流的敏感性。
CEUS和SMI均是临床常用且有效的超声检测技术,对操作医生的技术要求较高。SMI检测微血管的效能较高,且不需要注射造影剂,由于其检查效果易受设备的新旧版本、检查者的经验以及收集的资料等综合因素势的影响,必要时还需要增加样本量,因此,SMI检查耗时较传统检查方法稍长,但其作为与CEUS一致性较高的诊断方式,在特殊情况下具有后者所不具备的作用。
本研究结果显示,患者血清TG、LDL-C升高、合并糖尿病、合并高血压、颈动脉斑块内IPN形成是患者发生ACI的独立危险因素。有研究[20]显示,斑块IPN的壁不完整,其缺少结缔组织和基底膜支架,IPN管壁渗透性和脆性均明显增加,导致斑块破裂,增加ACI的发生风险,IPN的形成与缺血缺氧导致细胞因子过量表达有关,药物因素、高血压、高胆固醇等因素也会促进ACI的进程。结合本研究结果来看,临床对既往有糖尿病、高血压、高血脂的患者应该密切观察,积极给予干预治疗。
CEUS技术可明显增加对IPN血管壁、血管腔内部结构等的检测敏感度,还能清晰反映血管壁及血管腔内的病变程度。SMI既能反映颈动脉斑块的特点,还可评估颈动脉斑块中IPN形成,SMI在评估颈动脉粥样硬化斑块中发挥了重要作用[21,22]。目前,SMI在探究颈动脉斑块IPN形成与发生ACI的危险因素方面的相关研究较少,本研究在以往研究的基础上,进一步探究上述事件发生的危险因素,相关结果有助于提示临床对相关患者采取及时的病情控制措施,降低ACI的发生率。
综上所述,SMI在评价颈动脉粥样硬化斑块IPN形成与CEUS方式具有高度的一致性,同时,操作更简单和方便,且颈动脉斑块IPN形成与患者发生ACI具有高度的相关性。

