多b值DWI及T2* mapping成像软骨定量分析技术在诊断KOA中的应用
孙伟伟, 黄部发, 李 蕾
1. 连云港市第一人民医院影像科, 江苏 连云港 222000; 2. 连云港市中医院影像科, 江苏 连云港 222000
膝骨关节炎(KOA)是非炎症性慢性退行性疾病,主要特点为关节软骨损伤及骨质增生,目前,已成为中老年致残的主要疾病之一[1,2]。关节软骨自我修复能力有限,然而随临床药理学及其他治疗手段的进步,修复已损伤软骨、延缓软骨退变,甚至自体软骨移植已成为可能[3]。这依赖于可准确、无创评价关节软骨生理状况的技术手段。近年来,磁共振成像(MRI)技术飞速发展,已广泛应用于关节软骨疾病评价[4]。3.0T MRI具有高分辨优势,可更清晰显示变薄软骨分层,利于精确发现损伤程度及损伤范围,目前,国内外研究主要集中于T1P、T2* mapping、磁共振扩散加权成像(DWI)等技术,获取慢速扩散系数(SlowADC值)、快速扩散系数(FastADC值)、T2* 值等定量参数,为临床诊断提供参考依据[5,6],但对多b值DWI及T2* mapping成像联合分析KOA研究较少。本研究尝试分析3.0T MRI定量检查关节软骨SlowADC值、FastADC值、T2* 值在KOA诊断及病情程度评估中的联合应用价值。
1 资料与方法
1.1 一般资料
选取2018年6月至2020年10月连云港市第一人民医院的60例KOA患者(92个膝关节)作为观察组,另选取60例同期健康体检者(90个膝关节)作为对照组。纳入标准:KOA的诊断参照《膝骨关节炎中西医结合诊疗指南》[7]诊断标准;体质量指数(BMI)在18~25 kg/m2;研究对象均知情同意。排除标准:膝关节手术、外伤、骨折史者;炎症、肿瘤者。观察组:男33例,女27例,年龄42~76岁,平均年龄(59.27±7.15)岁,平均BMI(21.49±1.14)kg/m2。对照组:男35例,女25例,年龄40~78岁,平均年龄(60.38±7.54)岁,平均BMI(21.71±1.26)kg/m2。两组性别、年龄、BMI对比,差异无统计学意义(P>0.05)。本研究经我院伦理委员会审批通过。
1.2 方法
采用美国GEMR750 3.0T MRI进行MRI定量检查,八通道线圈。常规序列:冠状位T1WI及FS-T2WI、矢状位T1WI及FS-T2WI、轴位FS-T2WI;多b值DWI:b值分别取20、50、100、150、200、400、800、1000、1200 s/mm2;T2* mapping序列:用8回波SE序列,TR 600.0 ms,TE 3.0、8.1、13.2、18.2、23.3、28.4、33.5、38.6 ms,层间距1.0 mm,层厚4.0 mm,FOV 18 cm×18 cm,扫描时间4.34 min。图像均传输至ADW4.6工作站,由1位副主任医师和1位主治医师独立进行分析及测量,结果不一致时,协商一致。通过后处理界面进入T2* MAP及MADC菜单,分别计算出膝关节内、外侧软骨的SlowADC值、FastADC值、T2* 值。
1.3 观察指标
(1)两组患者及观察组不同病情程度患者关节软骨SlowADC值、FastADC值、T2* 值比较。病情程度:无任何骨关节炎征象为0级;轻微骨赘,关节间隙可疑变窄为I级;明显骨赘,关节间隙可疑变窄为Ⅱ级;中等量骨赘,关节间隙中度变窄为Ⅲ级;大量骨赘,关节间隙明显变窄,严重软骨下骨硬化及明显畸形为Ⅳ级。0~Ⅰ为轻度,Ⅱ级为中度,Ⅲ~Ⅳ级为重度。(2)关节软骨SlowADC值、FastADC值、T2* 值与KOA发生及病情程度的关系。(3)关节软骨SlowADC值、FastADC值、T2* 值对KOA的诊断价值,以及对病情程度的评估价值。
1.4 统计学处理
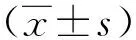
2 结果
2.1 两组SlowADC值、FastADC值、T2* 值
观察组关节软骨内侧和外侧SlowADC值、FastADC值、T2* 值均明显高于对照组(P<0.05)。
见表1、图1。
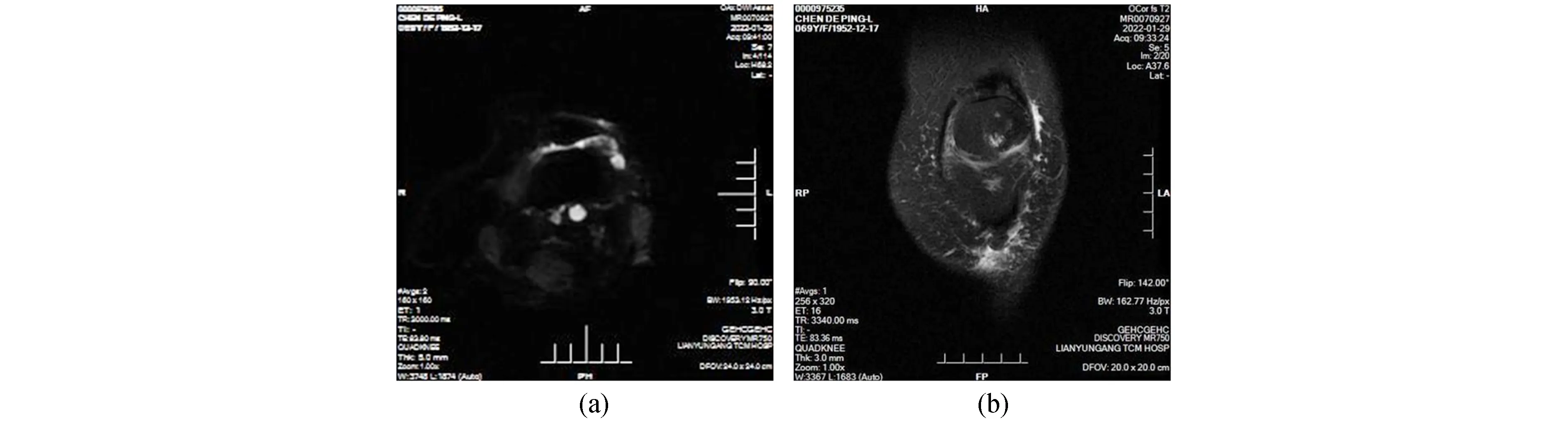
图1 KOA患者关节软骨DWI序列(a)及T2* mapping序列(b)扫描图像

表1 两组SlowADC值、FastADC值、T2* 值比较
2.2 观察组不同病情程度患者SlowADC值、Fast-ADC值、T2* 值
观察组不同病情程度患者关节软骨内侧和外侧SlowADC值、FastADC值、T2* 值差异有统计学意义(P<0.05);两两比较,重度患者>中度患者>轻度患者(P<0.05)。见表2。

表2 观察组不同病情程度患者关节软骨SlowADC值、FastADC值、T2* 值比较
2.3 SlowADC值、FastADC值、T2* 值与KOA发生及病情程度的关系
Spearman相关性分析,关节软骨内侧和外侧SlowADC值、FastADC值、T2* 值与KOA发生、病情程度呈正相关(P<0.05)。见表3。
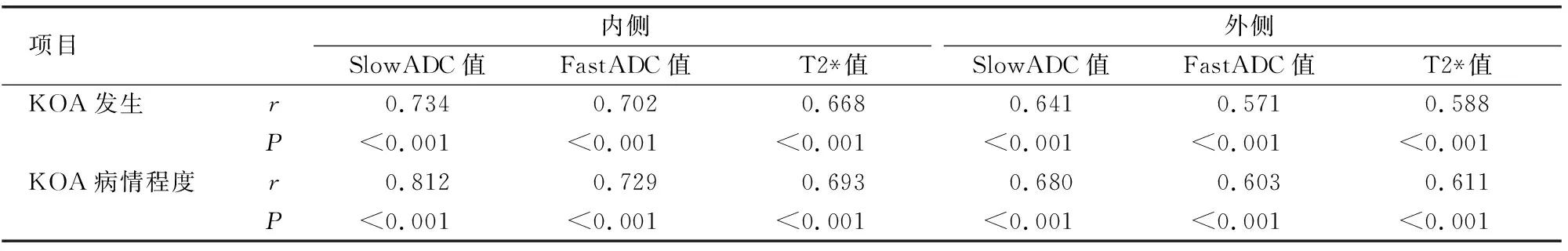
表3 关节软骨SlowADC值、FastADC值、T2* 值与KOA发生及病情程度的关系
2.4 关节软骨SlowADC值、FastADC值、T2* 值对KOA的诊断价值
以观察组为阳性样本,以对照组为阴性样本,ROC曲线分析结果显示,关节软骨内侧SlowADC值、FastADC值、T2* 值诊断KOA的曲线下面积(AUC)分别为0.841、0.704、0.862;关节软骨外侧SlowADC值、FastADC值、T2* 值诊断KOA的AUC分别为0.786、0.765、0.716。上述6项联合诊断KOA的AUC为0.900,高于各指标单独诊断(P<0.05)。见图2。
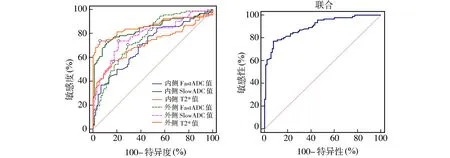
图2 关节软骨SlowADC值、FastADC值、T2* 值对KOA诊断价值
2.5 关节软骨SlowADC值、FastADC值、T2* 值对病情程度的评估价值
以重度KOA作为阳性样本,轻中度KOA作为阴性样本,ROC曲线分析结果显示,关节软骨内侧SlowADC值、FastADC值、T2* 值评估病情程度的AUC分别为0.663、0.758、0.814;关节软骨外侧SlowADC值、FastADC值、T2* 值评估病情程度的AUC分别为0.639、0.778、0.666。上述6项联合评估病情程度的AUC为0.881,高于各指标单独评估价值(P<0.05)。详见图3。

图3 关节软骨SlowADC值、FastADC值、T2* 值对病情程度的评估价值
3 讨论
目前,临床多认为KOA是炎症和力学因素共同作用下,软骨细胞、细胞外基质及软骨下骨合成和降解正常耦联失衡所致[8,9]。随临床药理学及分子生物学研究进展,早期治疗KOA成为可能。因此,如何早期、半定量或定量分析软骨损伤显得尤为重要。T2* mapping已被公认为反映胶原软骨改变的敏感技术,而T2* mapping成像时间更短、空间分辨率更高及完整覆盖关节软骨面,有望成为关节软骨病变病情监测的优选影像学检查方式[10]。有学者研究显示,T2* mapping可定量评价膝关节软骨损伤,可显示胶原排列方向及水分子含量变化,并以T2* 值定量反映出来[11]。本研究显示,KOA患者关节软骨内侧、外侧T2* 值高于健康体检者,且T2* 值随KOA病情恶化而增加。分析原因,主要是由于T2* 值影响因素主要为水分子含量、胶原纤维各向异性、胶原含量等。KOA早期,软骨胶原网格损坏,蛋白聚糖散开,氨基葡聚糖侧链暴露更多负电荷,吸引更多水分子,同时,胶原网格崩解,各向异性减小,导致T2* 值升高[12]。而关节软骨由软骨细胞与细胞外基质(蛋白多糖、胶原纤维、水等)构成,膝关节退变过程中,胶原蛋白流失,细胞外基质降解及合成失衡,导致KOA发生[13]。由此可知,KOA患者未发生形态学改变时,T2* mapping成像即可发现软骨组织成分变化,且能区别不同病情程度的病变,可作为评价早期软骨损伤的敏感指标。
DWI反映组织中水分子微观扩散运动。既往研究显示,早期软骨损伤患者ADC值显著升高[14]。多b值DWI指应用双指数衰减模型-体素内不相干运动(IVIM)拟合DWI参数,已更好地反映水分子自由扩散运动与血流灌注信息,SlowADC值、Fast-ADC值分别表示水分子弥散运动、微血管灌注情况[15,16]。本研究显示,关节软骨内侧、外侧SlowADC值与KOA发生、病情程度呈正相关,与马小芳等[16]的报道一致。关节软骨组织损伤时,胶原蛋白减少,导致水含量增加,水分子扩散速度加快,SlowADC值增加。本研究中,KOA患者关节软骨内侧、外侧FastADC值明显升高,且与病情程度有关。KOA患者滑膜中血管增生是导致滑膜炎、骨和软骨破坏的重要因素[17]。KOA进程中血管生成,血管内皮细胞表达多种细胞因子与黏附分子,促使炎症细胞不断进入炎症滑膜,同时,随病情进展,侵蚀性病变侵入软骨或骨组织,此处血管数量及滑膜细胞增加,在各种细胞因子与炎症介质介导下,导致关节和骨破坏[18,19]。笔者认为滑膜血管增生与KOA发生及病情进展密切相关,FastADC值可敏感评价软骨损伤,而马小芳等[16]发现,轻度KOA患者与重度KOA患者FastADC值差异无统计学意义,与本研究存在差异的原因可能与纳入对象个体差异性、分级标准不同等有关。此外,本研究采用ROC曲线评价关节软骨SlowADC值、FastADC值、T2* 值对KOA诊断及病情程度评估价值,数据显示,关节内外侧SlowADC值、FastADC值、T2* 值联合应用价值最高(诊断、病情程度评估AUC分别达0.900、0.881),为临床提供有效量化参考依据。
综上可知,多b值DWI及T2* mapping成像软骨定量分析技术可早期评价KOA软骨损伤,并可区别不同时期KOA,为临床诊治提供理论参考。

