基于Chirp编码激励的微型介入式超声消融方法研究
陈贝翼, 宁传龙, 张 瑞, 黄文昌,徐 杰, 邵维维, 崔崤峣*
1. 中国科学技术大学生物医学工程学院(苏州), 生命科学与医学部, 江苏 苏州 215000;2. 中国科学院苏州生物医学工程技术研究所, 江苏 苏州 215163
1 引言
近年来,针对肿瘤、心脑血管等重大疾病的治疗更多趋于微创或无创的新型物理治疗技术,其中,高强度超声治疗技术以其安全性高、不良反应小、成本低、适用范围广等特点倍受关注[1]。高强度超声治疗一般为高强度聚焦超声(high-intensity focused ultrasound,HIFU),采用体外聚焦的超声探头,将超声波能量聚焦于体内某靶区部位,利用超声的热效应和空化效应等特性,使靶区内的组织温度升高至60 ℃及以上,造成组织细胞不可逆凝固性坏死,从而达到肿瘤等病灶消融的目的[2]。目前,一方面,现有的HIFU设备对病灶区域的消融多是通过机械扫描方式逐点移动体外聚焦式超声探头,使得能量逐渐覆盖病灶区域。受探头焦点尺寸的限制,妇科肿瘤等疾病的治疗时间将长达1~2 h。这样治疗过程中可能会因为患者的肢体位移,造成消融区域的不准确[3,4]。另一方面,对于一些深部组织病变,由于体位和器官遮挡等,HIFU从体外的聚焦方式不能很好地满足临床的需求。
因此,采用微型介入式超声探头,通过自然腔道或者是介入手术的方式,在体内更接近病灶部位的地方实施高强度超声治疗,可以最大程度避免不必要的热损伤,获得更好的治疗效果。Nazer等[5]研究表明介入式超声可以在不破坏健康的心外膜组织的情况下,对内部的病灶实现消融。Ghoshal等的实验证实了介入式超声消融治疗脑组织的可行性[6],介入式超声探头可以通过微创的方式在体外超声不易达到的位置对病灶进行消融[7]。通常来说,功率型治疗换能器的能量转换率与其体积成正比,介入式超声治疗探头体积一般较小,在一定激励条件下所产生的能量有限,也使覆盖同样尺寸病灶所需的时间较长[6]。
一般的治疗超声激励多采用恒定频率的正弦波,在超声成像领域有较多研究采用Chirp编码激励方式来提高高频超声成像的信噪比[8]。Wang等研究表明,Chirp编码激励高强度超声会影响超声的热效应和空化效应[9-12]。为了在微创介入治疗情况下,尽可能扩大消融治疗区域、缩短治疗时长,本文提出一种基于Chirp编码激励的介入式超声消融方法。
2 方法
Chirp编码信号一般是正弦信号在脉冲持续时间内经过线性调频产生,主要有频率信息丰富、发射带宽宽等特点,影响其性能的参数有扫频区间、扫频周期、扫频方向,Chirp编码波形及参数示意图如图1所示。扫频区间表示起始频率至终止频率的跨度,扫频周期表示从起始频率线性增减至终止频率的周期所需要的时间,扫频方向表示在扫频周期内频率是线性递增(向上扫频)还是线性递减(向下扫频)。
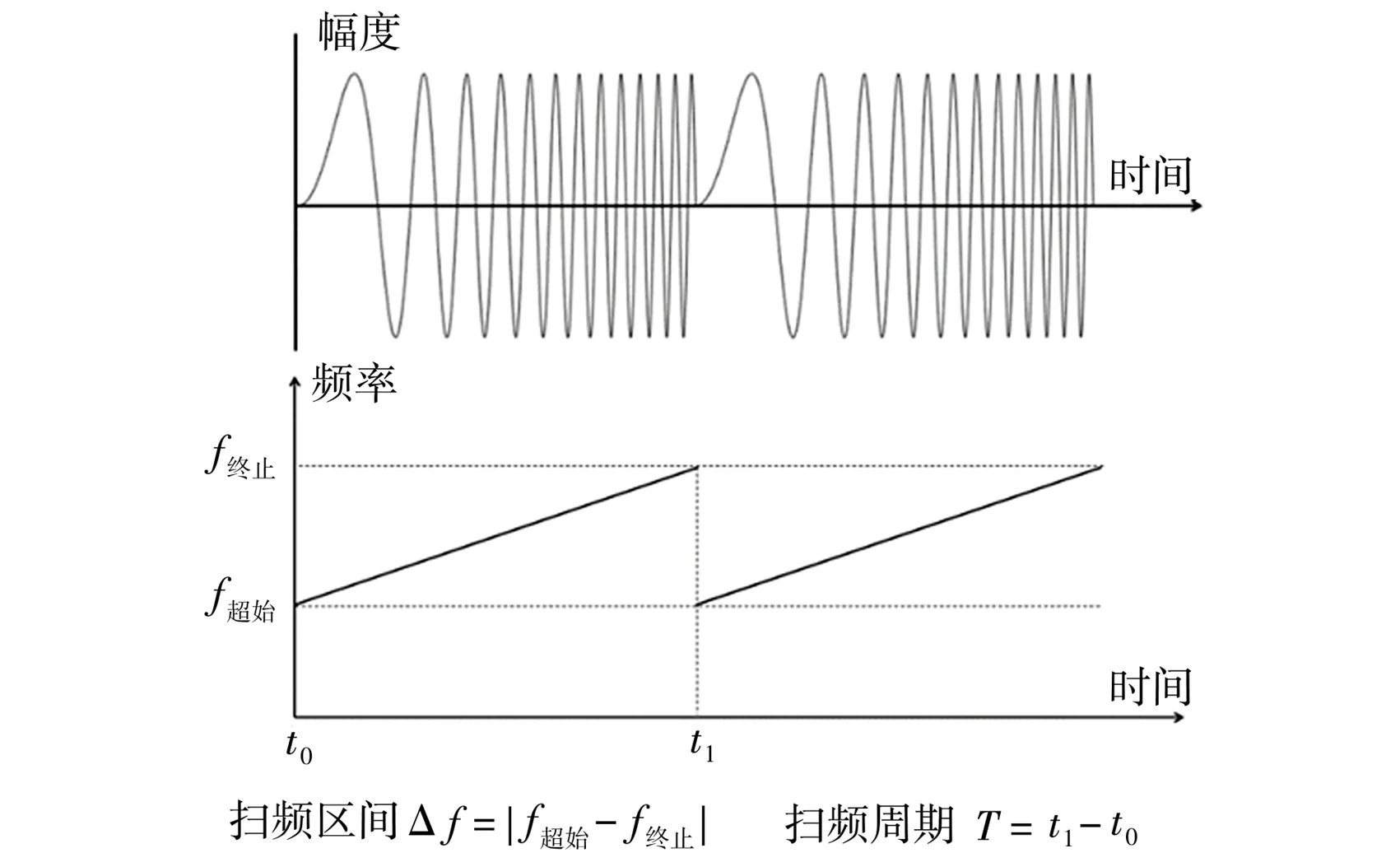
图1 Chirp编码波形及参数示意图
本文首先自主设计并研制了一套功率型超声Chirp编码激励电路模块,接着在自制的实验平台上,对Sonic Concepts公司的HIFU探头分别采用恒定频率和Chirp编码激励方法,比较验证消融结果。最后进一步将Chirp编码激励方法运用于实验室自主研制的微型介入式超声换能器,通过仿体实验充分比较验证这种基于Chirp编码的激励方法用于介入式超声治疗的可行性和有效性。
2.1 Chirp编码激励电路模块的设计研制
为了更好地实现Chirp编码激励中扫频参数的任意可调,本文自主研制的Chirp编码激励电路模块的整体框图如图2所示,实物图如图3所示。上位机界面可供用户选择扫频参数,FPGA通过串口接收扫频指令[13],分解为起止频率和变频速率,然后采用频率可变的直接数字频率合成技术(DDS)输出Chirp编码扫频数字信号,实现扫频参数的任意可调。为了驱动超声换能器,设计了四级放大电路,输出功率可至30 W以上。本文对研制的Chirp编码激励模块进行了初步测试,设计要求为产生扫频区间200 kHz(8.0~8.2 MHz)的Chirp编码信号。数字示波器显示的输出信号频谱图如图4所示,仅有8.0~8.2 MHz的频率成分的功率绝对值在-30 dBm以上,输出频谱结果符合设计要求。
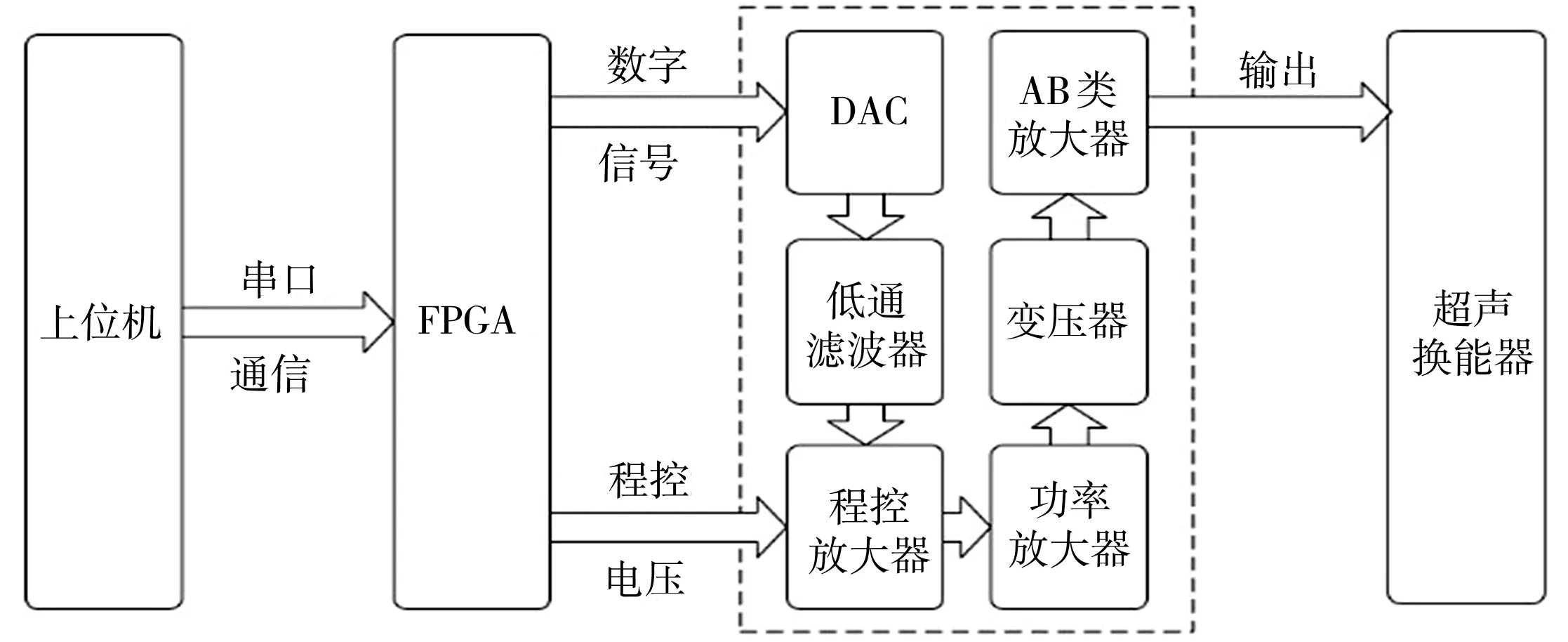
图2 Chirp编码激励模块整体框图

图3 Chirp编码激励电路模块实物图
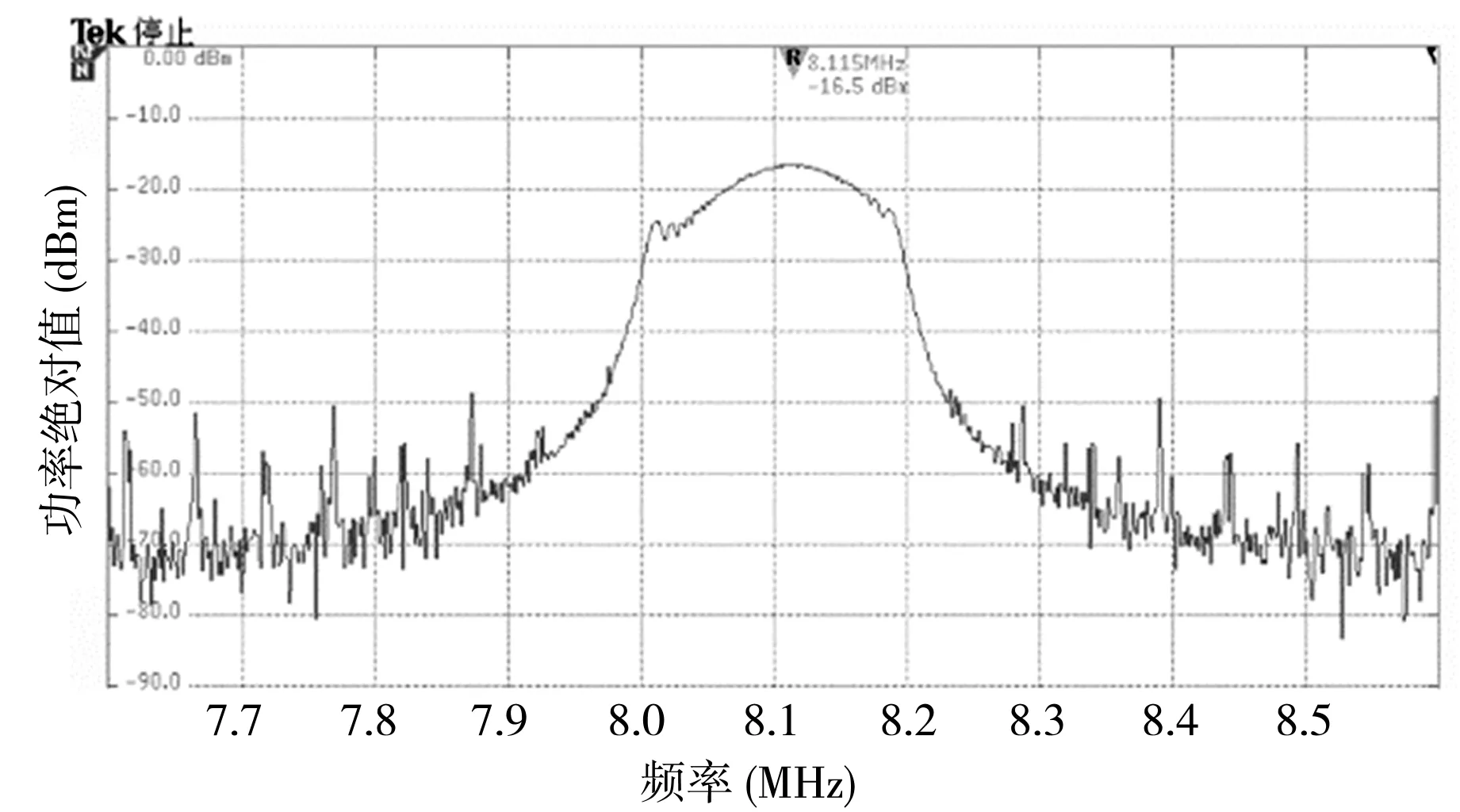
图4 模块输出频谱图
2.2 实验平台与仿体
本文的仿体实验采用聚丙烯酰胺(PAA)仿体,实验装置如图5所示。PAA仿体是添加了30%蛋白的聚丙烯酰胺凝胶,声学参数与离体肝脏和肌肉相似。室温下仿体呈透明色,研究表明当温度上升到60 ℃及以上,仿体会变成不透明白色,因此经常选用它来进行HIFU消融实验[14]。仿体和超声换能器均浸没于装满除气去离子水的恒温箱中,恒温箱温度设为35 ℃,以模仿人体内的基础温度。仿体和超声换能器由夹持件固定,周围的反射面均放置了吸声海绵。实验采用的高强度超声换能器参数如表1所示。实验室自主研制的微型介入式换能器实物图及声场分布如图6所示。
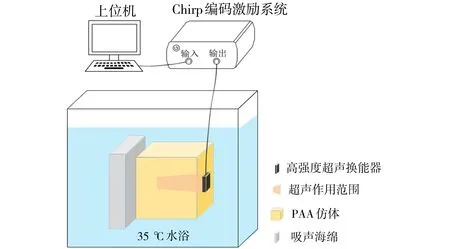
图5 实验装置示意图

表1 高强度超声换能器参数
2.3 治疗效果评估方法
根据PAA仿体达60 ℃变白的特性,实验后仿体的白色区域即超声消融的有效范围。本文采用俯视[图6(b)中的Y方向]剖面的仿体白色区域来量化评估治疗效果,定义白色区域与超声发射方向垂直的最宽距离为横向宽度,白色区域与超声发射方向平行的最长距离为径向长度。高强度超声换能器消融的横向宽度、径向长度分别如图7、图8所示。用直尺分别测量消融范围的横向宽度和径向长度,记录上述消融结果并做统计学分析。统计学分析采用双尾t检验,检验两种不同激励方法的消融结果间的差异性,若t检验的P<0.05,则认为两种激励方法的消融结果差异有统计学意义,即检验的两种激励方法改变了超声的消融范围的大小。
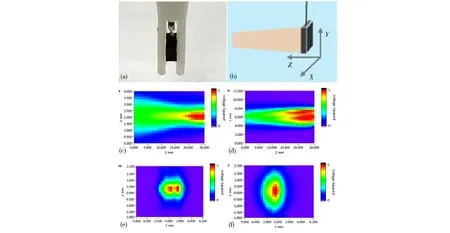
图6 微型介入式换能器实物图及声场分布(a) 实物图; (b) 声场测量示意图; (c) XOZ平面; (d) YOZ平面; (e) 10 mm处XOY平面; (f) 25 mm处XOY平面
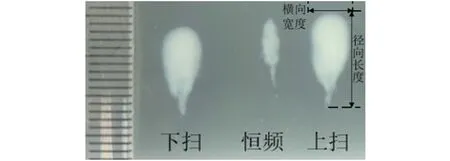
图7 仿体内恒频与Chirp编码激励HIFU消融俯视剖面对比(直尺最小刻度1 mm)
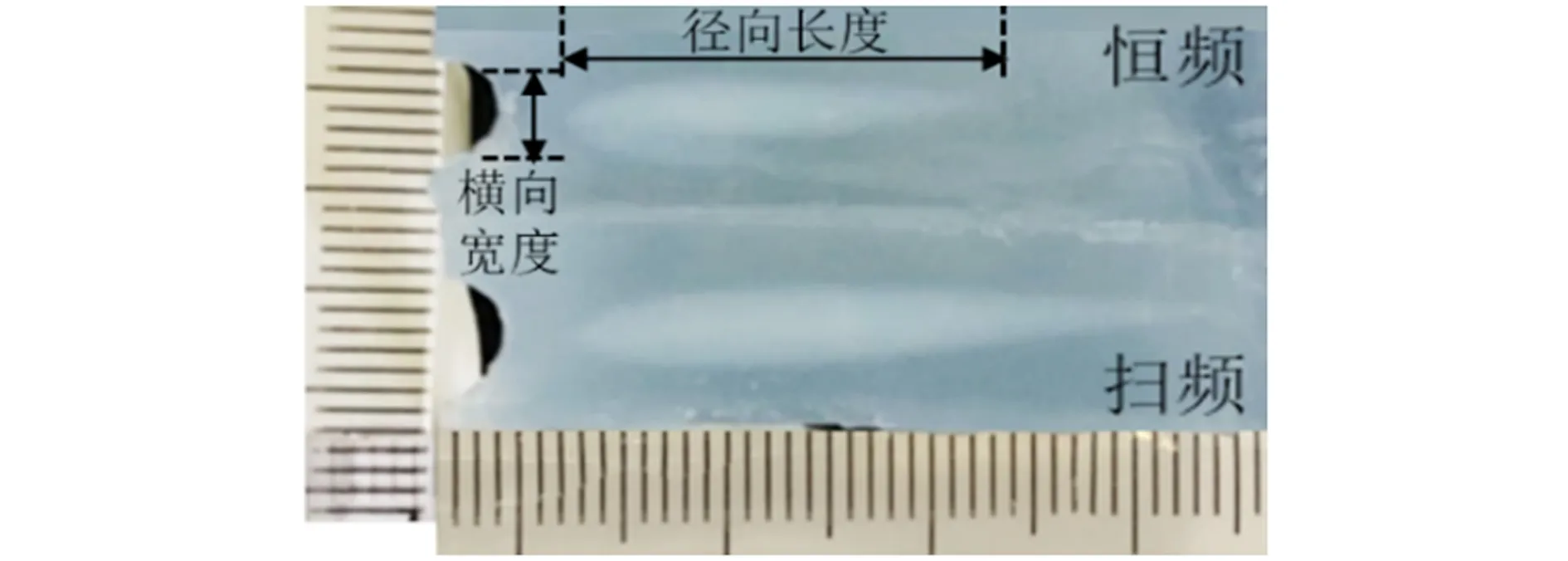
图8 仿体内恒频与Chirp编码激励微型介入式换能器消融俯视剖面对比(直尺最小刻度1 mm)
3 结果与讨论
3.1 高强度聚焦超声探头实验结果
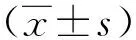

表2 仿体内恒定频率与Chirp编码激励HIFU消融对比实验
恒定频率与Chirp编码激励HIFU消融俯视剖面图(对照组A与实验组A1、A2,每组实验重复3次)见图7,超声发射方向从上往下。量取HIFU消融的横向宽度和径向长度,多次数据的统计结果如图9所示。从图9可以看出,向上扫频、向下扫频的激励方法在横向宽度和径向长度上的均值都大于恒定频率的结果。将恒定频率的消融结果分别与向上扫频、向下扫频两种激励方法的样本做t检验,差异均有统计学意义(P<0.05)。所以,在相同条件下,Chirp编码的激励方法能有效增大HIFU单次消融的横向宽度和径向长度,扩大消融范围。
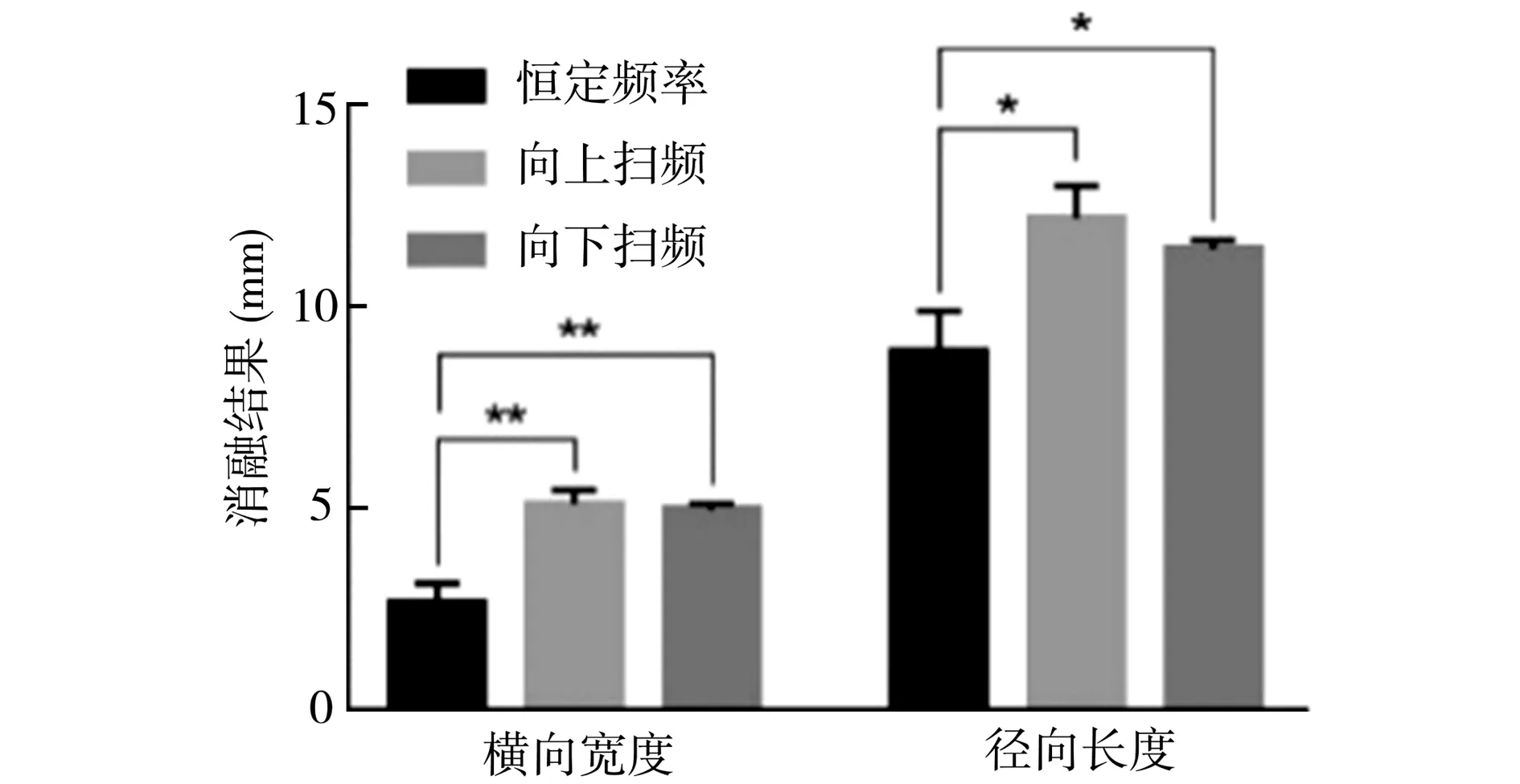
图9 仿体内恒频与Chirp编码激励HIFU消融结果对比(n = 3,*:P<0.05,**:P<0.01)
HIFU实验还探讨了Chirp编码的扫频方向、扫频周期对消融范围的影响,比较不同扫频方向(实验组A1、A2)、扫频周期(实验组A1、A3、A4)的HIFU消融范围。经统计学分析,向上扫频与向下扫频的消融结果均无统计学差异(P>0.05)。不同扫频周期的俯视剖面如图10所示,图10中可以看出改变扫频周期对HIFU消融范围的影响不大。扫频方向、扫频周期两参数在微型介入式换能器的实验中不再讨论。

图10 仿体内不同扫频周期HIFU消融俯视剖面对比(直尺最小刻度1 mm)
3.2 微型介入式超声换能器实验结果

表3 仿体内恒定频率与Chirp编码激励微型介入式超声换能器消融对比实验
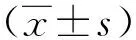
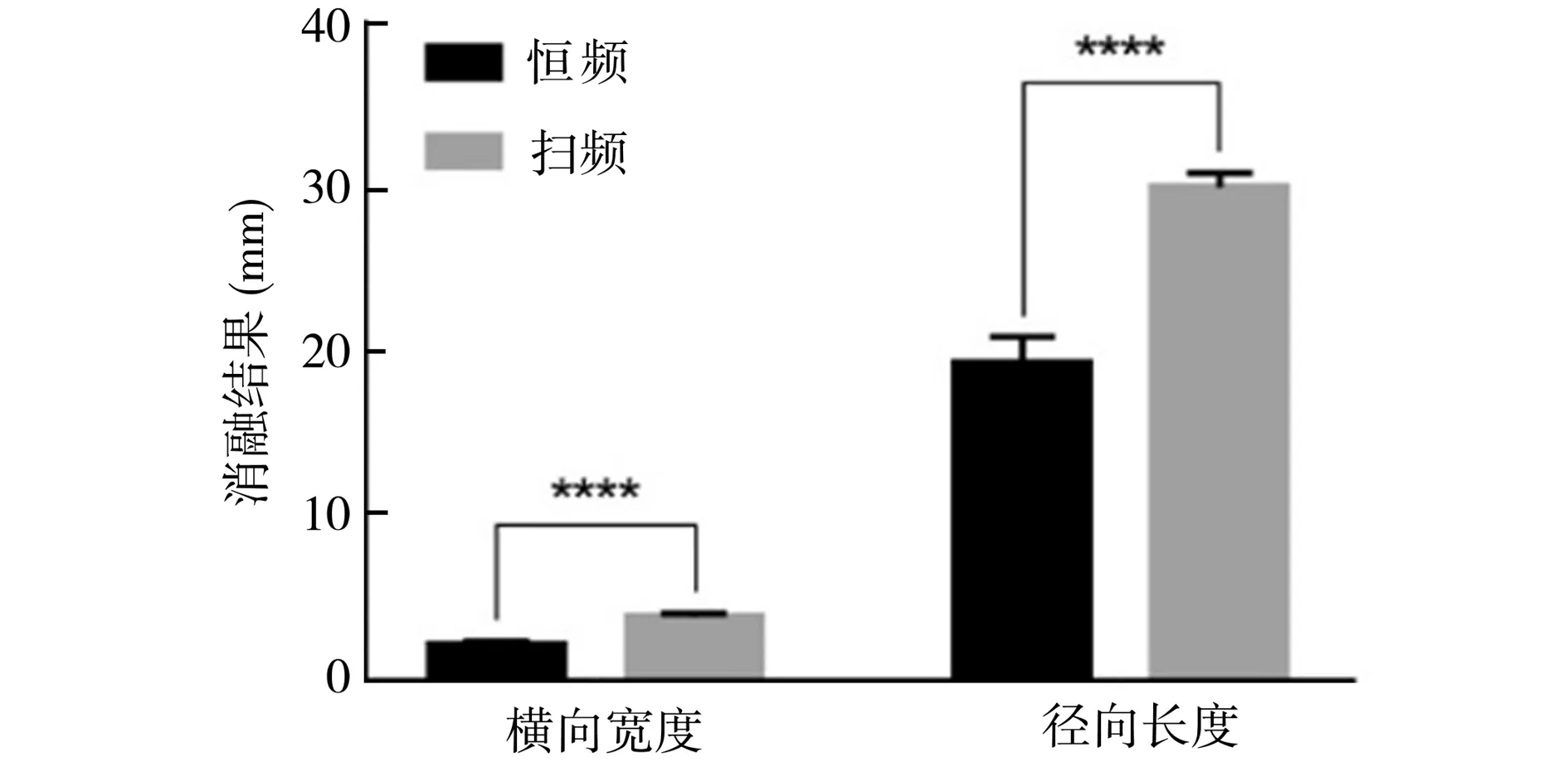
图11 仿体内恒频与Chirp编码激励微型介入式换能器消融结果对比(n = 3,****:P<0.0001)

图12 仿体内恒频与Chirp编码激励微型介入式换能器不同距离温度曲线对比(n=3)
改变Chirp编码的扫频区间,探究不同扫频区间对微型介入式换能器消融范围的影响。图13为微型介入式换能器消融不同扫频区间的俯视剖面图(实验组B2、B3、B4),超声发射方向为从左到右。量取微型介入式换能器消融的横向宽度和径向长度,多次数据的统计结果如图14所示。结果表明,增加扫频区间至1 MHz(7.5~8.5 MHz)、2 MHz(7.0~9.0 MHz),微型介入式换能器消融的横向宽度、径向长度的均值反而增大。将扫频区间分别为2 MHz与400 kHz的消融结果进行t检验,两组的横向宽度、径向长度的差异均有统计学意义。因此,扩大扫频区间不会缩小微型介入换能器的消融范围,即实验室自研的微型介入换能器在至少2 MHz的带宽内频率响应良好。

图13 仿体内不同扫频区间激励微型介入式换能器消融俯视剖面对比(直尺最小刻度1 mm)
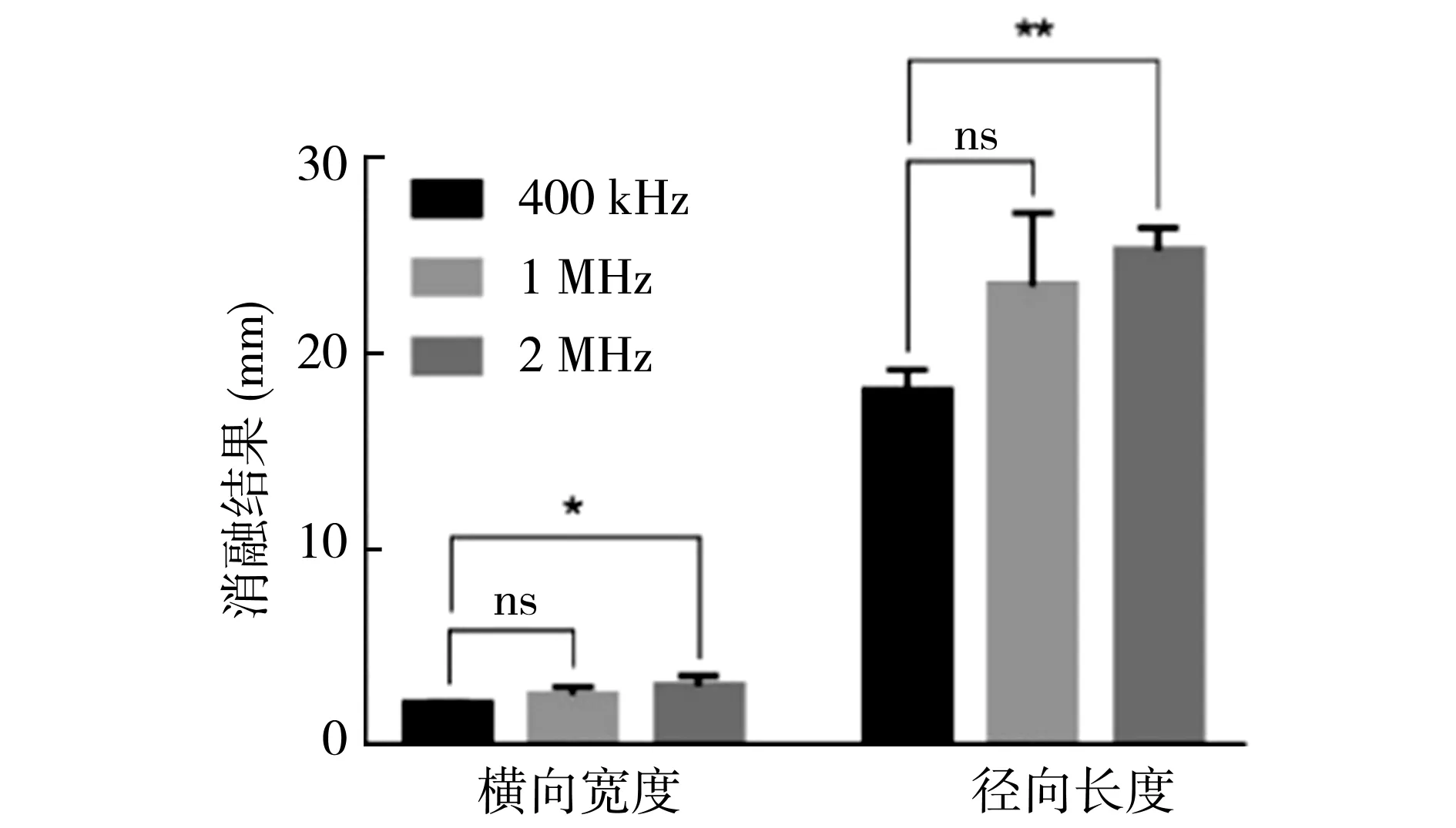
图14 仿体内不同扫频区间激励微型介入式换能器消融结果对比(n=3,*:P<0.05,**:P<0.01,ns:P>0.05)
3.3 讨论
Chirp编码的激励方法导致超声消融范围扩大,原因可能是功率型超声的作用区域会随频率变化,这使原来有限区域内过剩的高温分散,从而使达60 ℃以上的区域更大,即扩大了临床所需的消融范围。图12中仿体10 mm处,采用Chirp编码比恒定频率的最高温度更低,但25 mm处采用Chirp编码的最高温度却更高,达到了60 ℃以上,这样的现象支撑了Chirp编码使高温分散,从而导致相同时间内消融范围扩大的推论。
4 结语
本文提出了一种基于Chirp编码激励的介入式超声消融方法,并结合自主研制的微型介入式超声换能器和小型化Chirp编码激励电路模块,实验验证讨论了该方法的有效性。PAA仿体实验结果表明:采用Chirp编码激励方法,可以在相同时间内扩大单次消融的有效治疗区域;在保证完整覆盖所需治疗面积的基础上,Chirp编码激励方法能有效减少整体的消融时间。上述研究工作为后续进一步相关仪器开发奠定了良好的基础。

