钆塞酸二钠增强MRI肝胆期高信号病变影像表现与特征分析
徐磊贾中正张学琴张涛陈莹刘茂童
钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)是一种肝细胞特异性MRI对比剂,同时兼具非特异性细胞外间隙对比剂的特性和功能肝细胞特异性对比的特性,对肝脏局灶性病变的检出和特征的显示具有独特的优势[1]。近年来,Gd-EOB-DTPA已广泛应用于肝脏病变的诊断,相较于使用传统对比剂增强的CT或MRI,部分病变在Gd-EOB-DTPA增强MRI肝胆期的信号表现具有一定特征[2]。既往有文献[3-4]报道了Gd-EOB-DTPA增强MRI肝胆期高信号病变的影像表现及高信号形成机制,但表现肝胆期高信号病变有很多,尚未有研究对其进行总结、分型并探讨。本研究旨在总结肝胆期表现为高信号的肝脏局灶性病变的影像学特征,并进行分型,以提高对Gd-EOB-DTPA增强MRI肝胆期高信号病变的认识。
1 资料与方法
1.1 一般资料 回顾性纳入2015年1月—2020年6月于南通市第三人民医院确诊为肝脏局灶性病变且行Gd-EOB-DTPA增强MRI检查的病人124例,男75例,女49例,年龄21~84岁,平均(55.1±15.8)岁。纳入标准:①增强MRI肝胆期,病灶呈高信号表现;②良性病灶,经手术病理证实或影像表现典型且随访2年以上未见增大;③恶性病灶,经手术病理证实或结合临床及随访证实。排除标准:①病灶高信号范围小,影响数据测量;②影像质量差,不能满足诊断要求。124例病人共纳入124个病灶,其中恶性病灶69个,良性病灶55个。恶性病灶包括肝细胞癌(hepatocellular carcinoma,HCC)52个、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)7个、混 合 型HCC-胆 管 癌(combined hepatocellular cholangiocarcinoma,cHCC-CC)4个、肝脏转移瘤(hepatic metastases,HM)6个(5个为胃肠道转移,1个为乳腺肿瘤转移)。良性病灶包括局灶性结节增生(focal nodular hyperplasia,FNH)及FNH样变42个,肝腺瘤(hepatocellular adenoma,HCA)2个、异型增生结节(dysplastic nodule,DN)5个、肝海绵状血管瘤(cavernous hemangioma of liver,CHL)6个。
1.2 设备与方法 采用飞利浦Achieva TX 3.0 T MR扫描设备,16通道相控阵体线圈。扫描范围从膈顶至双肾下极。常规序列包括快速自旋回波(TSE)T2WI抑脂序列、化学位移成像(同相位和反相位T1WI)和扩散加权成像(DWI)(b=0、800 s/mm2)。增强扫描经肘静脉团注对比剂Gd-EOB-DTPA(质量浓度181.43 mg/mL,拜耳医药公司),注射剂量0.025 mmol/kg体质量,流率1.0 mL/s。注射对比剂后用20 mL生理盐水冲洗。分别在动脉期(20 s)、门静脉期(60 s)和移行期(180 s)进行T1高分辨率各向同性容积激发(T1high-resolution isotropic volume excitation,THRIVE)序列扫描。注射对比剂后20 min采集肝胆期影像。肝胆期扫描参数:TR/TE 3.20 ms/1.15 ms,翻转角10°,层厚5.0 mm,激励次数1,FOV 400 mm×352 mm,矩阵268×236,共90层,扫描时间12 s。
1.3 影像分析及分型 由2位分别有8年及12年腹部诊断经验的放射科医师在PACS工作站分析所有Gd-EOB-DTPA增强MRI肝胆期影像,意见不一致时协商确定。定量参数由每位医师测量3次,取其平均值作为该医师的测量结果,再取2位医师的平均值作为最终结果。相同性质且相同表现的高信号病灶,只纳入最大病灶进行分析。在病灶最大层面勾画ROI并进行测量。病灶的ROI尽量包含病灶中高信号区域,肝脏的ROI尽量避开大的血管、胆管及伪影。分别测量肝胆期同层面病灶及肝脏的信号强度(signal intensity,SI),计算病灶-肝脏信号强度比(lesion to live contrast ratio,LLR),LLR=SI病灶/SI肝脏。根据强化方式将病灶肝胆期高信号(病灶内或边缘信号值高于邻近正常肝组织)分为Ⅰ-Ⅳ型[4-5],并根据有无包膜分为不同亚型[包膜指在门静脉期或移行期环绕病灶的光滑、均匀的环形结构(可呈高信号或低信号)]:①Ⅰ型为均质型,整个病灶信号值均高于周围正常肝实质;可分为Ⅰa(无包膜)、Ⅰb(有包膜且大部分或完整)亚型。②Ⅱ型为镶嵌型,病灶内见线条状、斑片状或网格状分布的不均匀“马赛克”样高信号;可分为Ⅱa(无包膜)和Ⅱb(有包膜)亚型。③Ⅲ型为结节中结节型,低信号病灶内见结节状高信号。④Ⅳ型为甜甜圈型,病灶边缘呈规则或不规则高信号,内部呈低信号;可分为Ⅳa(高信号在病灶内)和Ⅳb(高信号在病灶外)亚型。详见图1、2。
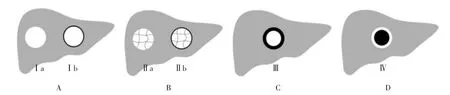
图1 肝脏增强MRI肝胆期高信号病灶分型示意图。A-D图分别为Ⅰ-Ⅳ型。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析。采用Kolmogorov-Smirnov法对计量资料进行正态分布检验,非正态分布的计量资料以中位数[M(P25,P75)]表示,多组间比较采用Kruskal-Wallis检验,组间两两比较采用Steel-Dwass检验。计数资料以例(%)表示,组间比较采用Fisher确切概率检验。P<0.05为差异有统计学意义。
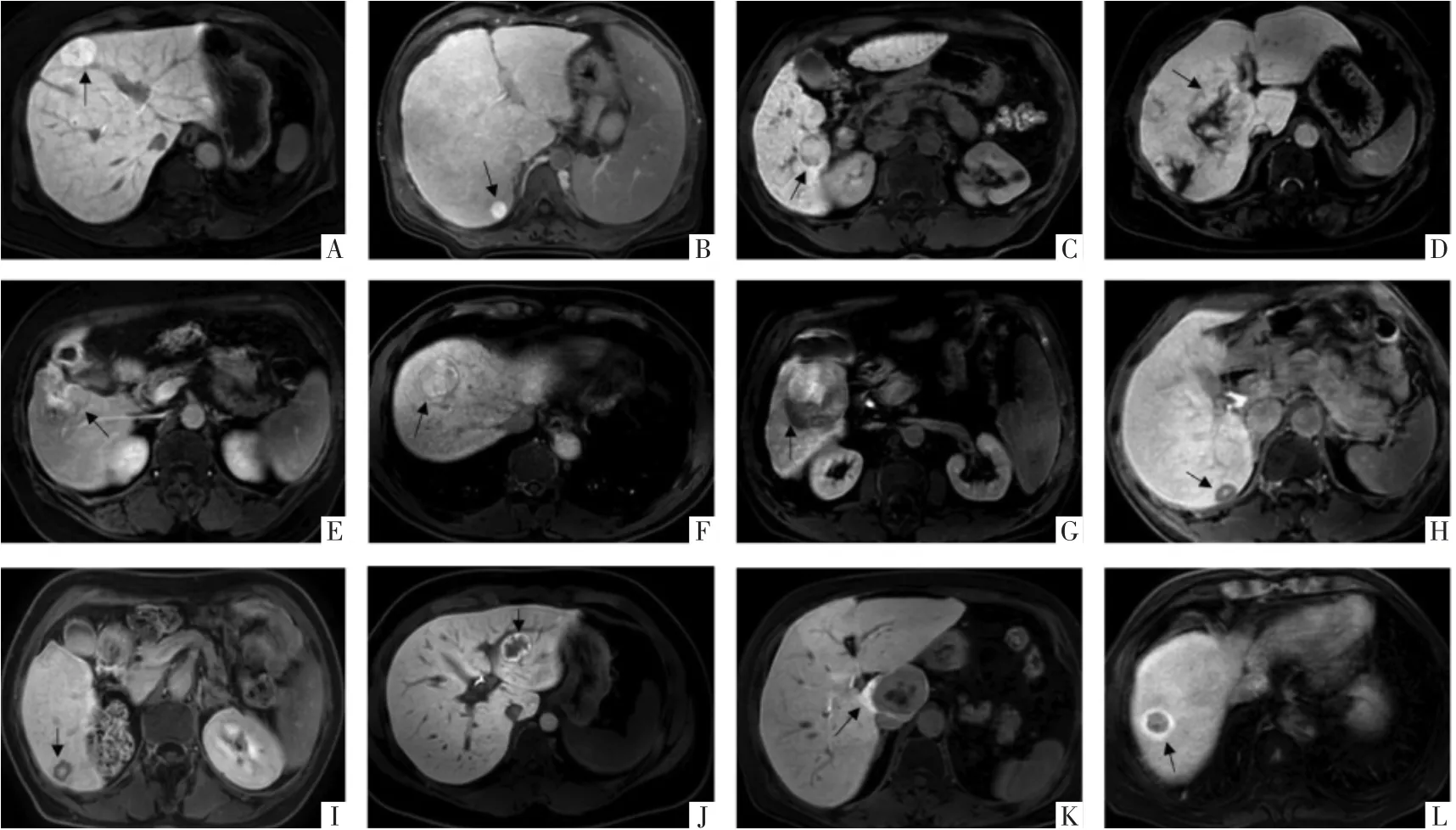
图2 肝脏增强MRI肝胆期高信号病灶不同分型的横断面影像表现。A图,肝左内叶FNH,肝胆期呈均匀高信号(Ⅰa型);B图,肝右后叶DN,肝胆期为均匀高信号(Ⅰa型);C图,肝右后叶HCC,肝胆期中央均匀高信号伴低信号包膜(Ⅰb型)。D图,肝前右叶CHL,病灶多发且肝胆期呈不均匀高信号(Ⅱa型);E图,肝右前叶HM,表现为“马赛克”样高信号(Ⅱa型);F图,肝右前叶HCC,表现为不均匀高信号伴周围低信号包膜(Ⅱb型);G图,肝右前叶cHCC-CC,呈不均匀“马赛克”样高信号伴低信号包膜(Ⅱb型)。H图,肝右后叶HCC,表现为中央高信号周围环形低信号(Ⅲ型);I图,肝右后叶ICC,呈中央高信号周围环形低信号(Ⅲ型)。J图,肝左外叶FNH,肿瘤边缘环形高信号,表现为“甜甜圈”样改变(Ⅳa型);K图,肝尾状叶HCA,肿瘤周围见不规则环形高信号(Ⅳb型);L图,肝右前叶HCC,肿瘤周围见明显环形高信号(Ⅳb型)。
2 结果
2.1 肝胆期高信号病灶中不同分型间占比的比较HCC、ICC、HM、FNH/FNH样变和DN中4种分型间占比的差异均有统计学意义(均P<0.05)。HCC病灶中28个可见包膜(53.85%),各分型中Ⅱb型最多(23/52,44.23%);ICC病灶中Ⅱa型和Ⅲ型最多(均为3/7,42.86%);HM病灶中Ⅱa型最多(4/6,66.66%),且均为胃肠道转移瘤;FNH/FNH样变中Ⅳa型最多(32/42,76.19%);DN病灶中Ⅰa型最多(4/5,80.00%)。cHCC-CC、HCA和CHL中4种分型间占比的差异均无统计学意义(均P>0.05)。其中,4个cHCC-CC病灶中3个为HCC,仅1个为ICC(Ⅱa型)。2个HCA病灶分别为Ⅰa型[β-catenin激活型(B-HCA)]及Ⅳb型[炎症型(I-HCA)]。详见表1。
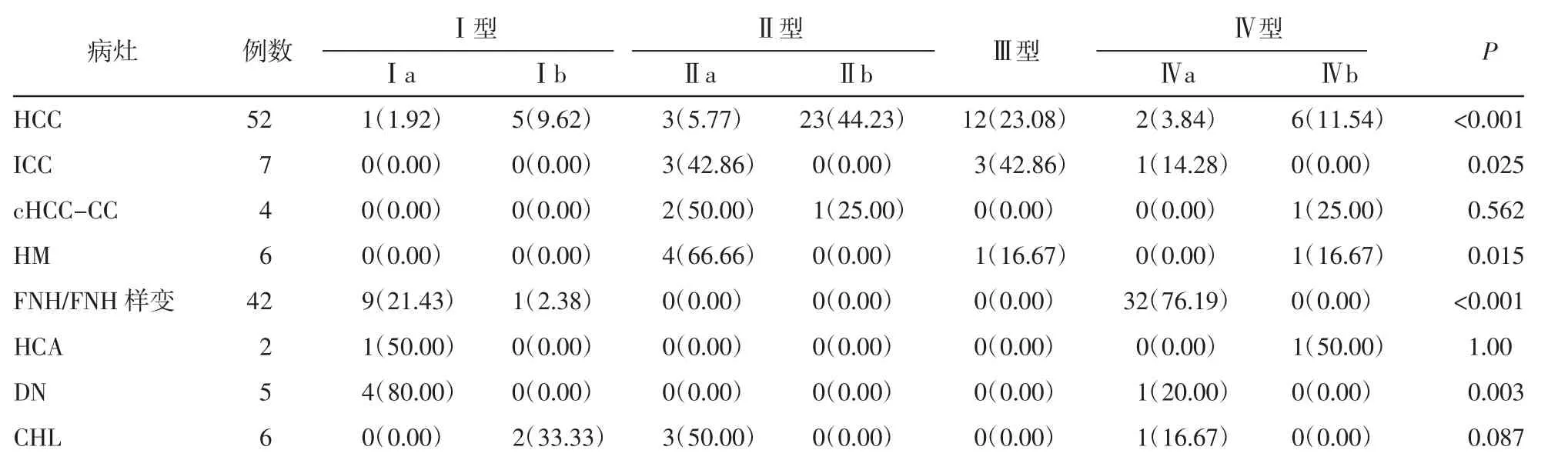
表1 肝胆期高信号病灶不同分型间占比的比较 例(%)
2.3 肝胆期高信号不同病灶的LLR比较HCC、ICC、cHCC-CC、HM、FNH/FNH样变、DN和CHL肝胆期LLR分别为1.08(1.05,1.15)、1.07(1.06,1.09)、1.06(1.05,1.20)、1.11(1.05,1.12)、1.20(1.09,1.31)、1.20(1.09,1.46)和1.11(1.06,1.19),2例HCA的LLR分别为1.07及1.35。上述肝胆期高信号不同病灶间LLR的差异有统计学意义(H=21.432,P=0.003),HCC的LLR低 于FNH/FNH样 变(P=0.003),其余病灶间LLR两两比较的差异均无统计学意义(均P>0.05)。
3 讨论
Gd-EOB-DTPA主要由功能肝细胞摄取,通过位于肝细胞膜上的有机阴离子转运蛋白(organic anion-transporting polypeptide 1B3,OATP1B3)摄入,然后通过肝细胞膜上的多耐药蛋白排出[6]。肝胆期含无功能肝细胞的局灶性病变通常表现为低信号,但由于增生肝细胞摄取、肿瘤细胞摄取、细胞外间隙滞留、瘤周滞留及肿瘤内胆道强化等原因,可导致部分肝脏局灶性病变在肝胆期可部分或全部表现为高信号[4,7]。
HCC在肝胆期通常为低信号。HCC肝胆期高信号的机制主要是肿瘤细胞摄取对比剂及对比剂在瘤周滞留,高信号HCC中OATP1B3的表达较高,而低信号HCC表达较低或不表达[6]。Kitao等[3]发现随着HCC的进展,其分化程度逐渐降低,肝胆期信号也随之降低,因此肝胆期高信号HCC的恶性程度低于低信号HCC,高信号HCC术后复发率明显低于低信号HCC。本研究52例肝胆期高信号HCC中,以Ⅱb型及Ⅲ型较多见。Suh等[5]发现肝胆期病灶中存在对比剂未摄取区域及低信号包膜是诊断HCC的重要依据,对比剂未摄取区域定义为肝胆期病灶内存在低信号区以及低信号分隔,可能反映肿瘤的坏死、异质组织分化或去分化,与Ⅱ型“马赛克样”表现有关,该研究中55%的HCC肝胆期有低信号包膜,本研究中53.85%的HCC有包膜,且本研究中50%的HCC为镶嵌型(Ⅱ型),与Suh等[5]报道的结果相符。本研究中23.08%的HCC表现为Ⅲ型,HCC这种表现与OATP1B3的表达有关,也反映了肝硬化结节的多步癌变过程[3]。HCC另一种高信号机制为对比剂瘤周滞留[4],体现在Ⅳb型中,主要原因为肿瘤周围存在增生的肝细胞表达OATP1B3,本研究中有此表现者占11.54%。
病理上ICC肿瘤细胞多位于肿瘤外周,中央为纤维间质和坏死,纤维间质较正常组织的细胞外间隙要大,致使Gd-EOB-DTPA不能正常排出,因此其肝胆期高信号的发生机制为对比剂在细胞外间隙滞留。有文献[8]报道,ICC肝胆期多呈分层状(即不均匀马赛克样高信号)或靶样高信号(即结节中结节样高信号),本研究7例ICC在镶嵌型(Ⅱa)及结节中结节型(Ⅲ)占比最高,与文献[8]报道结果相符。
cHCC-CC兼具HCC和ICC 2种肿瘤成分,和/或伴有干细胞分化特征,在Gd-EOB-DTPA增强MRI肝胆期表现多样,多呈低信号。文献[9]报道,富血供cHCC-CC中HCC占比较高,ICC占比较低,纤维间质少,而肝胆期呈靶样表现的cHCC-CC中ICC占比较高,纤维间质多。本研究cHCC-CC中的3例HCC成分多的分别为Ⅱa型、Ⅱb型和Ⅳb型,另1例ICC成分多的呈Ⅱa型,可见,cHCC-CC内肿瘤成分比例不同,肝胆期高信号表现为多种分型。
有研究[10]发现,超过50%的乳腺癌肝转移灶在肝胆期呈周围低信号、中央高信号的靶样信号特征(Ⅲ型),而胃肠道转移瘤可表现为不均质的肝胆期高信号(Ⅱ型)。HM肝胆期高信号主要源于肿瘤内部促结缔组织增生反应导致细胞组织间隙扩大及内部组织的凝固性坏死,从而使对比剂滞留。本研究中4例胃肠道转移瘤在肝胆期表现为Ⅱ型,1例乳腺癌肝转移灶表现为Ⅲ型,这与文献[10]报道结果基本相符。
FNH由增生的肝细胞和中央疤痕两部分组成,其出现肝胆期高信号的机制为增生的功能性肝细胞对Gd-EOB-DTPA的摄取,因为中央疤痕不含或几乎不含功能性肝细胞,故肝胆期呈低信号[4],而周围有增生的肝细胞存在,能表达较多OATP1B3,因此在肝胆期呈环状或甜甜圈状高信号,出现率为50%~60%[11]。本研究中病灶呈甜甜圈样高信号(Ⅳa型)的占比为76.19%,与文献[11]报道的高出现率相符。<3 cm的FNH通常没有肉眼可见的中央疤痕,因此肝胆期呈均匀高信号[2]。FNH样变通常发生于肝硬化病人,尤其是酒精性肝硬化者。Suh等[5]研究发现,FNH样变在组织病理学上与FNH无区别或相似。
HCA病理分类分为β-catenin激活型(B-HCA)、HNF-1α失活型(H-HCA)、炎症型(I-HCA)和未分类型(U-HCA)4种亚型[12]。肝胆期HCA通常呈低信号,而有研究[4,12]显示,有80%以上的B-HCA型和26%~33%的I-HCA型可以在肝胆期摄取Gd-EOB-DTPA,表现为等或高信号,另2型未发现有肝胆期高信号的报道,分析其原因可能与肿瘤细胞表达OATP1B3有关,因此HCA的肝胆期高信号机制为肿瘤细胞摄取对比剂。本研究只收集了2例HCA,B-HCA表现为Ⅰa型、I-HCA为Ⅳb型,与文献[4,12]报道的B-HCA型及I-HCA型可以在肝胆期表现为高信号相符。
CHL在Gd-EOB-DTPA增强MRI中延迟强化是由于对比剂进入多个血管通道并缓慢充填病灶,故肝胆期可表现为高信号,其发生机制是对比剂在细胞外间隙的滞留[4]。Tamada等[13]报道,有47%的CHL在肝胆期显示肿瘤内有不均匀的高信号。本研究6例CHL中有3例(50%)表现为不均匀“马赛克”样高信号,与Tamada等[13]报道结果相仿。
肝硬化相关结节还包括再生结节、低度异型增生结节和高度异型增生结节[14]。有研究[15]发现,再生结节及低度异型增生结节因含有增生的肝细胞,OATP1B3过度表达,导致病灶肝胆期信号与周围正常肝脏相似或高于周围肝脏,大部分病灶呈均匀高信号,少部分病灶可呈甜甜圈样高信号,因病灶在动脉期无明显强化,故可与FNH区别,而大多数高度异型增生结节在肝胆期呈低信号。本研究5例DN中4例为均质型(Ⅰa型),1例呈Ⅳa型,与文献[15]报道的研究结果相符。
Suh等[5]研究显示,HCC与良性病变(FNH与肝硬化相关结节)的LLR差异无统计学意义。本研究结果显示,HCC的肝胆期LLR低于FNH/FNH样变,而HCC与DN肝胆期LLR的差异无统计学意义,与Suh等[7]研究结果不同,考虑与入组病例样本量不同及病灶OATP1B3的表达有关。
本研究存在以下局限性:①本研究为回顾性研究,研究结果会受选择偏倚的影响。②并非所有的病变均经组织病理学证实。③除了HCC与FNH病例较多外,其他病例数均较少。后期将进行多中心研究、扩大样本量,以进一步细化分型并深入分析。
综上所述,肝脏病变可在Gd-EOB-DTPA增强MRI肝胆期呈高信号改变,但HCC的不均质“马赛克”样高信号伴低信号包膜及FNH甜甜圈样高信号是相对特征性表现。由于不同病变高信号形成的机制不同,因此肝胆期信号的特征也会有差异,通过了解这些机制,总结分析肝胆期高信号病变的影像表现,有助于提高临床医生对肝脏局灶性病变的诊断和鉴别诊断。

