外周血Th17/Treg失衡与儿童免疫性血小板减少症严重程度及预后的关系
黄宝山
免疫性血小板减少症是一类获得性自身免疫性疾病,高发于儿童,以血小板减少及出血为主要临床特征[1]。由于儿童免疫性血小板减少症的发病机制尚未明确,缺乏根治性疗法,首选对症止血治疗,然而整体效果并不十分理想。一直以来,临床学者致力于寻找与儿童免疫性血小板减少症密切相关的指标,期望为准确评估病情提供依据,给此病的治疗带来启示。近年来,国内外研究显示,儿童免疫性血小板减少症的发生、发展与免疫功能异常导致的炎症反应有关[2-3]。鉴于辅助性T淋巴细胞17(Th17)和调节性T淋巴细胞(Treg)均是调控免疫应答过程的CD4+效应T细胞,而已有研究表明,免疫性血小板减少症患儿Th17细胞和Treg细胞分泌的细胞因子水平波动明确[4]。由此推测,外周血Th17/Treg失衡可能是导致儿童免疫性血小板减少症的启动因素,然而外周血Th17/Treg失衡是否与患儿的病情严重程度有关,对预后的评估价值如何,均有待明确,且相关研究鲜有报道。对此,本研究目的在于分析外周血Th17/Treg失衡与儿童免疫性血小板减少症严重程度及预后的关系。
1 资料与方法
1.1 一般资料
选取徐州市儿童医院2017年1月-2021年9月接诊的65例免疫性血小板减少症患儿作为研究对象。纳入标准:(1)年龄2~14岁;(2)符合文献[5]《儿童原发性免疫性血小板减少症诊疗规范(2019年版)》关于此病的诊断标准;(3)首次发病,病程不超过60 d,接受常规一线治疗;(4)患儿配合治疗、检查和随访。排除标准:(1)合并感染性疾病、恶性肿瘤、其他血液系统疾病、其他免疫系统疾病;(2)入组前接受输血及提升血小板治疗;(3)长期接受免疫调节剂治疗。根据病情严重程度,将其分为重型组(30例,血小板计数<10×109/L)和非重型组(35例,血小板计数≥10×109/L)。重型组男13例,女17例;年龄2~14岁,平均(3.62±0.83)岁;病程2~60 d,平均(14.38±1.71)d。非重型组男17例,女 18例;年龄2~14岁,平均(3.71±0.76)岁;病程 2~60 d,平均(14.35±1.68)d。两组一般资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患儿监护人知悉研究内容,签署知情同意书。
1.2 方法
所有患儿均予以丙种球蛋白和糖皮质激素治疗,静脉滴注丙种球蛋白(1 g/kg,共1次)联合甲基泼尼松龙[10 mg/(kg·d),每隔3天剂量减半,共 9 d],继之口服泼尼松 [1.5~2.0 mg/(kg·d)],持续治疗1~2个月逐渐减量,总疗程3个月。所有患儿均检测外周血指标及炎症因子水平,在治疗前 1 d,采集 2 份 5 ml静脉血,其中 5 ml血样经抗凝处理,分离提取外周血单个核细胞并制作细胞悬液,分为两份,分别用于检测Th细胞和Treg细胞。往细胞悬液加入异硫氰酸荧光素标志的抗人CD8单抗和叶绿素蛋白耦联物标志的抗人CD3单抗各5 µl,经孵育、固定、洗涤等处理后,使用美国BD FACSCanto Ⅱ流式细胞仪检测外周血Th细胞。往细胞悬液加入异硫氰酸荧光素标志的抗人CD4单抗、藻红蛋白标志的抗人CD127单抗、叶绿素蛋白耦联物标志的抗人CD25单抗共20 µl,经混匀、避光孵育等处理后,流式细胞仪检测Treg细胞。计算外周血指标(Th17细胞和Treg细胞比例及外周血Th17/Treg比值)。另外5 ml血样予以抗凝处理,离心处理,分离血清,使用酶联免疫吸附试验检测炎症因子(血清IL-4、IL-6、IL-10、IL-17)水平,检测试剂盒均来源于上海生物芯片有限公司,检测结果使用美国MD全波长酶标仪读取。
1.3 观察指标及评价标准
比较重型组和非重型组外周血指标(Th17细胞和Treg细胞比例及Th17/Treg比值)、炎症因子(血清IL-4、IL-6、IL-10、IL-17)。使用Pearson相关性分析外周血Th17/Treg比值与血小板计数、起效时间的关系(以血小板计数≥10×109/L且较治疗前至少升高1倍作为判断起效的依据)。并根据病情是否缓解,对患者进行分组,以血小板计数≥10×109/L且较治疗前至少升高2倍,无出血表现作为判断病情缓解的依据[6]。比较缓解组与未缓解组治疗前1 d外周血指标。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,符合正态分布且方差齐性的计量资料以(±s)表示,两组间采用t检验,计数资料以率(%)表示,两组间采用χ2检验,使用Pearson相关性分析外周血Th17/Treg比值与血小板计数、起效时间的关系,P<0.05为差异有统计学意义。
2 结果
2.1 重型组和非重型组外周血指标比较
重型组外周血Th17细胞比例、Th17/Treg比值均高于非重型组,Treg细胞比例低于非重型组(P<0.05),见表 1。
表1 重型组和非重型组外周血指标比较(±s)
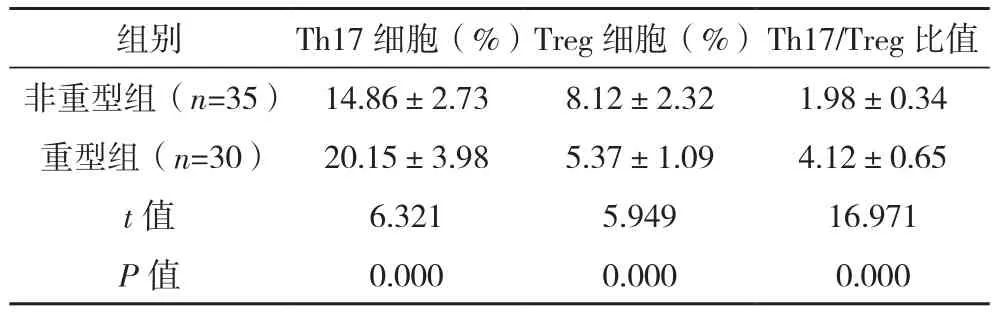
表1 重型组和非重型组外周血指标比较(±s)
组别 Th17细胞(%)Treg细胞(%)Th17/Treg比值非重型组(n=35) 14.86±2.73 8.12±2.32 1.98±0.34重型组(n=30) 20.15±3.98 5.37±1.09 4.12±0.65 t值 6.321 5.949 16.971 P值 0.000 0.000 0.000
2.2 重型组和非重型组炎症因子比较
重型组血清IL-4、IL-10水平均低于非重型组,IL-6、IL-17水平均高于非重型组(P<0.05),见表2。
表2 重型组和非重型组炎症因子比较[ng/L,(±s)]

表2 重型组和非重型组炎症因子比较[ng/L,(±s)]
组别 IL-4 IL-6 IL-10 IL-17非重型组(n=35) 26.84±5.69 91.25±12.47 149.75±35.84 1.98±0.76重型组(n=30) 3.18±0.73 121.46±25.83 74.61±16.92 6.74±3.05 t值 22.591 6.140 10.514 8.926 P值 0.000 0.000 0.000 0.000
2.3 外周血Th17/Treg比值与血小板计数、起效时间的关系
在65例免疫性血小板减少症患儿中,治疗前血小板计数平均为(15.87±2.16)×109/L,起效时间平均为(2.15±0.67)d。经Pearson相关性分析,外周血Th17/Treg比值与血小板计数呈负相关(r=-0.784,P=0.000),与起效时间呈正相关(r=0.691,P=0.000),散点图见图1。
2.4 缓解组与未缓解组外周血指标比较
所有患儿均完成治疗,在治疗3个月内缓解52例,纳入缓解组,未缓解13例,纳入未缓解组。治疗前1 d,缓解组外周血Th17细胞比例、Th17/Treg比值均低于未缓解组,Treg细胞比例高于未缓解组(P<0.05),见表 3。
表3 缓解组与未缓解组外周血指标比较(±s)
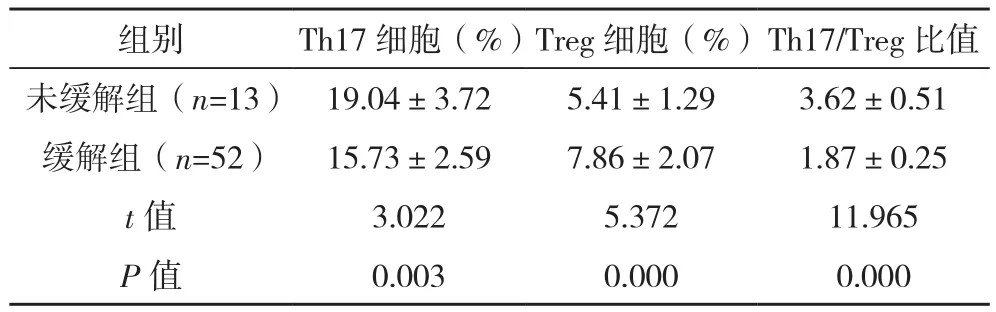
表3 缓解组与未缓解组外周血指标比较(±s)
组别 Th17细胞(%)Treg细胞(%)Th17/Treg比值未缓解组(n=13) 19.04±3.72 5.41±1.29 3.62±0.51缓解组(n=52) 15.73±2.59 7.86±2.07 1.87±0.25 t值 3.022 5.372 11.965 P值 0.003 0.000 0.000
3 讨论
儿童免疫性血小板减少症的病因复杂,发病机制仍在探索中,治疗手段缺乏针对性,因此准确评估病情严重程度并指导治疗方案的制定,就显得十分有必要。近年来,国内外研究显示,儿童免疫性血小板减少症可能与细胞免疫功能异常导致造血干细胞损伤有关[7-8]。Th17细胞可分泌致炎因子IL-6、IL-17,调控机体炎症反应,诱导自身免疫性疾病发生、发展,Treg细胞具有免疫抑制作用,通过分泌抗炎因子IL-4、IL-10,发挥免疫抑制功能,维持免疫平衡。从本研究结果可知,重型组血清IL-4、IL-10水平均低于非重型组,IL-6、IL-17水平均高于非重型组(P<0.05),初步揭示了重型免疫性血小板减少症患儿机体存在外周血Th17/Treg失衡,导致血清致炎因子IL-6、IL-17和抗炎因子IL-4、IL-10表达异常。Guo等[9]研究表明,重型免疫性血小板减少症患儿机体Th17细胞数量显著增多,且明显多于非重型患儿。也有研究表明,免疫性血小板减少症患儿病情处于活动期时外周血Treg细胞表达水平明显低于完全缓解期患儿[10]。由此推测,儿童免疫性血小板减少症的病情严重程度可能与Th17/Treg比例失衡引起的免疫调节功能紊乱有关。在本研究中,重型组外周血Th17细胞比例、Th17/Treg比值均高于非重型组,Treg细胞比例低于非重型组(P<0.05),与王明镜等[11]的研究结果相符,揭示了外周血Th17/Treg比值与儿童免疫性血小板减少症的病情演变有关,能在一定程度上用于判断患儿的病情严重程度。与此同时,本研究使用Pearson相关性分析,结果显示,免疫性血小板减少症患儿外周血Th17/Treg比值与血小板计数呈负相关(r=-0.784,P=0.000),亦进一步佐证了上述观点,提示外周血Th17/Treg比值与儿童免疫性血小板减少症严重程度存在关联。
尽管以激素与丙种球蛋白冲击治疗为主的一线治疗方案已广泛用于治疗儿童免疫性血小板减少症,但仍有高达20%的患儿病情进展至慢性或难治性阶段,若能提前准确评估预后,指导治疗,有望增加患儿的临床获益[12-13]。章大谦等[14]研究表明,激素结合免疫球蛋白冲击疗法能够纠正外周血Th17/Treg失衡,抑制炎症反应,进而达到治疗免疫性血小板减少症的目的。笔者认同上述观点,并推测外周血Th17/Treg失衡程度可能是评价免疫性血小板减少症患儿预后的理想指标。本研究通过Pearson相关性分析,结果显示,免疫性血小板减少症患儿外周血Th17/Treg比值与起效时间呈正相关(P<0.05),提示外周血Th17/Treg失衡与免疫性血小板减少症患儿的早期病理、生理过程有关,进而影响预后,具体作用有待深入研究予以明确。出现上述结果的原因,考虑在于免疫性血小板减少症患儿外周血Th17/Treg失衡程度越大,自身抗体对血小板的破坏越严重并拮抗血小板生成,进而影响治疗效果[15]。本研究中,所有患儿均完成治疗,在治疗3个月内缓解52例,纳入缓解组,未缓解13例,纳入未缓解组。治疗前1 d,缓解组外周血Th17细胞比例、Th17/Treg比值均低于未缓解组,Treg细胞比例高于未缓解组(P<0.05)。提示外周血Th17/Treg失衡可影响预后,有可能成为此病潜在的治疗靶点。基于本研究结果,认为在免疫性血小板减少症患儿的治疗过程中,有必要强调免疫治疗,通过抑制Th17增殖及其炎症因子的合成、释放,增强Treg细胞的分化活性,纠正外周血Th17/Treg失衡,达到控制病情,改善预后的目的。
综上所述,外周血Th17/Treg失衡与儿童免疫性血小板减少症严重程度存在关联,有助于评估预后,可能成为早期评估病情的理想指标。当然,本研究存在样本量不多、缺乏长期随访数据,未能分析外周血Th17/Treg失衡与患儿病情复发及远期预后的关系,有待日后扩大研究规模,深入分析Th17/Treg失衡在儿童免疫性血小板减少症发生、发展中的作用机制,将有助于研究结果的完善,为此病的诊治提供高级别证据支持,可能是未来该领域研究的热点。

