四川南充地区部分猪场呼吸道疫病主要病原调查与分析
王怀禹,刘强,何子双,龙冬梅,魏玲
(1.南充职业技术学院 四川南充 637131;2.阆中大北农农牧食品有限公司 四川南充 637400)
猪呼吸道疾病综合征(porcine respiratory disease complex,PRDC)是一种由多种病毒、细菌、支原体以及环境应激、不良的饲养管理和机体免疫力降低等诸多因素相互作用引起的猪只呼吸道疾病的总称。在规模化猪场养殖过程中,PRDC 病原主要分为两大类,即原发性病原与继发性病原,前者主要包括猪圆环病毒2 型(PCV2)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)等;后者主要包括副猪嗜血杆菌(HPS)、猪胸膜肺炎放线杆菌(APP)、猪肺炎支原体(MH)、猪链球、多杀性巴氏杆菌(Pm)、绿脓杆菌和猪附红细胞体(eperythrozoonsuis)等。PRDC 感染通常由多种病原混合感染引起,临床上常见感染途径为原发性病原先侵入猪只呼吸道和肺脏破坏呼吸道的防御屏障,引起免疫抑制,进而降低感染猪体呼吸道抵抗力,然后猪体内潜在病原或环境外源病原共同引起呼吸道疾病。据已报道的临床统计,PRRSV 和PCV2 混合感染最为常见,对猪场PRDC的发生起着不容忽视的影响。PRDC 一年四季均可传播流行,但在秋末、冬春较寒冷季节高发,感染率可达30%~80%,病死率约为10%~30%,主要感染6~10 周龄保育猪和13~20 周龄的育肥猪,且猪龄越小感染率和死亡率越高,不同时期的发病猪临床症状、发病特点有所不同。南充是畜牧大市,2020 年生猪出栏量位居四川省第一,为确保生猪产能恢复,为生猪产业健康发展保驾护航,做好猪疫病防控显得尤为重要,及时调查分析猪场重要疫病-呼吸道疫病综合征主要病原混合感染状况,能够为有效地防控PRDC 提供科学依据。本研究采集了2020—2021 年南充地区部分规模化猪场及散养户疑似PRDC 发病猪的肺、肾和淋巴结等组织病料236 份,了解南充地区规模化猪场及散养户猪只PRDC 主要病原混合感染状况,基于检测结果的分析为规模化猪场疫病有效防控提出解决方案。
1 材料
1.1 病料来源
本研究所用样品来自四川省南充地区9 个县市,主要采集具有咳嗽、呼吸困难和体温升高等疑似PRDC 症状的发病猪肺、肾和淋巴结等组织病料,2020 和2021 年检测样品分别为126 和110份,合计236 份。
1.2 主要试剂
细胞/组织基因组DNA 提取试剂盒(购自北京百泰克生物技术有限公司),RNAiso Plus Total RNA 提取试剂(购自上海生工生物工程股份有限公司),DNA Marker2000、TRIzol、2X Taq Master Mix、琼脂糖(购自大连宝生物工程有限公司);无水乙醇、异丙醇、DEPC、氯仿等(购自四川协力生物有限公司);麦康凯、TSA 及改良Friis 培养基等。
1.3 引物设计与合成
所用引物参考NCBI 相关病原基因组序列,利用Primer 6.0 设计软件选取保守序列设计各自特异性引物,由上海生工生物工程股份有限公司合成。
2 方法
2.1 调查法
对病料来源的猪场相关管理、技术人员进行问卷和座谈等形式的调查,调查内容主要涉及养猪场基本情况、存栏量、免疫情况、疫病流行特点,如临床症状与剖检病变、各生长阶段死淘情况及防治措施和效果等,切实了解疫病发生的情况。
2.2 实验室检测法
采集疑似PRDC 临床症状的典型发病猪现场剖检采样,无菌采集病猪肺脏、淋巴结、血液等病料组织样品进行实验室检测,本实验主要对PRRSV、PCV2、CSFV、PRV、HPS、MH、链球菌、产毒性巴氏杆菌共计8 种PRDC 常见病原进行了检测,各病原所有引物详见表1。
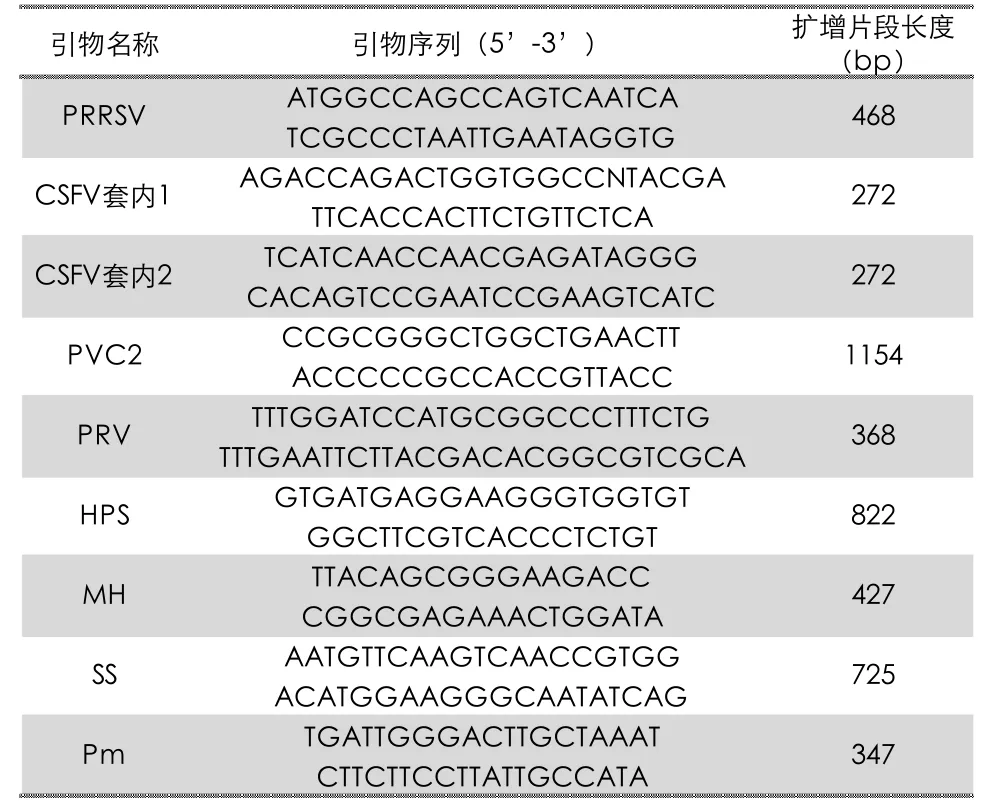
表1 PRDC 8种常见病原引物
2.2.1 病毒鉴定
1)DNA 和RNA 提取。待检测样品分别进行DNA 和RNA 提取。首先对病料进行研磨、离心等处理,再按照DNA 提取试剂盒说明书提取相关DNA,同时使用提取试剂完成RNA 的提取。RNA 提取方法如下:①在200μL 病料悬液中加入1,000μL TRIzol 细胞裂解液,4℃静置10min 后,12,000r/min 离心10min;②取上清并在其中加入约1/2 体积的氯仿,4℃静置10min,12,000r/min 离心10min;③取上清加入等体积异丙醇,4℃静置10min,12,000r/min 离心10min;④去上清后,在离心管中加入75%乙醇1,000μL,反复冲洗沉淀,12,000r/min 离心5min。室温静置10min 后,溶于20μL DEPC 水中进行反转录。
2)DNA PCR 扩增。将所提取DNA 分别利用特异性引物进行PCR扩增,PCR反应体系为:2X Taq Master Mix 10μL,DNA 0.5μL,上下游引物各0.5μL,补灭菌HO 至总体积20μL。PCR 反应条件为:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸30s,30 个循环,最后72℃延伸10min,4℃保存。取10μL PCR扩增产物经1.5%琼脂糖凝胶进行电泳后,在凝胶成像仪上观察结果并记录。
3)RNA RT-PCR。检测CSFV 和PRRSV 分别采用套氏PCR 和普通RT-PCR。CSFV 套式PCR 扩增第1 轮一步法扩增反应体系为:2× 1 Step Buffer 20μL,Prime Script TM One Step Enzyme Mix 1.5μL,外套上下游引物各1μL,RNA模板1.5μL,用RNase-free Water 补至总体积50μ L;第1 轮扩增条件为:50℃反转录30min,94℃预变性5min;95℃变性15s,54℃退火30s,72℃延伸30s,35 个循环;最后72℃延伸10min;4℃保存;第2 轮扩增反应体系为:Premix Taq Enzyme 25μL,内套上下游引物各1μL,第1轮PCR产物300倍稀释后为模板1.5μL,用RNase-free Water 补反应体积至50μL。第2 轮扩增条件为:94℃5min;95℃15s,54℃30s,72℃30s,35 个循环;最后72℃延伸10min;4℃保存。普通RT-PCR 扩增程序为:94℃5min;94℃30s,59℃45s,72℃30s,30 个循环;最后72℃延伸10min。取10μL 第2 轮PCR 产物于1.5%琼脂糖凝胶电泳后,凝胶成像系统上照相观察并记录结果。
2.2.2 细菌的分离鉴定将病料组织分别接种到麦康凯、含5%牛血清的TSA 培养基和含5%牛血清、0.01%NAD 的特殊培养基中进行细菌分离培养,37℃培养过夜。选取典型疑似病原菌的菌落进行革兰氏染色镜检、扩菌、生化试验及PCR 鉴定。细菌培养特性、菌落形态及生化鉴定详见表2。

表2 分离菌培养特性
2.2.3 支原体的分离鉴定将采集的肺组织等病料,加入改良Friis 液体培养基进行无菌研磨制成肺组织乳剂,静置后,取上清液接种于含50%猪鼻支原体特异性血清的改良Friis 液体培养基中,37℃培养4~10d,每天记录pH 值变化,且每隔5d 盲传1 次。取0.2mL 液体培养物接种于改良Friis 固体培养基表面,37℃、5%CO条件下培养,观察是否有支原体样菌落。将疑似支原体菌落接种于改良Friis 液体培养基中,37℃培养,每日观察颜色变化及pH值变化。变黄后进行PCR 鉴定。
3 结果与分析
3.1 调查结果与分析
本实验采集病料来自南充地区9 个县市如嘉陵区、阆中市、南部县、仪陇县、西充县、蓬安县、营山县等12 个规模化养殖场和8个散养户。规模化养殖场均采用水泡粪饲养模式,存栏均在1 万头以上,散养户存栏均在1,000 头以上。20 个猪场疑似PRDC 死淘猪主要集中在30~110 日龄,临床主要表现为发热、气喘、呼吸困难、消瘦、咳嗽、背毛粗乱、眼鼻分泌物增多,有的后肢关节肿胀等。病猪剖检发现病变均集中在肺部。
3.2 实验室检测结果与分析
通过对236 份病料进行PCR 检测,结果显示,236 份病料样品中,236 份均为阳性,检出率为100%。其中有189 份检出PCV2,阳性率为80.1%,151 份检出PRRSV,3 份检出CSFV,34份检出PRV,35 份检测出链球菌,22 份检测出产毒性巴氏杆菌,11 份检测出猪肺炎支原体,14 份检测出副猪嗜血杆菌,详见表3。对阳性组织样品进行病原学分析时,所有病料既有单一病原感染,也有混合感染,且混合感染非常普遍,236 份阳性样品中有207 份为混合感染,占所有阳性样品的87.7%,而且混合感染类型相当复杂,病原分析发现二重感染较为普遍,PCV2 和PRRSV 混合感染率最高为47.5%,其次为PCV2+PRV 感染率为14.4%,有一部分病料为三重甚至四重混合感染情况,三重感染中以PCV2+PRRSV+SS 感染率最高约4.7%,四重混合感染率为0.4%,未发现五重感染(详见表4)。

表3 病原鉴定结果
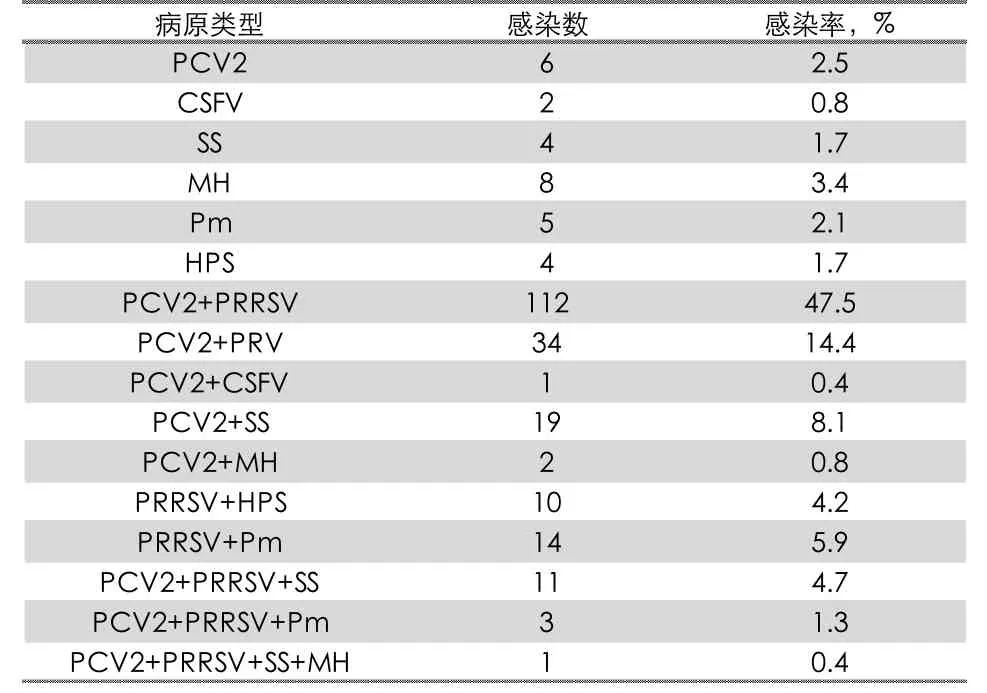
表4 混合感染情况
4 小结与防控
PRDC 在世界各地普遍存在,在养猪生产实际中,该病往往由一种或多种病原体感染所致。近年来我国PRDC 持续感染,危害日渐明显和严重,特别是现代化规模化猪场养殖模式下,病原日益复杂,多重感染或混合感染是当前常见的发病规律,常见以病毒性、细菌性、病毒与细菌混合等多种感染形式出现。研究发现潜在的原发性病原主要为病毒类;继发性感染是导致病猪大量死亡的主要原因。根据临床分析,PRRSV 和PCV2 是最常见的混合感染,对PRDC 发生有着非常重要的影响。
本次研究采集了236 份南充地区部分猪场病料,主要检测了8 种常见的PRDC 病原:PRRSV、CSFV、PCV2、PRV、SS、HPS、Pm、MH。结果显示,虽然各猪场存在的主要呼吸道疾病不同,在毒株、菌株种类及感染情况等方面存在差异,但各猪场普遍存在PCV2和PRRSV 的混合感染和继发感染,这提示在四川南充地区猪群中普遍存在PRDC,且引起的病原也非常复杂,PRRSV 是造成当地猪场保育和育肥阶段猪群呼吸道疾病的重要因素之一,日常关注环境控制和病原混合或继发感染、控制猪群死淘率是各猪场应重视的问题。在多种病原混合感染过程中,病原间具体的作用机制有待进一步研究。
分析PRDC 在我国普遍流行的原因,有以下几种:对于保育阶段的猪群而言,此阶段猪只自身免疫系统、消化和呼吸系统功能尚不健全,且体内母源抗体逐渐降低,加之断奶、混群等应激因素,导致该阶段猪群感染率发病率高。育肥阶段的猪群饲养密度过大、通风不良、营养缺乏和免疫机能降低等是导致猪群呼吸道疾病暴发的主要原因。
防控PRDC 的有效方法是科学免疫结合药物防治,各猪场应结合实际情况进行有针对性防治。PRDC 完整的防治计划应从以下几个方面着手:猪场要采取严格的生物安全措施,制定合理的免疫接种程序,加强各类疫病的控制和监测,强化猪场日常管理,详细记录猪群生长情况、产量记录等信息,对于重点猪群如保育猪、育肥猪等应尽可能避免各类应激反应,合理控制猪舍饲养密度,坚持营养全面、科学搭配的喂养原则,给予全价的优质饲料,确保饲料中蛋白质、氨基酸和微量元素等营养物质的供应,确保保育舍的保温和通风等。日常饲养过程中,严格执行清洁卫生制度和消杀制度,对于潜在的病原携带者如外来人员或车辆、物品等进行风险管控,防止外界病原体的传入而引发感染。对于一些常见细菌,极易产生耐药性,因此对于细菌类疾病养猪场应根据药敏试验结果选用高效抗菌药物,并能够联合用药或交替使用异种抗菌类药物,但要注意药物间配伍禁忌。
随着养殖技术的不断提升和现代集约化养殖模式的扩大,各类猪病本身也发生着新的变化,不仅表现在抗原表位的突变,混合感染的复杂化、耐药机制的多元化等,多种病原的相互作用,使得机体多系统并发症日益严重,疫病防控越来越难。呼吸系统作为动物机体的对外口户,更是众多病原的突破口,因此是预防疾病的重中之重。在当前猪病严峻形势下,有必要加强对猪群的疫病监测和疫苗免疫。

