lncRNA OIP5-AS1 通过海绵吸附miR-143-3p调控COL1A1 促进胃癌发展
刘 锐 褚伟伟 余明军 王海明
胃癌是世界上最常见的恶性肿瘤之一,发病率和死亡率都很高,尤其在东亚国家如中国、日本、韩国等。胃癌的发生是一个多阶段、多因素、多因子的病理过程,由基因的表达突变和表观遗传改变所致[1]。长链非编码RNA(long non-coding RNA,lncRNA)是癌症生物学的关键调控因子,可以在多个层面调控癌症相关基因表达水平,参与胃癌的发生发展[2],但确切机制尚不清楚。lncRNA Opa 相互作用蛋白5 反义RNA 1(Opa-interacting protein 5 antisense RNA 1,OIP5-AS1)是位于人类OIP5 基因反义链上的lncRNA,通过不同的途径促进癌症的发生发展[3]。相关研究表明,lncRNA OIP5-AS1 与miR-143-3p 在肿瘤发展中起到重要作用[4-8]。然而,其在胃癌中的具体作用和机制尚未阐明。因此,本研究将探讨lncRNA OIP5-AS1 通过靶向调控miR-143-3p 对胃癌细胞发展的影响。
1 实验材料
1.1 细 胞 胃癌细胞AGS(目录号TCHu232)购自中国科学院细胞库,SGC7901(目录号CL-0206)、MKN-45(目录号CL-0292)、BGC823(目录号CL-0033)及人正常胃细胞GES-1(目录号CL-0563)均购自武汉普诺赛生命科技有限公司。
1.2 试 剂 DMEM 培养基(批号10566016)和胎牛血清(批号10100147)均购自美国Gibco 公司;荧光素酶报告载体OIP5-AS1-WT、OIP5-AS1-MUT、Ⅰ型胶原α1(COL1A1)-WT、COL1A1-MUT 及相应的对照质粒购自上海吉玛生物制药有限公司;双荧光素酶报告基因试剂盒(批号E1910)购自美国Promega 公司;Lipofectamine2000(批号11668500)购自美国Invitrogen 公司;qRT-PCR 试剂盒购自(批号RR42LR)日本TaKaRa 公司;Anti-COL1A1(批号72026S)及山羊抗兔二抗(批号7074S)均购自美国CST 公司;Transwell 小室(批号3422)购自美国Corning 公司。
1.3 主要仪器 General Use Only 离心机,美国Thermo;FormaTMSteri-CycleTMCO2Incubator 培 养箱,美国Thermo;Multiskan FC 酶标仪,美国Thermo;LightCycler 96 荧光定量PCR 仪,德国罗氏;TiS 荧光倒置显微镜,日本尼康;E1960 双萤光素酶报告基因检测系统,美国Promega 公司。
2 实验方法
2.1 细胞培养与转染 将人正常胃细胞GES-1 和胃癌细胞AGS、SGC7901 置于含有10%胎牛血清、100 U/mL 青霉素和100 U/mL 链霉素的DMEM 培养基中,在5% CO2、37 ℃培养箱中培养,细胞生长至85%时,加入胰酶消化传代培养。将对数生长期的胃癌细胞稀释,然后按照Lipofectamine 2000 试剂盒说明书进行转染。转染细胞分组为阴性对照(si-NC)、si-lncRNA OIP5-AST(si-OIP5-AS1)、NC mimic、miR-143-3p mimic、si-OIP5-AS1+inhibitor NC、si-OIP5-AS1+miR-143-3p inhibitor 和si-OIP5-AS1+miR-143-3p mimic+si-COL1A1。
2.2 Western blot 检测 COL1A1 蛋白表达RIPA 裂解液提取三组细胞总蛋白,BCA 法测定蛋白浓度。取40 μg 蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。采用常规湿转法转膜,于5%的脱脂牛奶(TBST 溶解)室温下封闭1 h。将膜置于稀释的一抗溶液(1∶2000)室温孵育2 h,PBST 洗膜每隔5 min 洗1 次,洗6 次;再将膜置于稀释的二抗溶液中室温孵育1.5 h(1∶5000),PBST 洗膜5 min,洗6次,化学发光显色剂显色。甘油醛-3-磷酸脱氢酶(GAPDH)蛋白为内参。
2.3 qRT-PCR 检测miR-143-3p 和OIP5-AS1 的表达 TRIzol 法提取细胞总RNA,反转录为cDNA 进行qRT-PCR 检测。检测lncRNA OIP5-AS1 以βactin 为内参,miR-143-3p 以U6 为内参,使用2-ΔΔCt法计算miR-143-3p 和lncRNA OIP5-AS1 的相对表达水平。反应参数:95 ℃5 min,96 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,35 个循环。所用引物序列(由上海生工生物合成)如下:miR-143-3p 的反转录引物为5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGAGCTA-3'。miR-143-3p 上游引物为5'-CGCGTGAGATGAAGCACTG-3',下游引物为5'-AGTGCAGGGTCCGAGGTATT-3'。U6上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-ACGCT-TCACGAATTTGCGT-3'。OIP5-AS1上游引物为5'-CAGACCTGGCACAATGGCTCAC'-3',下游引物为5'-GTGGGCTCAAACTGGGCTCAAG-3'。β-actin 上游引物为5'-TGTCAC-CAACTGGGACGATA-3',下游引物为5'-GGGGTGTT-GAAGGTCTCAAA-3'。
2.4 CCK-8 检测细胞增殖 采用CCK-8 检测试剂盒在96 孔板中测定细胞活力并设置3 个复孔。每孔加入10 μL CCK-8 试剂,在37 ℃黑暗培养箱中连续孵育3 h。使用酶标仪检测在450 nm 处测定吸光度。
2.5 伤口愈合实验检测细胞迁移 将细胞铺到12孔板中,培养达到约100%的融合度。用10 μL 的移液枪枪头在孔底造成划痕,使用预冷的PBS 除去未附壁的细胞至无细胞脱落。将细胞放入不含血清的DMEM 中培养24 h。显微镜下观察细胞迁移距离。
2.6 Transwell 实验检测细胞侵袭 各组细胞用胰酶消化处理后,接种于Transwell 小室24 孔板内,上室加入100 μL 细胞悬液,下室加250 μL 含10%胎牛血清的培养基,在37℃、5% CO2培养箱中培养48h,PBS 冲洗2 次至无细胞碎片,4%多聚甲醛固定细胞15 min,0.1%结晶紫染色15 min 后PBS 冲洗染色液,干燥后显微镜下观察细胞染色情况。
2.7 双荧光素酶报告实验 将构建的OIP5-AS1 野生型载体OIP5-AS1-WT/突变型载体OIP5-AS1-MUT 以及COL1A1 野生型载体COL1A1-WT/突变型载体COL1A1-MUT 分别与NC mimic 或miR-143-3p mimic 共转染,转染成功后继续培养48 h,按双荧光素酶试剂盒操作说明检测荧光素酶活性。
2.8 统计学方法 应用Graph Pad Prism 7.0 统计软件进行数据处理,计量资料符合正态分布,以均数±标准差()表示,多组间比较用单因素方差分析,组间两两比较用LSD 检验,P<0.05 为差异有统计学意义。
3 结果
3.1 lncRNA OIP5-AS1 在胃癌细胞系表达水平升高 qRT-PCR 测定结果显示,lncRNA OIP5-AS1 在胃癌细胞AGS、SGC7901、BGC823、MKN-45 中表达水平分别是GES-1 细胞的6.10、5.53、3.90 和3.03倍,差异有统计学意义(P<0.01)。选择表达水平较高的AGS 和SGC7901 细胞进行下一步研究。
3.2 敲低lncRNA OIP5-AS1 抑制胃癌细胞增殖、迁移和侵袭 应用siRNA 敲低lncRNA OIP5-AS1 的表达,并通过qRT-PCR 验证AGS、SGC7901 细胞在转染si-OIP5-AS1 后,lncRNA OIP5-AS1 表达水平分别降低至原来的0.25 和0.34 倍(P<0.05)。通过CCK-8 分析lncRNA OIP5-AS1 对胃癌细胞增殖的影响,结果显示,与si-NC 相比,si-OIP5-AS1 转染的AGS 和SGC7901 增殖明显减少[AGS:(0.71±0.07)比(1.20±0.11);SGC7901:(1.02±0.10)比(1.80±0.10),P均<0.05]。此外,分别通过伤口愈合实验和Transwell测定lncRNA OIP5-AS1 对胃癌细胞迁移(见图1)和侵袭(见图2)的影响,结果表明,AGS 和SGC7901 的迁移[AGS:(29.01±3.68)%比(72.04±6.82)%;SGC7901:(23.97±2.24)%比(62.02±3.73)%,P 均<0.01]和侵袭能力[AGS:(35.68±6.96)个比(278.33±11.85)个;SGC7901:(62.74±12.77)个 比(248.65±12.03)个,P均<0.01]因lncRNA OIP5-AS1 的敲低而显著减弱。
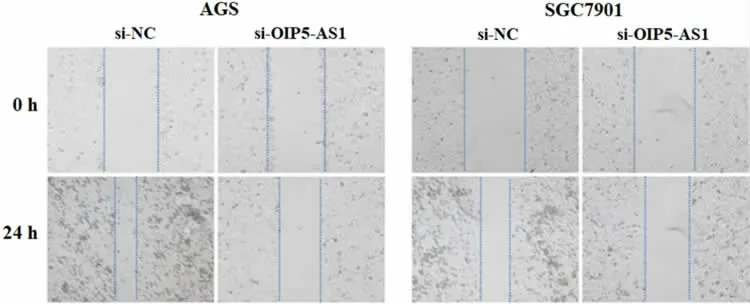
图1 伤口愈合实验检测si-OIP5-AS1 对胃癌细胞迁移的影响
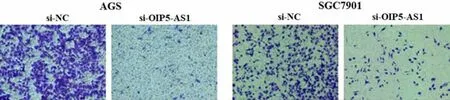
图2 Transwell 实验检测si-OIP5-AS1 对胃癌细胞侵袭的影响
3.3 miR-143-3p 在胃癌细胞系表达水平显著降低,COL1A1 表达水平升高 qRT-PCR 结果显示,AGS和SGC7901 中miR-143-3p 表达水平分别是GES-1的0.56 和0.49 倍,差异有统计学意义(P<0.01)。Western blot 结果显示,COL1A1 在胃癌细胞系中的蛋白表达水平显著高于GES-1 细胞(P<0.01),见图3。
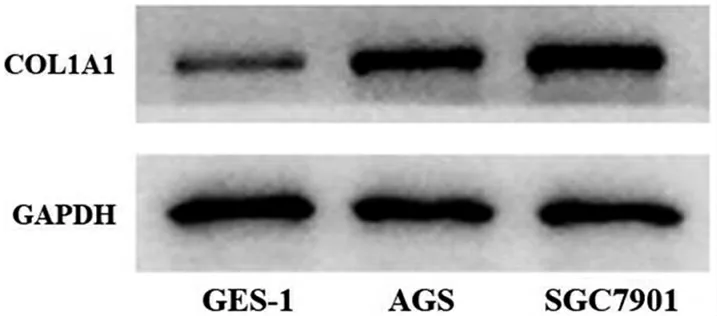
图3 Western blot 检测COL1A1 在胃癌细胞和正常胃细胞中的表达水平
3.4 lncRNA OIP5-AS1 通过吸附miR-143-3p 调控COL1A1 的表达 通过starBase 预测发现lncRNA OIP5-AS1 与miR-143-3p,miR-143-3p 与COL1A1具有结合位点(见图4)。同时,miR-143-3p mimic 显著降低OIP5-AS1-WT 和COL1A1-WT 的荧光素酶活性(P<0.01)(见表1)。qRT-PCR 结果显示,敲低lncRNA OIP5-AS1 后,AGS 和SGC7901 细胞miR-143-3p 表达水平升高,分别为对照组的2.60 和2.13倍,差异有统计学意义(P<0.01),而Western blot 结果显示,相比于si-NC 组COL1A1 表达水平显著降低(P<0.01);此外,敲低lncRNA OIP5-AS1 对COL1A1 表达的抑制作用能够被miR-143-3p inhibitor 所逆转(P<0.01),见图5。

图4 starBase 预测lncRNA OIP5-AS1、miR-143-3p、COL1A1的靶向结合位点
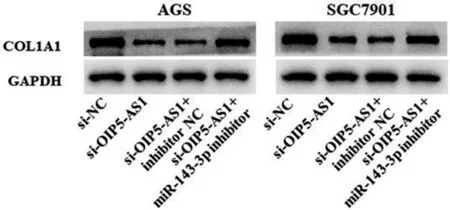
图5 Western blot 检测不同处理组胃癌细胞COL1A1 表达
表1 双荧光素酶报告实验分析胃癌细胞lncRNA OIP5-AS1 与miR-143-3p、miR-143-3p 与COL1A1 间的相互关系()
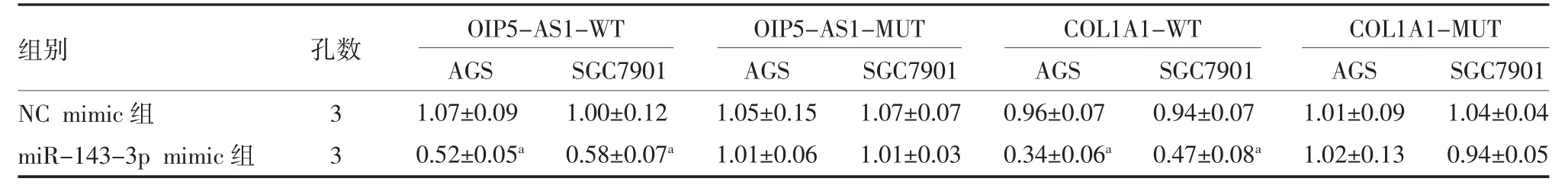
表1 双荧光素酶报告实验分析胃癌细胞lncRNA OIP5-AS1 与miR-143-3p、miR-143-3p 与COL1A1 间的相互关系()
注:NC mimic 组为每孔胃癌细胞加入100 nmol 的NC mimic 及5 μL 转染试剂;miR-143-3p mimic 组为每孔胃癌细胞加入100 nmol 的miR-143-3p mimic 及5 μL 转染试剂;OIP5-AS1 为Opa 相互作用蛋白5 反义RNA1;COL1A1 为Ⅰ型胶原α1;与NC mimic 组比较,aP<0.01
3.5 lncRNA OIP5-AS1 通过调控miR-143-3p/COL1A1 影响胃癌细胞增殖、迁移和侵袭 挽救实验表明,si-OIP5-AS1 对胃癌细胞增殖、迁移和侵袭的抑制作用,能够被miR-143-3p inhibitor 恢复;在此基础上,敲低COL1A1 能够抑制胃癌细胞增殖、迁移和侵袭能力,见表2,图6-7。

图6 伤口愈合实验检测各处理组胃癌细胞的迁移
表2 各处理组胃癌细胞的增殖、迁移和侵袭()
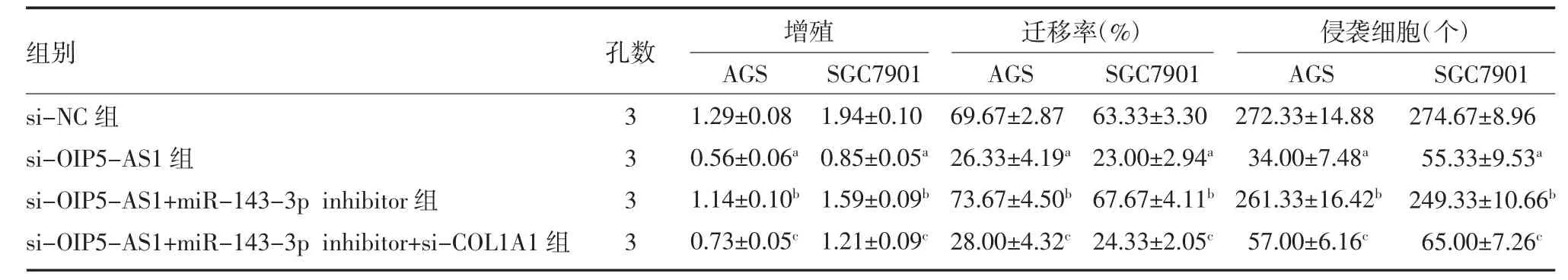
表2 各处理组胃癌细胞的增殖、迁移和侵袭()
注:si-NC 组为每孔胃癌细胞加入100 pmol 的si-NC 及5 μL 转染试剂;si-OIP5-AS1 组为每孔胃癌细胞加入100 pmol 的si-OIP5-AS1 及5 μL转染试剂;si-OIP5-AS1+miR-143-3p inhibitor 组为每孔胃癌细胞加入100 pmol 的si-OIP5-AS1、100 nmol 的miR-143-3p inhibitor 和5 μL 转染试剂;si-OIP5-AS1+miR-143-3p inhibitor+si-COL1A1 组为每孔胃癌细胞加入100 pmol 的si-OIP5-AS1、100 nmol 的miR-143-3p inhibitor、100 nmol 的si-COL1A1 和5 μL 转染试剂;OIP5-AS1 为Opa 相互作用蛋白5 反义RNA1;COL1A1 为Ⅰ型胶原α1;与si-NC 组比较,aP<0.01;与si-OIP5-AS1 组比较,bP<0.01;与si-OIP5-AS1+miR-143-3p inhibitor 组比较,cP<0.01
4 讨论
由于早期胃癌缺乏特异性症状,大多数胃癌患者确诊时已为中晚期,预后差。目前被证实的胃癌高危因素包括幽门螺杆菌感染、过量摄入盐和硝酸盐、肥胖等,此外,异常的分子信号通路也参与了胃癌的发生和转移[9]。lncRNA 的失调参与了癌症中的细胞增殖、肿瘤进展和转移,同时,lncRNA 作为miRNA的分子海绵,阻断靶转录本的结合活性[10]。已有多种lncRNA 被鉴定为致癌或抑癌因子,如XIST、GAS5、HOTAIR 和MALAT1[11]。lncRNA 已被证明参与了不同癌症类型,据报道lncRNA OIP5-AS1 通过靶向调控miR-378a-3p 促进肺癌细胞的增殖,而敲低lncRNA 表达会抑制肺癌细胞的增殖[12]。Yang 等[13]也发现,lncRNA OIP5-AS1 通过调控miR-410 的表达调控其靶基因KLF10,从而促进多发性骨髓瘤细胞增殖、周期进展和抑制凋亡,影响下游信号通路。本研究也发现,lncRNA OIP5-AS1 在胃癌细胞系中表达水平显著升高。
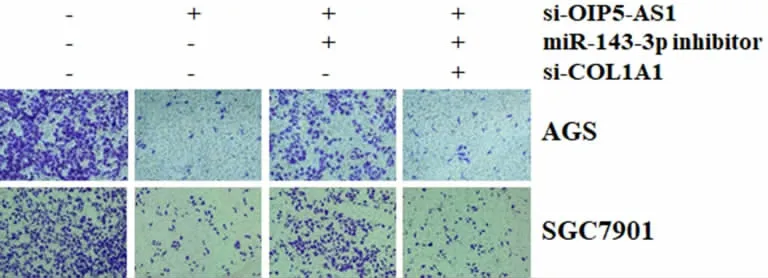
图7 Transwell 实验检测各处理组胃癌细胞AGS 和SGC7901 的侵袭
多项研究表明,miR-143 在人类癌症中表达下调,其中miR-143-3p 发挥肿瘤抑制因子的关键作用,通过靶向癌基因参与人类癌症的发病过程,靶向HK2 在食管鳞状细胞癌中发挥作用[14]。miR-143-3p表达下调与卵巢癌的进展有关[15]。这说明miR-143-3p 的表达与肿瘤的发生发展有直接的关系。本研究结果显示,miR-143-3p 抑制胃癌细胞的增殖、迁移和侵袭。
COL1A1 基因编码Ⅰ型胶原的α1 链,是主要的细胞外基质成分,已在多种类型的癌症中被证实。据报道COL1A1 在胃癌中表达上调,并影响胃癌细胞侵袭转移[16]。本研究结果显示,COL1A1 在胃癌细胞中表达上调,促进胃癌细胞的增殖、迁移和侵袭。
本研究中,生物信息预测miR-143-3p 的上下游靶标分子,发现miR-143-3p 能够靶向作用于lncRNA OIP5-AS1,以及下游COL1A1 mRNA 的3’-UTR,双荧光素酶报告实验以及挽救实验进一步证实了lncRNA OIP5-AS1 通过海绵吸附miR-143-3p 上调COL1A1 促进胃癌细胞增殖、迁移和侵袭进,影响胃癌细胞的发展。

