人G6PD在大肠埃希菌中的表达及体外抑制剂筛选模型的建立
金科华,游云悠,魏友煜,左 越,柯志强,尧 青,刘 洁
作者单位:湖北科技学院1糖尿病与血管病变湖北省重点实验室、2医学部基础医学院、3医学部基础医学院2018级卓越医师班、4医学部健康医学院,咸宁 437100
多数肿瘤细胞有两大代谢特征,一是通过从头合成途径合成[1]核苷酸;二是脂肪酸合成旺盛。磷酸戊糖途径(pentose phosphate pathway,PPP)的中间产物5-磷酸核糖和NADPH分别是核苷酸和脂肪酸合成的必须原料。抑制PPP可抑制肿瘤细胞DNA合成和脂肪酸合成,抑制肿瘤细胞的增殖。6-磷酸葡萄糖脱氢酶(glucose 6-phosphate dehydrogenase,G6PD)是PPP的限速酶,催化6-磷酸葡萄糖(glucose 6-phosphate,G6P)和NADP+转化为6-磷酸葡萄糖酸内酯和NADPH(在340 nm波长处有特征吸收值)。高活性的G6PD与肿瘤发展和不良预后密切相关[2-3],G6PD缺失与肿瘤的生长呈负相关[4-5]。6-氨基烟酰胺通过抑制G6PD,诱导肿瘤细胞产生氧化性胁迫,提高肿瘤对抗癌药物和放疗的敏感性[6-8]。脱氢表雄酮(dehydroepiandrosterone,DHEA)通过抑制G6PD能有效抑制肿瘤增殖[9]。然而,DHEA治疗非小细胞肺癌时,易导致患者产生严重的抑郁和疲倦[10],6-氨基烟酰胺有神经毒性[11],限制了它们在临床上的应用,故发现更多靶向G6PD的抑制剂具有重要意义。为此,拟在原核生物中表达人G6PD,并建立其体外抑制剂筛选模型,为发现G6PD抑制剂奠定基础。
1 材料与方法
1.1 主要材料大肠杆菌BL21(DE3)、质粒pET-28a为湖北科技学院基础医学院保存。G6PD cDNA(与Genebank中NM_001360016.2的G6PD序列一致)由厦门大学生命科学学院提供。DNA聚合酶、DNA连接试剂盒购自TaKaRa(大连)公司。大肠杆菌Top10感受态细胞购自北京全式金生物技术有限公司。引物、质粒抽提试剂盒、卡那霉素(Kana)、凝胶回收试剂盒、G6P、NADP购自上海生工生物工程有限公司。快速限制酶购自美国Fermentas公司,镍离子亲和层析柱购自美国GE公司。DHEA购自美国Sigma公司。兔抗人G6PD IgG单克隆抗体(一抗)购自杭州Epitomics公司,HRP标记的羊抗兔IgG抗体(简称二抗)购自北京中杉金桥公司。
1.2 主要仪器Eppendorf 5425 R微量离心机(美国eppendorf公司);HERMLE Labortechnik GmbH Z 32 HK离心机(德国HERMLE公司);TS-1000 PCR仪、蛋白质电泳及转印系统(美国Bio-Rad公司);DYY-6C电泳仪电源、DYCP-31DN型琼脂糖水平电泳仪(北京六一生物科技有限公司);JY92II DN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.3 PCR扩增G6PD cDNA根据G6PD cDNA序列,设计上游引物P1:5′-CGACATATGATGGCAGA-GCAGGTGGCCCTG-3′,下游引物P2:5′-ACGCTCG-AGTCAGAGCTTGTGGGGGTTCAC-3′。下划线序列分别为NdeⅠ、XhoⅠ位点。PCR反应体系:H2O 40.5 μl,10× Pyrobest Buffer 5 μl,dNTP Mixture(2.5 mmol/L each)2 μl,P1(10 μmol/L)、P2(10 μmol/L)各1 μl,G6PD cDNA 0.25 μl(90 ng), Pyrobest DNA polymerase 0.25 μl。PCR循环条件:95 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃修复延伸10 min。将PCR产物进行电泳检测,并按DNA凝胶回收试剂盒回收。
1.4 G6PD cDNA和pET-28a的酶切与回收G6PD cDNA酶切反应:H2O 16 μl,cDNA 25 μl,10× FD Buffer 5 μl,NdeⅠ和XhoⅠ 各2 μl,37 ℃保温3 h。质粒酶切反应:H2O 42 μl,pET-28a 8 μl(800 ng),10× Buffer 6 μl,NdeⅠ和XhoⅠ 各2 μl,37 ℃保温3 h。酶切的cDNA和质粒按凝胶回收试剂盒回收。
1.5 目的基因与载体的连接及转化取1.4酶切的pET-28a 和G6PD 各2.5 μl、DNA连接试剂盒之Solution I 5 μl,混匀,16 ℃连接3 h。将100 μl Top10感受态细胞冰浴解冻,将5 μl连接产物加入感受态细胞,轻吸混匀,按冰浴30 min、-42 ℃ 60 s、-冰浴2 min的程序转化,向转化后的菌液中,加入500 μl LB培养基,200 r/min 37 ℃活化菌体1 h。取100 μl菌液,涂布于含50 μg/ml Kana的LB平板(抗性平板),筛选重组子。
1.6 重组质粒的酶切和测序鉴定取1.5筛选的单菌落两个,分别接种于两支4 ml 抗性(50 μg/ml Kana)LB,37 ℃ 、220 r/min培养10 h。取菌液1 ml,按质粒抽提试剂盒提取质粒,记为pG1、pG2。质粒双酶切鉴定:pG1(或pG2,或pET-28a)8 μl,NdeⅠ、XhoⅠ各1 μl,10× FD Buffer 2 μl,H2O 8 μl,37 ℃酶切2 h。将酶切产物于1%的琼脂糖进行电泳鉴定。委托广州英潍捷基公司对酶切阳性的质粒测序。
1.7 IPTG诱导表达G6PD取pG1 10 ng,按1.5的方法转化BL21(DE3)感受态细胞,筛选单菌落。取抗性菌落1个,记为BL21-pG1,接种于4 ml抗性LB,37 ℃ 、250 r/min培养10 h,作母液。将母液按1 ∶100平行接种2份于100 ml抗性LB中,37 ℃、250 r/min培养至A600为0.6。诱导组加入IPTG至终浓度0.4 mmol/L,对照组加等体积的无菌水。两份菌液于37 ℃、 250 r/min培养5 h。10 000 r/min室温离心1 min(下称离心),去上清液,沉淀用PBS洗涤两次。离心,去PBS上清液,沉淀用30 ml、100 mmol/L 、pH7.5 Tris-HCl重悬。按225 W功率、超声2 s 、停4 s的程序,冰浴超声重悬的沉淀30 min。以4 ℃、13 000 r/min离心超声处理菌体10 min。取上清液600 μl,与200 μl 4× Loading Buffer混匀,100 ℃变性10 min,取20 μl变性蛋白进行SDS-PAGE检测。
1.8 G6PD的纯化取镍离子层析珠0.5 ml,弃去保存液,用超纯水洗涤2次。在4 ℃冰箱中,将层析珠与裂解液上清液混合30 min,流出未结合的蛋白。依次用含20、40、80 mmol/ L咪唑的100 mmol/ L 、pH7.5 Tris-HCl洗涤层析珠。加25 ml洗脱液(含200 mmol/L咪唑的100 mmol/L 、pH7.5 Tris-HCl)洗脱G6PD。取600 μl洗脱液,200 μl 4× Loading Buffer,混匀,100 ℃加热变性10 min, 13 000 r/min室温离心2 min,取上清液。按Millipore超滤管(截留分子量10 ku)说明书,将洗脱液超滤浓缩至约500 μl。用BCA法测定浓缩蛋白浓度。取450 μl浓缩蛋白与50 μl甘油混匀,分装后-80 ℃保存。
1.9 Western blot检测G6PD取1.6和1.7的变性蛋白样品各10 μl,于10%的分离胶进行SDS-PAGE。将分离的蛋白湿法恒压120 V×1 h电转至PVDF膜。将PVDF膜浸于5 % BSA中,室温处理1 h,将1 ∶1 000稀释的G6PD一抗与PVDF膜4 ℃孵育过夜。取出PVDF膜,用TBST洗涤3次×10 min。加入1 ∶5 000稀释的二抗,室温孵育1 h,TBST洗涤3次×10 min。用ECL覆盖PVDF膜,于Bio-Rad 公司的ChemiDoc XRS+成像中系统检测条带信号。
1.10 G6PD抑制剂体外筛选模型的建立确定G6PD最佳浓度。按文献[8]配制G6PD反应缓冲液(G6PD buffer, GB)。用GB配置4 mmol/L G6P和2 mmol/L NADP,将适量的G6P和NADP等体积混匀,作为底物混合液,4 ℃避光待用。冰浴解冻-80 ℃保存的G6PD。向96孔板中的加入底物混合液190 μl,置Varioskan Flash微孔板度数仪(赛默飞世尔,美国),37 ℃预热10 min。每孔分别加入10 μl不稀释、稀释5倍、稀释25倍的G6PD(终浓度依次为22.5、4.5、0.9 μg/ml)或10 μl GB,混匀,每30 s测定一次A340,测定6 min,绘制Time-A340曲线,确定最佳G6PD浓度。
确定阳性对照DHEA的最佳浓度。向96孔板中加入:底物混合液180 μl,浓度分别为200、40、8 μmol/L的DHEA溶液(终浓度分别为10、2、0.4 μmol/L)或DMSO各10 μl,最适浓度G6PD 10 μl。按上述程序测定A340,绘制Time-A340曲线。按文献[12]计算模型的可靠性因子—Z′因子,确定最佳DHEA浓度。以上实验均为三次生物学重复。
1.11 统计学处理用EXCEL 2013计算重复测定的数据的平均值、标准差。
2 结果
2.1 pET-28a-G6PD的构建PCR产物分子量介于1 400 ~1 600 bp,与G6PD cDNA分子量(1 569 bp)一致(图1A),对照组无扩增产物。双酶切的pG1、pG2均产生两条带,小带分子量介于1 000~2 000 bp,与G6PD cDNA分子量相符;大带分子量与pET-28a(5 369 bp)酶切片段相符(图1B)。测序结果与G6PD cDNA序列一致。可见G6PD cDNA正确插入pET-28a质粒。

图1 pET-28a-G6PD的构建
2.2 表达产物的鉴定人G6PD分子量约58 ku,重组G6PD(recombinant G6PD, rG6PD)较之G6PD多出由载体翻译产生的29个氨基酸(分子量约3 ku),故rG6PD分子量约61 ku。由图2A可见,经IPTG诱导的BL21-pG1裂解液上清液及纯化产物有61 ku左右蛋白条带(箭头示),与rG6PD分子量相符,未经IPTG诱导时无61 ku的条带。经quantity one软件分析,纯化的G6PD总蛋白的84%。Western blot结果提示,经IPTG诱导后,BL21-pG1裂解液上清及纯化产物均存在61 ku条带(箭头示),与rG6PD分子量相符(图2B)。浓缩的rG6PD浓度为0.5 mg/ml,可知rG6PD总量为0.25 mg,故其表达量为2.5 mg/L。
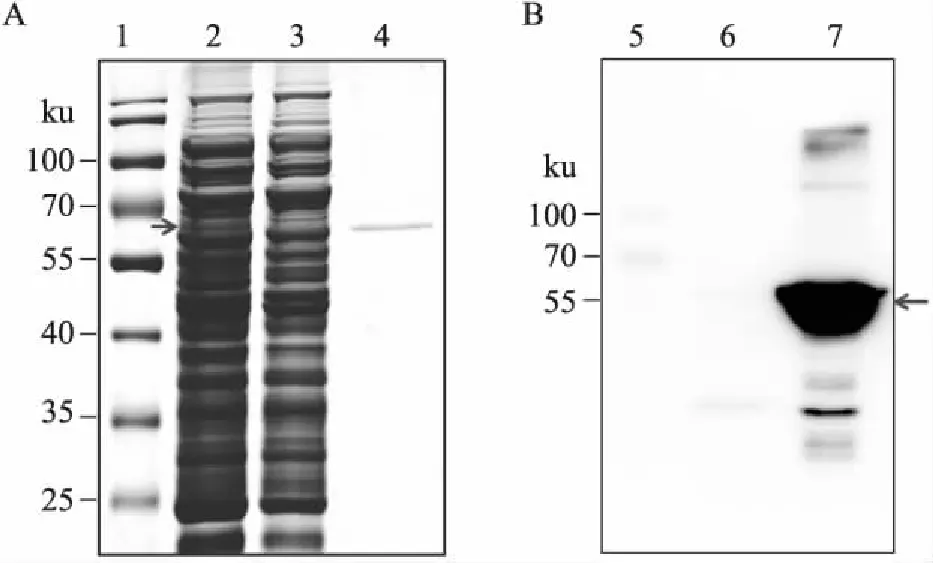
图2 鉴定G6PD表达产物
2.3 G6PD抑制剂体外筛选模型的建立
2.3.1G6PD最佳浓度的确定 不同G6PD浓度的时间-A340曲线见图3。不加G6PD时,保温过程中A340无变化。随G6PD浓度增大,A340升高速度加快。在测定起点,22.5、4.5、0.9 μg/ml G6PD组A340相同。反应0.5 min,三种G6PD浓度的A340升高值(ΔA340)依次为0.202、0.015、0.010;反应0.5~1 min,ΔA340依次为0.076、0.015、0.01;反应1~1.5 min,ΔA340依次为0.028、0.015、0.01。可见22.5 μg/ml G6PD浓度过大,最大反应速度发生在加入酶液后的30 s(甚至更短时间)内,因G6P被大量氧化,其浓度急剧降低,产物6-磷酸葡萄糖酸内酯急剧升高,导致反应速度快速下降。反应前3 min内,4.5、0.9 μg/ml G6PD组ΔA340分别恒定为0.015、0.010;反应3~6 min,4.5 μg/ml G6PD组每30 s内ΔA340逐步下降,0.9 μg/ml G6PD组ΔA340仍恒定为0.010。22.5 μg/ml G6PD组无法通过ΔA340来观测酶活力,不适合抑制剂的筛选; 4.5、0.9 μg/ml G6PD组前3 min均能通过ΔA340的变化来观测G6PD酶活力,但0.9 μg/ml G6PD组ΔA340恒定时间更长,便于操作,故稀释25倍是G6PD的最佳浓度(900 μg/L)。
2.3.2最佳DHEA浓度的确定 不同DHEA浓度的时间-A340曲线如图4,随DHEA浓度增大,A340升高速度逐步变慢。20、2、0.2 μmol/L的DHEA对G6PD的抑制率分别为(80.7±0.2)%,(40.1±1.7)%,(19.6±1.0)%;模型的Z′因子分别为0.88、0.74、0.18。Z′因子低于0.5时,模型不可靠;Z′因子越大,模型可靠性越高。可见,当DHEA为20 μmol/L时,Z′因子最符合高通量筛选要求。故DHEA最佳浓度为20 μmol/L。

图3 不同G6PD浓度的时间-A340曲线

图4 不同DHEA浓度的时间-A340曲线
3 讨论
本研究构建了大肠杆菌表达载体pET-28a-G6PD,重组菌BL21-pG1经0.4 mmol/L IPTG诱导表达、镍离子亲和纯化,获得可溶性的G6PD,产量为2.5 mg/L。以G6P为底物、NADP为辅因子、900 μg/L G6PD为最佳酶浓度、20 μmol/L DHEA为阳性对照,建立了高可信度的G6PD体外抑制筛选模型,为发现G6PD的抑制剂奠定了基础。
BL21-GPG6PD经IPTG诱导后在大肠杆菌中获得了高水平表达,但主要以包涵体形式存在(SDS-PAGE检测图未列出),可溶性蛋白产量偏低。汪自然 等[13]构建Luk S-PV与GFP融合蛋白表达载体在大肠杆菌中获得了较高水平的可溶性表达。后续拟将尝试G6PD与标签蛋白融合表达、延长诱导时间等措施提高可溶性G6PD的产量,以满足大规模抑制剂筛选对酶的需求。
G6PD纯度为84%,表明还存在少量杂质蛋白。杂质蛋白可能对酶促反应有一定干扰,为此拟在提高G6PD产量的基础上,进一步采用增加分子筛等纯化手段提高G6PD的纯度,尽可能降低杂质的干扰。
当底物浓度远大于酶浓度时,酶促反应速度与酶浓度成正比。理论上,22.5、4.5、0.9 μg/ml 的G6PD在最大反应速度阶段,ΔA340的比例应为25 ∶5 ∶1,而实际ΔA340比例约为202 ∶15 ∶10,具体原因需进一步研究。
基于体外筛选模型筛选的抑制剂,尚不能判断其在体内的毒副作用。G6PD抑制剂筛选模型亦如此,故采用本模型筛选所得的G6PD抑制剂,需要进一步观测其体内的毒副作用。
——一道江苏高考题的奥秘解读和拓展

