猪瘟病毒E2基因主要抗原区表达及Dot-ELISA建立研究
苏红辽 宗玉国
(1河南省滑县动物卫生监督所,河南安阳 456400;2山东省临朐县综合行政执法局,山东潍坊 262600)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)感染猪引起的一种急性或慢性、热性、高度接触性传染病[1]。该病临床症状以发病猪死亡、怀孕母猪繁殖障碍为主要特征,临床危害严重,被世界动物卫生组织(World Organization for Animal Health,WOAH) 列为必须报告疫病[2],我国将其列为二类动物疫病。欧洲部分发达国家已宣布成功消灭猪瘟,但包括我国在内的多数养猪国家和地区仍存在此病[3,4],甚至部分已宣布消灭猪瘟的国家仍不时发生[5],严重影响全球养猪业的健康发展[6]。以C株为代表的猪瘟弱毒疫苗在消灭、净化猪瘟过程中发挥了重要作用,但因实际免疫中存在盲目接种、接种后缺乏免疫效果监测甚至因免疫抑制等原因导致免疫失败[7]。因此,对生猪养殖场户、基层动物疫病预防控制机构而言,找到一种适宜于现地使用的CSFV抗体快速检测方法,有助于第一时间掌握猪群的猪瘟抗体水平,便于采取针对性防控措施。
依据我国发布的猪瘟诊断技术标准(GB/T 16551-2020),猪瘟抗体检测方法主要有病毒中和试验、酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)、免疫荧光试验等,但这些方法的使用场景主要以兽医实验室为主,且对人员、技术、设施、仪器等的要求相对较高,并不适宜养殖圈舍的现场使用。为此,本研究在分析了CSFVE2基因的主要抗原区域后,进行了E2基因的克隆、表达、纯化,经SDS-PAGE、Western blotting分析,表达的重组蛋白E2能够与CSFV阳性血清特异性结合,基于纯化的重组E2蛋白作为检测抗原,初步建立能检测猪瘟抗体的斑点酶联吸附试验(Dot-ELISA),该方法保留了常规ELISA的优点,克服了繁琐的操作程序,检测结果能直接肉眼观察,易于基层推广应用[8],将结果报道如下。
1 试验材料与方法
1.1 试验材料
1.1.1 菌(毒)株和质粒
猪瘟病毒、原核表达载体pET-28a(+)以及表达宿主菌Rosetta均由河南省滑县动物疫病控制中心保存。
1.1.2 主要试剂
TaKaRa RNA PCR Kit(AMV)Ver 3.0、Taq DNA聚合酶、EcoR I、Xho I和DNA胶回收试剂盒、T4 DNA连接酶均购自Takara;HRP标记羊抗猪IgG、BCA蛋白定量试剂盒购自生工生物工程(上海)股份有限公司;Immobilon ECL发光液购自Millipore公司;猪瘟阳性血清由河南省滑县动物疫病控制中心采集、鉴定并保存。
1.1.3 引物
根据Genebank中收录的CSFV Qixian株E2基因序列(KY816738),利用primer5.0设计1对扩增E2主要抗原区dE2的引物,预期扩增产物的大小为762 bp。引物序列:上游引物5’-GAGGAATTCAACCCATCA ACTGAGGAAATG-3’,下游引物5’-TATCTCGAGTT C TGCGAAGTAATCTGAGTGG-3’ (下划线分别为EcoR I和 Xho I位点)。
1.2 E2基因的RT-PCR扩增
1.2.1 cDNA合成
cDNA合成按照TaKaRa RNA PCR Kit(AMV)Ver 3.0说明书进行。
1.2.2 PCR扩增
PCR体系及反应参数分别如下,10×Taq DNA聚合酶缓冲液 5 μL、反转录 cDNA 5 μL,2.5 mmol/L dNTPs 2 μL,10 pmol/L上、下游引物各1.0 μL,Taq DNA聚合酶0.3 μL,灭菌超纯水补至50 μL;反应参数是 95℃ 5 min;94℃ 30 s,59℃ 30 s,72℃ 46 s,33个循环;72℃延伸6 min。
1.3 pET28a-dE2的构建
将E2基因PCR产物经核酸电泳、切胶回收纯化,再用EcoR I和Xho I双酶切后回收,与经EcoR I和Xho I酶切并回收的产物与pET-28a(+)连接,连接如下:E2 基因 4 μL,pET-28a(+)1 μL,5×T4 DNA连接酶缓冲液2 μL,T4 DNA连接酶1 μL,灭菌超纯水补至 10 μL,16℃过夜。转化 Rosetta,涂布于含 100 μg/mL卡那霉素(Kan) 的LBA平板上,37℃培养14~16 h,挑单菌落,培养后,分别进行PCR和双酶切鉴定,阳性质粒命名为pET28a-dE2,送生工生物工程(上海)股份有限公司测序,并进行NCBI BLAST分析。
1.4 pET28a-dE2的诱导表达
挑取pET28a-E2质粒转化的Rosetta,接种于含100 μg/mL Kan的LB液体培养基,37℃振摇培养至A600为0.5~0.6,加入0.1 mol/L IPTG至终浓度为0.2 mmol/L,37℃继续振摇培养6 h,备用。
1.5 E2基因的SDS-PAGE和Western blotting分析
1.5.1 SDS-PAGE分析
诱导培养物于4℃下3 000 r/min离心10 min,收集菌体,PBS洗涤,用1/10菌液体积的PBS重悬菌体,冰浴超声裂解菌体,4℃12 000 r/min离心10 min,收集上清,12%SDS-PAGE,染色,脱色,检测表达蛋白。同时设未诱导的pET28a-E2’为对照。
1.5.2 Western blotting分析
通过Western blotting分析E2基因的蛋白表达,方法参考文献[9],同时设未诱导的pET28a-E2’为对照。
1.6 Dot-ELISA方法的初步建立
纯化的dE2包被NC膜,建立检测E2抗体的Dot-ELISA方法如下:剪取硝酸纤维素膜,30 ng/μL的E2抗体,取1 μL涂于NC膜,37℃温箱干燥,10%脱脂奶粉37℃封闭1 h,PBST洗涤,CSFV抗体阳性血清(1∶200稀释)4℃孵育过夜,PBST洗涤,1∶3 000稀释HRP标记的羊抗猪IgG 37℃孵育30 min,PBST洗涤5次,置于AEC显色液中,至出现斑点后,终止显色。
2 结果与分析
2.1 E2基因主要抗原区的扩增
TR-PCR扩增获得了长度约为760 bp的E2基因片段(图1),与预期片段长度一致。
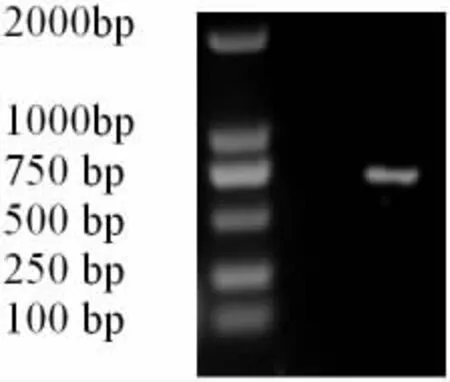
图1 E2基因RT-PCR扩增
2.2 pET28a-dE2的鉴定
pET28a-dE2的PCR鉴定获得了约760 bp的片段(图2-A),pET28a-dE2的EcoR I和Xho I双酶切鉴定获得了约530和760 bp的DNA片段(图2-B),与预期一致,表明E2基因扩增片段入pET-28a(+)载体。NCBIBLAST分析表明,扩增基因与我国CSFV分离株的E2基因对应序列的同源性≥98.84%以上(见图3)。

图2 pET28a-dE2的PCR(A)及双酶切 (B)鉴定

图3 E2基因主要抗原区序列Blast比对结果
2.3 E2重组蛋白的SDS-PAGE分析
SDS-PAGE分析结果(图4-A)显示,pET28adE2经IPTG诱导表达了约32.4 KDa的重组蛋白,而未诱导pET28a-dE2’转化菌则未见相应条带,与预期结果一致,表明E2基因主要抗原区已获得成功表达。
2.4 dE2重组蛋白的Western blotting分析
Western blotting结果(图4-B)表明,pET28a-E2诱导菌在约32.4 KDa处有特异性条带,而未诱导pET28a-E2’转化菌则未见相应条带,表明诱导菌中表达的E2蛋白能够与CSFV感染阳性血清发生特异性反应。
2.5 Dot-ELISA方法的初步建立
由Dot-ELISA显色结果(图4)可知,纯化dE2与CSFV抗体阳性血清反应,有可见斑点,而等量未诱导的菌体蛋白则不与CSFV抗体阳性血清反应,无可见斑点,表明重组蛋白作为包被抗原建立的Dot-ELISA,可检测猪血清中的CSFV抗体。

图4 E2重组蛋白的SDS-PAGE (A)和Western blotting (B) 分析

图4 重组蛋白的Dot-ELISA
3 讨论与结论
猪瘟是由猪瘟病毒引起猪的一种高度传染性疾病,呈急性或慢性经过,分布范围广,世界各地都有发生,能导致发病猪的死亡及母猪的繁殖障碍。当前,通过猪瘟疫苗接种和严格的生物安全措施,猪瘟的流行得到了有效控制。但我国在猪瘟免疫时间方面,由于缺乏及时、准确的免疫监测,导致免疫时机的选择具有很大的盲目性,常造成免疫失败[10,11]。相较于需要专业技术人员、专用设备的商品化CSFV抗体检测试剂盒,建立简便、易行、可现场使用的猪瘟抗体检测方法,及时对猪瘟抗体进行监测,给免疫时机选择提供参考,并且及时检测免疫效果,才是广大养殖场户和基层动物防疫机构开展猪瘟免疫并确保免疫效果的重要保障[5]。
鉴于Dot-ELISA的猪瘟抗体检测方法操作简便、易行,并且不需要特殊仪器设备读取检测结果,便于在基层推广应用[12]。E2是猪瘟病毒重要保护性抗原[13],本研究首先分析了E2主要抗原区,RT-PCR扩增了E2的主要抗原区(dE2),构建了重组表达载体pET28a-dE2,并利用SDS-PAGE和Western blotting成功表达了猪瘟病毒的重组蛋白抗原和特异性结合猪瘟抗体,然后利用表达的重组蛋白建立了检测猪瘟抗体的Dot-ELISA,为猪群猪瘟抗体检测提供了有效工具,通过猪瘟抗体检测,不仅可为猪瘟免疫时机选择提供参考,而且可以及时了解猪瘟免疫接种效果。此外,NCBI BLAST分析,发现本研究扩增的猪瘟病毒E2的主要抗原区与多个毒株E2基因对应序列的同源性≥99.8%,多数可达100%。表明本研究建立的Dot-ELISA,在检测猪群猪瘟抗体时具有较好的代表性和通用性,可为猪瘟病毒抗体检测提供有效工具。

