促生荧光假单胞菌对桃树根区土壤环境和植株生长的影响
杨晓帆,梁家慧,于文英,吴雪莲,李艳艳,肖元松,彭福田
(山东农业大学园艺科学与工程学院 / 作物生物学国家重点实验室, 山东泰安 271018)
我国桃树种类繁多,栽培历史悠久,距今已有3000多年,栽培地区广泛,在2019年我国桃种植面积和产量均居世界首位[1],桃产业在我国农业经济建设方面发挥重要作用。由于果园立地条件较差、化肥施用不当,使桃树生产中存在果实品质下降、优质果比例低等问题[2-3]。本课题组前期研究表明,桃树生产中普遍存在过量施肥现象,大量施入化肥不仅不能合理有效地改善土壤环境,还会造成资源浪费,引起环境污染[4]。因此,如何采取一定措施改善根区土壤条件,提高根区土壤养分有效性,减少化肥投入量成为研究的重点。
利用有益微生物来改善土壤微生物环境,调控植物生长发育,已成为当今农业可持续发展的重要科学策略之一[5]。生活在植物根际并且有利于植物生长的细菌称之为植物根际促生菌(plant growth promoting rhizobacteria,PGPR),荧光假单胞菌属于假单胞菌属,是一种重要的植物根际促生菌[6]。许多研究证明,荧光假单胞菌等根际促生菌对于蓝莓[7]、甘蓝型油菜、紫金草、大豆[8]、甘蔗[9]、小麦[10]、番茄[11]、樱桃[12]等作物,都具有一定促进生长的作用,不仅可以改善根际土壤,提高作物品质,降低植物病虫害发生几率,提高植物抗性,还可以减少化肥的施用,改善生态环境,具有很大的应用潜力。但是目前关于荧光假单胞菌促进桃树生长的研究,多围绕其间接促生的效应与机制,比如通过降低桃蚜的繁殖力[13-14]、抑制桃根腐病的发生[15]来提高桃树的抗逆能力,然而,对于荧光假单胞菌对桃树的直接促生效应及作用机制,却鲜有研究报道。
为此,我们研究了荧光假单胞菌(Pseudomonas fluorescens)的促生特性及其对桃树根区土壤环境和桃树生长的影响,明确荧光假单胞菌在桃树根系-土壤微生态系统中的作用机制,以期为荧光假单胞菌的桃树根际应用、构建绿色环保的桃园生态系统提供理论参考。
1 材料与方法
1.1 细菌促生能力的鉴定
试验所用荧光假单胞菌菌株购自北纳生物公司,编号为BNCC231887,按照说明书活化培养。细菌促生能力的鉴定方法及鉴定培养基的配制参考周波等[16]和易浪波等[17]的研究方法,具体方法如下:菌株产吲哚-3-乙酸(IAA)能力的测定,将荧光假单胞菌按照1%的接种量接种到NB培养基(添加0.5 g/L的L-色氨酸)中,置于28℃、180 r/min摇床培养7天,菌悬液离心取上清液与Salkowski试剂以1∶2的比例混匀,室温暗处显色30 min后观察是否显红色,并于530 nm处比色,计算其IAA产量。
菌株产铁载体能力的检测:将菌株点接种于CAS固体培养基上,28℃培养7天,观察菌落周围是否有黄色晕圈的产生。
菌株溶磷与解钾能力的测定:将菌株分别点接种于以磷酸钙为磷源的PKO固体培养基和以大豆卵磷脂为磷源的有机磷固体培养基及钾长石培养基上,28℃培养7天,观测菌落形态及培养基变化。将菌株荧光假单胞菌按照1%的接种量接种到PKO和有机磷液体培养基,28℃培养7天,离心取上清,采用钼锑抗比色法测定溶磷量。
1.2 荧光假单胞菌的使用浓度试验
将KB培养基中培养24 h的荧光假单胞菌菌液离心取菌体沉淀,用无菌水重悬备用。盆栽试验在山东农业大学南校区园艺实验基地进行,栽培用土由基地表层园土、园艺栽培通用基质(主要成分为泥炭、珍珠岩、椰糠、碳化稻壳等)与蛭石以2∶1∶1的比例配制而成,基本理化性质为pH 8.20、碱解氮40.18 mg/kg、速效磷 51.53 mg/kg、速效钾 78.45 mg/kg、有机质23.05 g/kg。预备试验所用塑料盆高为20 cm,盆口直径为24 cm、盆底直径为15 cm,每盆装土2 kg,供试材料为桃树生产上常用的砧木毛桃[Prunuspersica(L.) Batsch]。选取实验室育好的长势一致的健壮毛桃实生苗移栽至盆中,1棵/盆,缓苗15天。荧光假单胞菌菌悬液配成4个浓度(0、2×108、4×108、6×108CFU/mL),浇在土壤上,每次处理浇50 mL,每5天处理一次,共处理3次。在处理后20、40、60天时测定桃苗叶片SPAD值,处理后60天时测定桃苗叶绿素含量及生长量,并确定最佳菌液处理浓度。
叶绿素含量的测定:叶绿素相对含量SPAD值由SPAD-502Plus叶绿素测定仪测定,叶绿素的绝对含量测定采用丙酮浸提比色法[18]。
生长量的测定:株高采用皮尺测定,植株地上部与地下部的干重和鲜重采用万分之一电子天平测定。
1.3 荧光假单胞菌对土壤理化及生物学性状和桃树生长的影响试验
采用以毛桃为砧木,2年生的桃品种‘瑞光39/毛桃’ [P.persica(L.) Batsch]嫁接苗为试材进行盆栽试验。栽培容器为直径30 cm、高30 cm的美植袋,每袋用土16 kg,土壤理化性状与预备试验一致。依据预备试验结果,荧光假单胞菌菌悬液(PF)的最佳浓度为4×108CFU/mL,此浓度作为处理用浓度。将PF浇在土壤上,然后覆土,每7天浇灌处理一次,每次浇灌300 mL,共浇灌4次,以清水处理(CK)为对照。在第4次浇灌处理后,于1、2、4、6周时采集桃树根区土壤样品测定荧光假单胞菌数量,于20和40天时取植株样品测定光合指标、生物量、根系生长发育状况和养分含量,于40天时采集根区土壤样品测定土壤微生物结构、酶活性、养分状况和pH。
土壤中荧光假单胞菌数量的测定参照杜鹃等[19]的研究方法,即:以荧光假单胞菌的蛋白编码基因gyrB作为靶标基因,利用特异性引物建立实时荧光定量PCR的方法。
植物生理生化指标与土壤理化性质的测定主要参考赵世杰[18]和鲍士旦[20]的方法,各项指标测定3次重复,结果取其平均值,具体方法如下:
叶片净光合速率(Pn)、胞间二氧化碳浓度(Ci)、气孔导度、蒸腾速率的测定:在晴天上午9:30—11:00,选取长势高度一致的桃苗叶片利用CIRAS-3便携式光合仪测定系统(PP Systems,美国)测定。
根系构型的测定:取完整植物根系洗净,放入A4尺寸扫描仪的丙烯酸托盘中,加水使根系均匀散开,避免交叉重叠,采用专业版Win RHIZO (Rgent Instruments Inc., Canada)根系分析软件对根系构型扫描和分析(分辨率为300 dpi),各参数的设定参照软件使用说明进行。
植物养分含量的测定:植物材料经H2SO4-H2O2消煮后采用火焰分光光度计法测定植物全钾含量,采用钼黄比色法测定植物全磷含量,采用凯氏定氮仪测定植物全氮含量;植物材料经HNO3-H2O2微波消解后,采用原子吸收分光光度计测定植株全铁含量。
土壤养分含量的测定:根区土壤速效磷含量的测定采用碳酸氢钠浸提—钼锑抗比色法,碱解氮含量的测定采用碱解扩散法,有机质含量采用重铬酸钾容量法[21],土壤全铁含量采用DTAP浸提—原子吸收分光光度计测定。
土壤酶活性的测定:土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定,碱性磷酸酶活性采用磷酸苯二钠比色法测定,蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,过氧化氢酶活性采用高锰酸钾滴定法测定[21]。
土壤微生物的测定:每处理采集5棵桃树的根区土壤,混匀,对样本的基因组DNA进行提取,使用16S V4区引物(515F和806R)和ITS1区引物(ITS5-1737F和ITS2-2043R)进行PCR扩增,使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和QPCR定量,文库合格后,使用NovaSeq6000进行上机测序。
1.4 数据处理和分析
土壤微生物测序结果使用FLASH软件进行拼接,利用Uparse算法(Uparsev7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs (Operational Taxonomic Units),使用Qiime软件(Version 1.9.1)计算Chao1和Shannon指数。
采用Excel和IBM SPSS Statistics 26软件对数据进行计算和分析,采用邓肯多重比较法进行差异显著性检验,采用Pearson相关系数法进行相关性分析,采用GraphPad Prism 8软件进行作图。
2 结果与分析
2.1 荧光假单胞菌的促生特性
经过鉴定,促生荧光假单胞菌BNCC231887在NB培养基内28℃培养7天之后,其培养液上清可与Salkowski试剂反应显红色,而空白培养基与Salkowski试剂反应不显红色,证明了荧光假单胞菌BNCC231887具有产IAA的能力,通过测定,IAA产量为6.17 mg/L;该菌株能够在CAS检测培养基上生长并使菌落周围形成黄色晕圈,证明其可以产生铁载体;该菌株在不溶性无机磷PKO固体培养基上形成透明圈,28℃培养7天之后其透明圈直径(D)与菌落直径 (d) 大小之比(D/d)为1.62,在不溶性有机磷培养基有较强的生长能力,培养7天之后在不溶性无机磷和有机磷液体培养基中溶磷量分别为45.98和18.52 mg/L,表明了该菌株具有溶解磷酸钙和一定的降解有机磷的能力;该菌株在钾长石培养基上呈光滑半透明的油滴状,28℃培养7天之后直径大小为5.22 mm,具备一定的解钾能力(图1)。

图1 荧光假单胞菌产IAA能力的鉴定及其在不同培养基中的生长形态Fig.1 Identification of IAA production and the colonies of P.fluorescens in different mediums
2.2 荧光假单胞菌对1年生毛桃实生苗生长的影响
2.2.1 荧光假单胞菌对毛桃实生苗叶绿素含量的影响 通过检测叶片SPAD值(图2)发现,与对照相比,使用不同浓度荧光假单胞菌处理毛桃实生苗均可显著提高叶片SPAD值。如图2所示,当菌浓度低于4×108CFU/mL时,毛桃实生苗叶片SPAD值随菌液处理浓度的升高而升高,当菌液处理浓度超过4×108CFU/mL时,叶片SPAD值在处理后20和40天时与4×108CFU/mL处理持平,在处理后60天时较4×108CFU/mL处理降低,表明4×108CFU/mL浓度处理效果最好,在处理60天时4×108CFU/mL处理叶片SPAD值较对照显著提高了43.5% (P<0.05)。由于SPAD值体现叶片的相对叶绿素含量,因此我们进一步对叶片的叶绿素绝对含量进行了量化测定,结果显示荧光假单胞菌处理显著提高了叶片的叶绿素含量,且4×108CFU/mL为最佳处理浓度(表1)。这些结果表明荧光假单胞菌处理可以提高桃实生苗叶片的叶绿素含量,并且4×108CFU/mL荧光假单胞菌浓度处理效果最为显著。

图2 荧光假单胞菌处理对桃树实生苗叶片SPAD值的影响Fig.2 Effects of P.fluorescens treatments on SPAD of peach seedling leaves

表1 荧光假单胞菌处理对桃树实生苗叶片叶绿素含量的影响Table 1 Effects of P.fluorescens treatment on chlorophyll content of peach seedling leaves
2.2.2 荧光假单胞菌对桃树实生苗根系构型及植株生长量的影响 首先通过测定不同处理的桃树实生苗根系构型,发现PF处理显著增加了侧根的数量,同时提高了根系表面积和体积,且4×108CFU/mL浓度作用效果最显著(图3)。

图3 不同浓度荧光假单胞菌处理对毛桃实生苗根系构型的影响Fig.3 Effects of P.fluorescens treatment on root architecture of peach seedling
由表2可看出,与对照相比,荧光假单胞菌处理显著提高了桃树实生苗的生长量,4×108CFU/mL荧光假单胞菌浓度处理对提高桃苗地上与地下部干重提高效果最显著,分别较对照提高了151.0%和93.3% (P<0.05)。

表2 荧光假单胞菌处理对桃树实生苗生物量的影响Table 2 Effects of P.fluorescens treatment on plant growth of peach seedling
2.3 荧光假单胞菌在桃树嫁接苗根区土壤的定植
荧光假单胞菌在根区土壤的有效定植是其发挥作用的重要前提。在本试验中,通过土壤中荧光假单胞菌中gyrB基因的拷贝数来表示荧光假单胞菌的含量,CK组测得荧光假单胞菌含量表示土壤中本身含有的荧光假单胞菌含量。如图4所示,在处理后第1周,由于外源施加大量荧光假单胞菌,PF处理桃树根区土壤中荧光假单胞菌含量显著高于CK。随处理时间的延长,在第2周时PF处理桃树根区土壤中荧光假单胞菌含量较第1周显著降低,但仍高于对照组,表明PF施入土壤2周有部分定植。在处理后第4~6周,PF处理桃树根区土壤中荧光假单胞菌含量缓慢降低,仍显著高于CK,表明荧光假单胞菌在施入土壤6周时仍有部分定植。该试验结果表明,荧光假单胞菌可在桃树根区土壤中长期定植,进而发挥其促生作用。

图4 不同处理时间的桃树根区土壤的荧光假单胞菌含量Fig.4 The quantity of P.fluorescens in peach root-zone soil at different days after treatment
2.4 荧光假单胞菌对桃树嫁接苗根区土壤的影响
2.4.1 荧光假单胞菌对土壤pH和土壤养分含量的影响 由表3可知,PF处理可以显著降低桃树根区土壤的pH,相比于CK降低了0.19;PF处理可显著提高桃树根区土壤的养分含量,其中有机质、速效磷、碱解氮、速效钾和有效铁含量分别较CK提高了8.4%、42.3%、15.9%、39.5%和6.6% (P<0.05)。

表3 荧光假单胞菌处理对桃树根区土壤pH及养分含量的影响Table 3 Effects of P.fluorescens treatment on rhizospheric soil pH and nutrient contents of peach
2.4.2 荧光假单胞菌对土壤酶活性的影响 土壤酶活性是土壤肥力的一个重要指标,在很大程度上反映了土壤中物质循环与转化的强度。如图5所示,PF处理可以显著提高桃树根区的土壤酶活性,蔗糖酶、脲酶、碱性磷酸酶和过氧化氢酶活性分别较CK提高了37.6%、4.3%、34.2%和40.2% (P<0.05)。

图5 荧光假单胞菌处理对桃树根区土壤酶活的影响Fig.5 Effects of P.fluorescens treatment on soil enzyme activity of root-zone of peach
2.4.3 荧光假单胞菌对土壤微生物群落的影响 如图6所示,对于土壤细菌来说,从门水平上看,CK组的优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota),相对丰度分别为27.8%、11.6%、10.4%、8.0%和7.3%;PF处理和CK细菌群落组成相似,但其丰度存在差异,与CK相比,PF处理使变形菌门、酸杆菌门和放线菌门相对丰度分别提高了23.4%、8.6%和8.0%,拟杆菌门和厚壁菌门相对丰度分别降低了46.7%和35.7%。从属水平上看,CK优势菌属为拟杆菌属(Bacteroides)、鞘氨醇单胞菌属(Sphingomonas)和芽孢杆菌属(Bacillus),相对丰度分别为3.3%、3.9%和4.6%;PF组优势属为拟杆菌属和鞘氨醇单胞菌属,与CK相比拟杆菌属相对丰度降低了16.6%,鞘氨醇单胞菌相对丰度提高了32.2%,芽孢杆菌属相对丰度为0.6%,与CK相比降低了86.7% (P<0.05)。

图6 荧光假单胞菌处理对桃树根区土壤微生物相对丰度的影响Fig.6 Effects of P.fluorescens treatment on microbial relative abundance of root-zone soil of peach
对于土壤真菌来说,CK组优势菌门是子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)和担子菌门(Basidiomycota),相对丰度分别为71.1%、8.8%和2.9%;与CK相比,PF组子囊菌门相对丰度降低为67.1%,担子菌门相对丰度降低为1.8%,而被孢霉门相对丰度较CK升高了21.2%。从属水平上看,CK组优势菌属为木霉菌属(Trichoderma)、头束菌属(Cephalotrichum)、被孢霉属(Mortierella)和毛壳霉属(Chaetomium),相对丰度分别为14.6%、6.6%、7.7%和8.9%,PF组木霉菌属和毛壳霉属相对丰度较CK分别显著降低了79.5%和49.7% (P<0.05),头束菌属和被孢霉属相对丰度较CK分别提高了58.0%和21.4%,镰孢菌属(Fusarium)相对丰度较CK显著升高了45.2% (P<0.05),成为PF组优势菌属之一。
土壤微生物群落的Alpha多样性分析可以反映微生物群落的丰度和多样性,其中,Chao 1指数反映微生物群落丰富度,Shannon指数反映微生物群落多样性。从图7看出,对土壤细菌菌群而言,PF处理Chao 1和Shannon指数较CK没有显著提高,离散程度也较大;对于真菌菌群而言,PF处理使土壤真菌群落Chao 1和Shannon指数较CK分别提高了28.5%和8.5% (P<0.05),离散程度也小于CK。
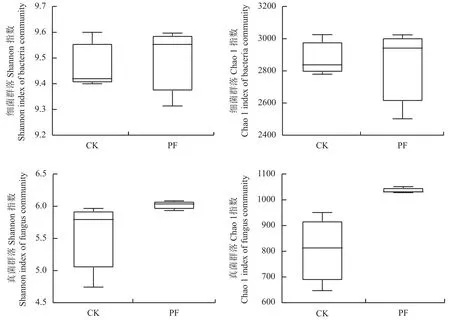
图7 桃树根区土壤细菌和真菌Alpha多样性分析Fig.7 Alpha diversity analysis of soil bacteria and fungus in peach root-zone soil
2.5 荧光假单胞菌处理对桃树嫁接苗根系生长的影响
由表4可以看出,与CK相比,PF处理可以促进桃树根系生长,根系长度、表面积、体积和根尖数分别显著提高了23.2%、67.3%、21.3%和87.0%(P<0.05)。

表4 荧光假单胞菌处理对桃树根系生长的影响Table 4 Effects of P.fluorescens treatment on root growth of peach
2.6 荧光假单胞菌对桃树嫁接苗叶片光合参数的影响
PF处理显著提高了桃树叶片的净光合速率,在处理后20和40天时分别较CK显著提高了23.7%和8.3% (P<0.05),PF处理一定程度上也提高了桃树叶片的气孔导度和蒸腾速率(图8)。

图8 荧光假单胞菌处理对桃树叶片光合参数的影响Fig.8 Effects of P.fluorescens treatment on photosynthetic parameters of peach leaves
2.7 荧光假单胞菌对桃树嫁接苗养分含量的影响
由图9看出,在处理后40天时,PF处理的桃树叶片和根系的全氮、全磷和全钾含量较CK都有显著提高(P<0.05),其中全氮含量在叶片和根中分别提高了4.9%和52.9%,全钾含量在叶片和根中分别提高了7.5%和17.4%,全磷含量在叶片和根中分别提高了9.2%和17.5%,对于植物全铁含量来说,PF处理使桃树叶片全铁含量升高了26.0%,使根系全铁含量降低了9.2%,表明荧光假单胞菌处理可能提高了桃树含铁量,并且影响铁元素在植物体内的分配。

图9 荧光假单胞菌处理对桃树养分含量的影响Fig.9 Effects of P.fluorescens treatment on nutrient content of peach
2.8 荧光假单胞菌对桃树嫁接苗生物量的影响
由表5可以看出,PF处理可以显著提高桃树的生物量,与CK相比,株高提高了14.8% (P<0.05),茎粗增加了3.8%,地下部分和地上部分干重分别显著提高了19.3%和19.9% (P<0.05)。

表5 荧光假单胞菌处理对桃树生物量的影响Table 5 Effects of P.fluorescens treatment on biomass of peach
2.9 桃树根区土壤理化性质与植物养分含量和生物量的相关性分析
由表6可知,在本试验中土壤pH与大部分土壤酶活性、土壤速效养分含量、叶片和根系养分含量和生物量显著负相关,大部分土壤养分含量与植株养分含量和生长显著正相关,如土壤速效磷含量与土壤磷酸酶活性、桃树全磷含量和桃树生长量显著正相关,然而土壤有效铁含量与桃树叶片全铁含量显著正相关,但与根系全铁含量无显著相关关系。

表6 桃树根区土壤理化性质、土壤酶活与植株养分含量和生物量的相关性分析Table 6 Correlation analysis of soil physical and chemical properties, soil enzyme activity of peach root-zone with nutrient content and biomass of peach
3 讨论
3.1 荧光假单胞菌的促生特性与根际定植
一株荧光假单胞菌往往具有多种促生机制,各种促生机制共同作用,调控植株生长。在本试验中,荧光假单胞菌具有多种促生特性,包括产IAA、溶磷、解钾、产铁载体的能力,其中该菌株在解无机磷的定性与定量检测中均表现出了较强的溶磷能力,具有很大的应用潜力[21]。
在桃树嫁接苗试验中,多次浇灌处理使荧光假单胞菌表现出了较长时间的根际定植,进而充分发挥其促生作用。在实际生产中,可以进行荧光
假单胞菌处理技术简化,比如选在桃树的关键物候期,结合平时施肥与浇水处理。为了提高荧光假单胞菌的定植率和定植时间,也可以将荧光假单胞菌制成海藻微胶囊埋入根区土壤从而达到缓释的作用[22]。
3.2 荧光假单胞菌对桃树根系生长和光合作用的影响
植物通过根系与土壤进行营养交换[23],植物根系吸收水分和养分的能力在一定程度上可以通过根长和表面积等指标来体现[24]。在本试验中,荧光假单胞菌处理显著提高了桃树嫁接苗根系的根长,增加了根系表面积和体积,促进了桃树水分和养分的吸收。植物根系的生长与侧根的发育受植物激素IAA的调控,前人研究证明,产IAA菌产生的IAA作为外源植物激素,可以显著增加植物侧根和根毛的数量,提高植株内部生长素的浓度[25];王婧[26]研究发现,枯黄假单胞菌产生IAA可显著促进番茄侧根的发育和提高玉米根长。在本试验中,PF处理使桃树嫁接苗根长和根尖数显著增加,这可能归因于PF产生的微量IAA。
光合作用是植物生长的生理基础,光合作用增强,植株生物量也会随之增加[27]。在本试验中,PF处理显著提高了桃树叶片的净光合速率,同时显著提高了植物干重。PF处理通过光合作用提高植株生物量的方式有以下两个方面:首先,叶绿素含量是影响光合作用的重要因素,其含量的增加有利于植物叶片对光能的捕获进而增强光合作用[28],在本试验中,PF处理显著提高了桃树叶片的叶绿素含量,这与前人研究结果[29-30]一致;其次,气孔导度的增加有利于植物光合作用的提高[31],在本试验中,PF处理使植株叶片气孔导度增强,促进了CO2的吸收,进而提高了植株的净光合速率。
3.3 荧光假单胞菌对桃树根区土壤速效养分和植株养分含量的影响
磷和钾是植物必需的营养元素,在保障作物高产、增强作物抗性和提升作物品质等多方面起着不可替代的作用,但土壤中大部分磷和钾都以难溶性的磷酸盐和硅酸盐形态存在,无法直接被植物吸收利用。具备溶磷和解钾能力的植物根际促生菌可以将土壤中难溶性磷和钾转化为植物可直接吸收利用的和K+,提高磷钾肥利用率,促进作物生长[32-33]。本试验首先鉴定了荧光假单胞菌具有溶磷和解钾的促生特性,根施处理显著提高了桃树根区土壤速效磷和速效钾含量,促进了桃树根际土壤中难溶性磷和钾的转化;同时荧光假单胞菌处理还显著降低了根区土壤的pH,且土壤pH与土壤速效磷、速效钾含量显著负相关。由于荧光假单胞菌的施用导致了土壤pH的降低,进而提高了土壤速效磷钾养分含量,进一步提高了桃树全磷和全钾含量和生物量。
铁元素是植物不可或缺的微量元素,土壤中的绝大部分铁都是以难溶于水的Fe3+形式存在,不能被根系吸收,有效态铁含量很低。根际促生菌产生的铁载体能活化土壤中的Fe3+,增加土壤铁的溶解性,从而提高土壤中铁的有效性,不仅可以促进植物生长,而且也能帮助植物抵御病原菌的侵染[34]。前人研究证明,土壤有效铁含量受土壤pH影响较大,每升高一个pH单位,土壤溶液中铁的活性减小1000倍[35]。在本试验中,荧光假单胞菌处理提高了桃树根际土壤有效态铁的含量,促进了植物对铁元素的吸收,显著增加了桃树叶片的总铁含量,一方面可能归因于荧光假单胞菌具有产生铁载体的能力,另一方面是由于荧光假单胞菌降低了土壤pH,从而促进土壤中无效铁到有效铁的转化。
3.4 荧光假单胞菌对桃树根区土壤生物学特征的影响
土壤是土壤中各种生理生化反应的场所。土壤酶在催化土壤多种生化反应中起着重要作用,土壤酶活性升高会加速土壤养分的分解与转化,促进植物对土壤养分的吸收与利用[36],其中脲酶与植物的氮素营养吸收有关[37],蔗糖酶活性能够反映土壤有机碳累积与分解转化的规律[38],磷酸酶能促进有机磷化合物和无机磷酸盐转化,有利于植物对磷的吸收与利用[39],过氧化氢酶有助于土壤中过氧化氢的分解,降低土壤有害物质对植物体的毒害作用。本试验中,荧光假单胞菌处理提高了土壤酶活性,包括土壤脲酶、蔗糖酶、磷酸酶以及过氧化氢酶,这与前人的研究结果[40]一致,荧光假单胞菌处理使土壤磷酸酶活性显著升高,导致了土壤速效磷含量升高,进而导致植株全磷含量的增加。
土壤酶大多来源于土壤微生物,土壤微生物也是土壤生化反应的主要驱动力[41]。本试验中,荧光假单胞菌处理使土壤细菌和真菌群落的Shannon和Chao 1指数提高,提高了土壤微生物群落的丰富度和多样性。从微生物群落结构上来看,荧光假单胞菌处理改变了细菌各优势菌门的相对丰度,其中变形菌门、酸杆菌门和放线菌门的相对丰度提高,拟杆菌门和厚壁菌门的相对丰度降低。荧光假单胞菌处理没有改变土壤中的优势菌门,这可能是由于它们在土壤中的生态幅较宽[42],外源荧光假单胞菌的短期处理对它们的分布影响较小。变形菌门包含大量有益微生物,如大量α变形杆菌与固氮相关,酸杆菌门可以通过参与腐殖酸降解的碳循环、分泌植物激素IAA等促进植物生长,放线菌门可以降解大量有机物质,同时还可以拮抗病菌,这些菌群在维持土壤生态系统稳定中起重要作用[43]。荧光假单胞菌处理也显著改变了土壤真菌各优势菌门的相对丰度,其中被孢霉门相对丰度显著升高。腐生真菌被孢霉门在有机质含量高的土壤中相对丰度较高,在土壤养分转化中起重要作用,前人研究证明,施加被孢霉可以提高园区土壤的速效磷、钾、钙、镁含量,促进土壤养分转化,促进植株生长[44-45]。
土壤的理化性质与土壤微生物群落结构是相互影响的,前人研究证明,通过施加微生物菌剂,使栽培基质中微生物数量增加,酶活性升高,促进了基质中有机物的分解与转化,促进了植物对养分的吸收与利用[46]。在本试验中,由于外源添加了大量荧光假单胞菌,改善了土壤微生物群落,土壤微生物群落的改变又导致了土壤养分被微生物大量固定,加速了土壤有机物的合成与转化[47],根区微生物活动的增加,使根区土壤酶活性增加,土壤肥力提高,进而促进了桃树生长。
4 结论
荧光假单胞菌具有产IAA和铁载体、溶解无机磷和有机磷、降解难溶性钾的促生特性。土壤施用荧光假单胞菌菌悬液可以显著改善桃树嫁接苗根区土壤环境,增加根区土壤微生物群落多样性,改变根区土壤微生物群落结构,降低土壤pH,提高根区土壤速效氮磷钾和铁含量,提高土壤酶活性,从而促进了桃树嫁接苗侧根的形成和生长,提高了叶片的净光合速率和养分含量,进而促进桃树生长。

