膀胱癌细胞凋亡相关基因的鉴定及意义
宋晔娜 俞程程 陈宇珂
膀胱癌是泌尿系统常见的恶性肿瘤,据估计每年约有100万新发病例,并有大约20万人死于膀胱癌[1]。膀胱分为肌层浸润性和非肌层浸润性,20%~25%的患者在首诊时即被确定为肌层浸润性膀胱癌。肌层浸润性膀胱癌是患者死亡的主要原因,其长期生存率不理想,远处转移风险较高[2]。肌层浸润性膀胱癌预后不良可能归因于对膀胱癌的分子特征和生物学机制认识不足。因此,寻找可靠的预测预后的生物标志物加以提前干预,对预测临床预后、指导治疗具有重要意义。细胞凋亡是由基因控制的有序生理过程,细胞内各组分在这一过程中相互协调,在维持机体内环境稳定方面起重要作用,在细胞代谢过程中,一旦细胞凋亡失衡,将会导致许多疾病。细胞凋亡是一种由基因调控的细胞程序性死亡,研究表明细胞凋亡在各种肿瘤的发生发展中起着重要作用,但是其与膀胱癌的关系却并未得到研究[3]。文章旨在明确膀胱癌细胞凋亡相关基因的表达,以更好地了解膀胱癌的发生和发展机制。
1 资料与方法
1.1 基因表达与差异表达基因分析
从TCGA数据库网站下载膀胱癌样本的转录组RNA测序数据,包括患者年龄、性别、病理分级、临床分期、病理TNM(tumor node metastasis)分期、总生存时间等临床信息。抗生素耐药基因(antibiotic resistance genes,ARGs)集从基因集富集分析(gene set enrichment analysis,GSEA)下载,其中包括163个通过胱天蛋白酶激活而定义凋亡的基因。使用R软件的limma软件包,在转录数据中进行了膀胱癌和非肿瘤样品之间的差异表达基因(DEGs,differentially expressed genes)。然后在匹配DEG之后鉴定差异表达的ARG。
1.2 ARGs的鉴定及预测模型的建立
通过单因素Cox回归分析确定与OS显着相关的ARGs(P<0.05)。通过多因素Cox回归分析最终确定与OS相关的ARG(P<0.05)。以多变量Cox回归为基础,采用glmnet软件包,应用OS相关的ARGs建立预后模型。每位患者的ARGs风险评分计算如下:风险评分=[(系数mRNA1)×(mRNA1的表达)]+[(系数mRNA2)×(mRNA2的表达)]+……+[(系数mRNAn)×(mRNAn的表达)]。根据中位风险评分将所有膀胱癌患者分为高风险组和低风险组,通过生存ROC程序包进行ROC分析,并用AUC评估其判别力。
1.3 AGRs预后模型与其他临床病理特征的独立性
为了确定该预后模型是否在其他临床特征中有意义,将癌症基因组图谱(the cancer genome atlas,TCGA)数据集中的所有临床病理特征,包括年龄、性别、病理分级、临床分期、病理TNM分期,分为两组。患者分为:年龄≤65岁、年龄>65岁;女性、男性;病理等级高、等级低;Ⅰ/Ⅱ期、Ⅲ/Ⅳ期;病理性T1/2、T3/4;病理性N0、N1。Kaplan-Meier分析用于评估每个亚组中高危组和低危组之间的总生存时间(overall survival,OS)差异。
1.4 预后相关的ARG的临床应用
通过R软件包“ggpubr”分析与预后相关的ARGs与临床病理特征(包括年龄、性别、病理等级、临床分期、病理TNM分期)的相关性。将所有具有临床病理特征的患者分为两组,分别为年龄≤65岁和年龄>65岁的亚组,女性和男性亚组,病理分级的高和低亚组,临床Ⅰ/Ⅱ和Ⅲ/Ⅳ期亚组,病理T1/2和T3/4组,病理N0和N1/2/3组。通过R软件通过Wilcox检验比较每个亚组之间的差异表达。
1.5 观察指标
观察研究病例患者的性别、年龄、肿瘤分期、肿瘤分级、淋巴结以及远处转移等临床病理特征,比较膀胱癌组织与非肿瘤组织之间差异表达的ARG,筛选差异基因。
1.6 统计学处理
所有统计均使用R 3.6.1和GraphPad Prism 7(San Diego,CA,USA)进行。计量资料表示为(±s),计数资料以n(%)表示。通过R软件的Wilcox检验比较组之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 TCGA数据集中的409例膀胱癌患者的临床病理特征
在笔者的研究中,TCGA数据集中共有409例膀胱癌患者,其中106例女性和303例男性患者。他们的病理阶段从Ⅰ期到Ⅳ期不等。T分期从1~4,N分期从0~3,M分期从0~1。见表1。

表1 TCGA数据集中膀胱癌症患者的临床病理特征
2.2 膀胱癌组织与非肿瘤组织之间差异表达的ARG
本研究共纳入409例具有RNA-seq数据和临床随访信息的原发性膀胱癌患者。膀胱癌与非肿瘤组织之间存在4 880个DEG,见表2)。与163个AGR匹配后,膀胱癌与非肿瘤组织之间存在40个AGR,包括21个下调基因和19个上调基因,见图1a。然后,将火山图可视化以显示PCa与非肿瘤组织之间差异表达的ARGs的表达模式,见图1b。

图1 在膀胱癌和非肿瘤组织中不同表达的ARGs
2.3 与预后相关的五个ARG 单变量
Cox回归分析中共有9个ARG与OS显着相关,多变量Cox回归分析中有5个ARG,它们分别是AIFM3、CASP6、EMP1、GSN、TAP1,见表2。

表2 ARGs相关OS的单变量和多变量Cox回归分析
2.4 ARGs相关的预后模型构建和验证
Kaplan-Meier生存曲线表明,低危组的死亡率低于高危组(P<0.001),见图2a。与OS相关的预测基因的ROC曲线如图所示。图2b中的AUC为0.686,风险评分的分布,OS状态和预后性5种ARG的热图如图2c所示。高危组的患者预后较差,而低危组的患者预后较好。
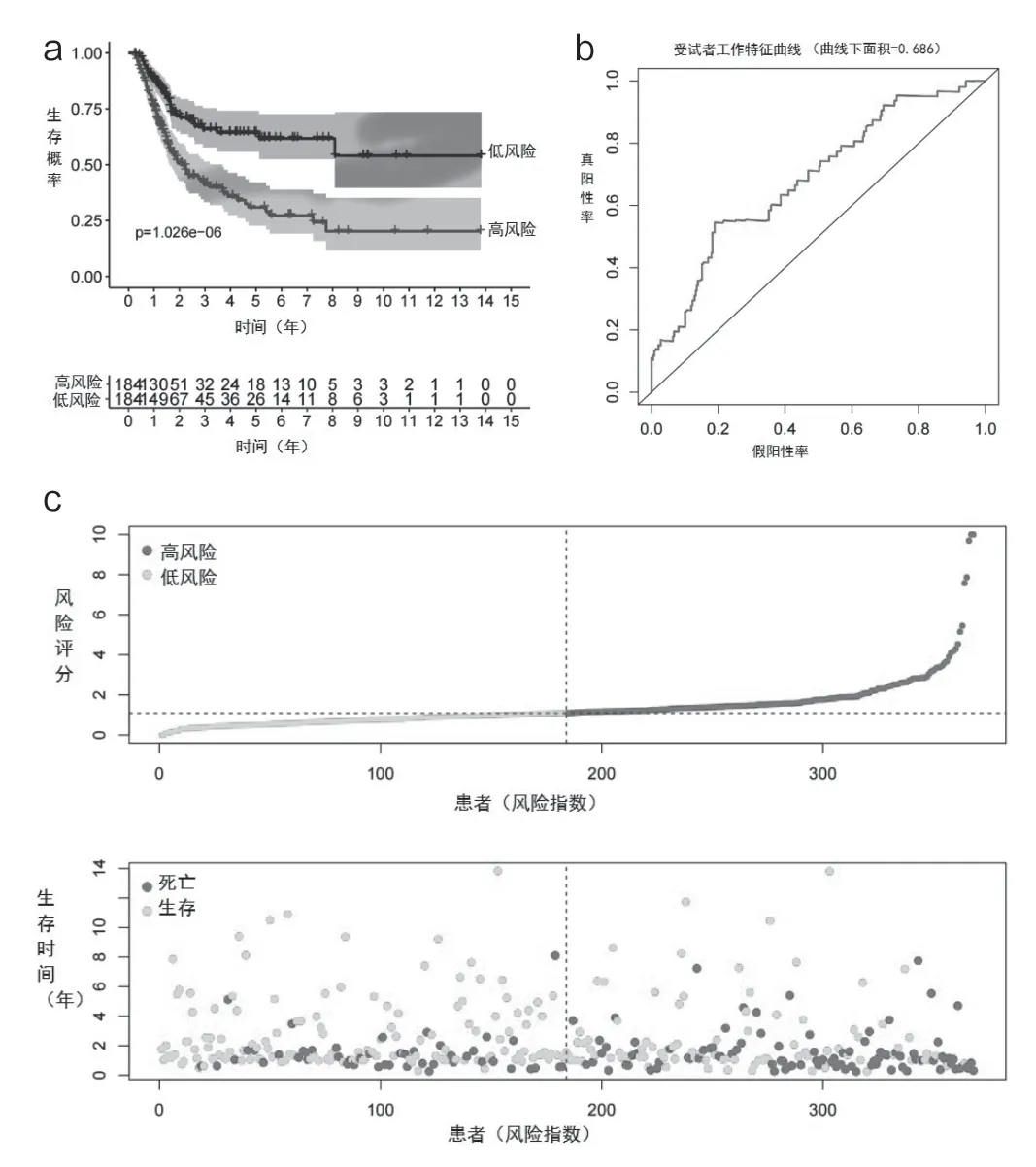
图2 KM生存分析、TCGA-BC数据集中的时间依赖性ROC曲线和预后相关ARG的风险评分评估
2.5 与预后相关的ARGs模型与其他临床病理特征的独立性
图3显示了根据预后相关ARGs按临床特征分层的亚组的KM生存结果。与其他临床病理特征无关,低风险组的预后要好于高风险组,差异有统计学意义(P<0.05)。

图3 临床分层亚组的K-M生存分析
3 讨论
在癌变过程中正常细胞转化为恶性细胞,避免细胞死亡是导致这种恶性转化的重要细胞变化之一。20世纪70年代,Kerr等人将凋亡与潜在恶性细胞的消除、增殖和肿瘤进展联系起来[4]。恶性肿瘤细胞逃避凋亡的途径很多,包括破坏促凋亡蛋白和抗凋亡蛋白之间的平衡,破坏死亡受体信号通路等[5-6]。凋亡是一种受基因调控的程序性细胞死亡,研究[6]表明细胞凋亡在各种肿瘤的发生和发展中起着重要作用。然而凋亡相关基因在膀胱患者中的预后价值研究还很有限。因此,笔者尝试从多个凋亡相关基因构建一个风险评分模型,以提高膀胱癌患者生存率的预测能力。
本研究中笔者结合TCGA和GSEA数据库来筛选膀胱肿瘤和正常组织中差异表达的ARG,并对ARG进行了单变量Cox回归分析和多元Cox回归分析,最终笔者筛选了5个ARG(AIFM3、CASP6、EMP1、GSN、TAP1),它们与膀胱癌患者的生存率显著相关。多项研究表明这些基因在肿瘤发生中起重要作用。EMP1可用作多种肿瘤的潜在生物标志物,包括卵巢癌、骨肉瘤和乳腺叶状肿瘤[7-9]。EMPs家族的成员包括EMP1,EMP2和EMP3,EMP1也被称为CL-40或肿瘤相关膜蛋白(tumor-associated membrane protein,TMP)。研究表明[10]EMP1参与细胞黏附、增殖和分化,在肿瘤形成和转移中起着至关重要的作用。一些研究[7-9]表明EMP1可能是包括卵巢癌等多种肿瘤的潜在生物标志物。Miao等[11]发现,在胶质母细胞瘤中,高表达的EMP1通过激活PI3K/AKT/mTOR信号通路促进肿瘤细胞增殖、侵袭和转移。Wang等[8]发现EMP1在骨肉瘤组织中表达上调,并且与淋巴转移和远处转移密切相关,它可通过IRX2/MMP9轴刺激骨肉瘤的恶性进展。Singh等[12]发现在儿童急性淋巴细胞白血病治疗过程中EMP1过度表达,且EMP1的mRNA表达可作为儿童B-ALL患者风险分层的潜在生物标记物。
Caspase是半胱氨酸天冬氨酸蛋白酶的家族,在介导细胞程序性死亡和维持细胞内稳态中起着重要作用。根据其在凋亡级联中的功能,Caspase可分为启动子(Caspase-2、-8、-9)或 执 行 子(Caspase-3、-6、-7)32。Caspase-6(CASP6)表达为一种非活性酶原[13]。已有研究[14]表明,单独过表达CASP6可促进细胞凋亡和死亡,在人类癌症基因调查中发现许多CASP6特异性底物与肿瘤相关。具有代表性的肿瘤相关CASP6底物包括双链断裂修复蛋白RAD21、肿瘤细胞抗原p53和TP53;乳腺癌1型易感蛋白BRCA1;补充XP-G细胞的DNA修复蛋白ERCC5;DNA错配修复蛋白MLH1;ras相关蛋白Rab-10、RB10。因此,CASP6与这些已知的肿瘤相关底物之间的串扰表明CASP6可能参与了癌症的发生。几年前,有报道[15]在肿瘤相关组织中进行了初步的CASP6体细胞突变研究,在胃癌和结直肠癌组织中检测到3个CASP6体细胞突变,表明CASP6在肿瘤的发生发展中具有一定作用。
凝胶素(glsolin,GSN)是一种肌动蛋白结合蛋白,用于切割和覆盖肌动蛋白丝,调节细胞骨架的周转,在细胞运动中起重要作用。此外,GSN还可以调节细胞形态、增殖甚至凋亡,已发表的数据表明[16]GSN在肝癌、结肠癌、胃癌、宫颈癌、卵巢癌等实体肿瘤中下调,表明其对肿瘤的发生发展具有调控作用。早期研究发现TAP1和TAP2在各种癌症中均下调,其与肿瘤预后有关。TAP1蛋白的过表达被认为是乳腺癌侵袭性的指标,这可能是由于高级别肿瘤下调TAP1的能力较低,或由于在产生IFN-γ的微环境中较高的免疫浸润浓度,导致TAP亚基被上调[17]。在大肠癌中,带有神经周围浸润的肿瘤中TAP1的水平降低,这使得TAP1的下调成为Ⅰ期和Ⅱ期疾病患者的预后因素[18]。在食道癌中,发现癌症组织中TAP1蛋白的上调是不利的预后因素[19]。
为了确定这些特异性基因是否可作为膀胱癌预后因子,笔者构建了一个基于5个基因的的预测模型。单因素和多元Cox回归分析结果表明,笔者发现了一种新的分子生物学标志物和凋亡相关危险信号,可用于准确预测膀胱癌患者的临床预后。笔者用K-M分析验证了这一点,并观察到高危分患者的生存率明显较差。这些结果表明,五基因风险评估法具有较高的预后评估价值,不仅是预测膀胱癌患者预后的一种新方法,而且有助于临床医师制定个性化的治疗方案。

