铁死亡相关lncRNA结肠癌预后风险模型的构建及临床应用
汪雨卿,张 越,徐 稳,崔中奇
(1.上海大学计算机工程与科学学院,上海 200444;2.同济大学附属第十人民医院检验科,上海 200072)
结肠癌是世界第三大恶性肿瘤,居肿瘤致死原因的第2位[1-2]。近10年来,尽管结肠癌的诊断和治疗已取得了一定的进展,但由于缺乏早期筛查和预后监测的生物标志物,导致患者的死亡率居高不下[2]。铁死亡是一种铁依赖性脂质过氧化物积累所致的细胞调节性死亡,明显异于细胞凋亡、细胞自噬和细胞焦亡[3]。铁代谢紊乱是导致肿瘤发生、发展的重要因素[4]。与正常细胞相比,肿瘤细胞表现出明显的铁成瘾性,而激活铁死亡途径可在一定程度上克服化疗药物的耐药性,为肿瘤的治疗开辟新的领域[5]。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度约为200个核苷酸的RNA分子。lncRNA除具有调控基因表达的经典功能外,在肿瘤的发生、发展、预后和治疗中也扮演着不可忽视的作用[6]。目前,关于铁死亡相关lncRNA的研究很少。本研究拟基于肿瘤基因图谱计划(the Cancer Genome Atlas,TCGA)数据库筛选铁死亡相关lncRNA,建立结肠癌的预后风险模型,同时探索关键lncRNA ITGB1-DT在结肠癌中的生物学功能,为结肠癌的治疗和预后评估提供新的思路。
1 材料和方法
1.1 研究对象
选取2019年7月—2021年12月同济大学附属第十人民医院行结肠癌根治术的患者48例,其中男26例、女22例,年龄39~72岁。所有患者均未经过任何化疗或放疗,术后经病理诊断确诊为结肠癌。收集术中切除的癌组织及对应的癌旁组织(距癌组织边缘2~3 cm),立即放入液氮中保存。本研究经同济大学附属第十人民医院伦理委员会批准,所有患者均知情同意。
从TCGA数据库(https://www.cancer.gov/tcga/)中收集结肠癌转录组数据和相应的临床资料。通过Ensembl网站(http://asia.ensembl.org/index.html)注释人类基因注释文件(GRCh38.103.chr.gtf.gz),以区分mRNA和lncRNA。剔除临床资料不完整和缺失生存数据的患者,最终保留428例结肠癌患者用于后续分析。
1.2 方法
1.2.1 差异表达铁死亡相关基因的获取和生物学功能分析 通过铁死亡数据库(FerrDb)(http://www.zhounan.org/ferrdb/) 获得288个铁死亡相关基因,其中铁死亡驱动基因108个、铁死亡抑制基因69个、铁死亡标志基因111个。采用R软件中的“limma”程序包对结肠癌组和正常对照组中的铁死亡相关基因进行差异性分析,筛选标准为|logFC|≥1且P<0.05。采用R软件“Clusterprofilter”程序包对这些差异基因进行基因本体(Gene Ontology,GO)富集分析和京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。
1.2.2 预后相关的铁死亡lncRNA的筛选 采用Pearson相关分析筛选铁死亡相关的lncRNA,筛选标准为r≥0.3且P<0.001。采用R软件“survival”程序包中的Cox比例风险回归模型筛选与结肠癌预后相关的铁死亡lncRNA,筛选标准为P<0.01。
1.2.3 结肠癌患者中铁死亡相关lncRNA的共识聚类分析 使用R软件“Consensus Cluster Plus”程序包进行无监督有共识聚类分析。根据预后相关的铁死亡lncRNA表达与模糊聚类测量比例之间的相似性确定具有最佳稳定性的聚类数。采用“survival”程序包评估不同集群(集群1和集群2)的患者总体生存率。
1.2.4 铁死亡相关lncRNA预后风险模型的建立 将428例结肠癌患者按7∶3的比例随机分为训练组和验证组。在训练组中进行LASSO回归分析,“惩罚”参数采用R软件“glmnet”程序包,通过10倍交叉验证的方式进行估算,根据最小的λ值筛选出10个lncRNA,按公式计算风险评分:风险评分=∑风险系数(genei)×每个lncRNA的表达量(expi)。随后采用R软件“survival”程序包绘制Kaplan-Meier生存曲线,比较高、低风险组的总体生存率。采用R软件“time ROC”程序包绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评估预后模型判断结肠癌患者1年生存、3年生存和5年生存的效能。
1.2.5 临床列线图的构建 根据428例结肠癌患者的临床资料(年龄、性别、肿瘤Stage分期、TNM分期)和风险评分,利用“rms”程序包绘制列线图,用于预测结肠癌患者的1年、3年和5年的生存率。
1.2.6 RNA提取和实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR) 取适量组织样本,加入1 mL TRIzol裂解液(美国Invitrogen公司),提取总RNA,采用NanoDrop 2000紫外分光光度计(美国ThermoFisher Scientific公司)检测RNA的纯度及浓度。采用Prime-Script RT试剂盒(日本TaKaRa公司)对提取的RNA进行逆转录,获得互补DNA(complementary DNA,cDNA)。采用SYBR试剂盒(日本TaKaRa公司)对ITGB1-DT进行定量检测,检测仪器为ABI 7500 PCR扩增仪(美国ABI公司)。ITGB1-DT的正向引物序列为5'-TGTATGTGATGGCTTTGGAG-3',反向引物序列为5'-AGGTGGGCAGTGGTATGG-3'。以GAPDH为内参,采用2-ΔΔCt法分析ITGB1-DT的相对表达量。严格按仪器和试剂盒说明书进行操作。
1.2.7 细胞培养和转染 结肠癌细胞系HCT-116和SW480均购自美国典型培养物保藏中心(American type culture collection,ATCC)细胞库。所有细胞均置于含10%胎牛血清(美国Invitrogen公司)和1%青霉素-链霉素(美国Invitrogen公司)的Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM)(美国Gibco公司)中,在37 ℃、5%CO2条件下进行培养。
将HCT-116细胞和SW480细胞分别接种于6孔板中,待细胞融合度达60%~70%时进行细胞转染。按Lipofectamine 2000试剂(美国Invitrogen公司)说明书,分别将干扰对照质粒(sh-NC)、ITGB1-DT表达干扰质粒(sh-ITGB1-DT#1和sh-ITGB1-DT#2)转染至HCT-116细胞和SW480细胞。转染24 h后采用RT-qPCR检测ITGB1-DT的表达量,以确定转染效率。所有质粒均购自生工生物工程(上海)股份有限公司。干扰质粒的序列见表1。

表1 干扰质粒的序列
1.2.8 细胞增殖和克隆形成能力的检测 (1)细胞增殖实验。采用CCK-8试剂盒检测HCT-116细胞和SW480细胞的增殖水平。收集转染不同质粒的HCT-116细胞和SW480细胞,按1 000个细胞/孔接种到96孔板中,同时每孔加入10 μL反应液,每组设置6个重复孔。分别于培养24、48、72和96 h时检测每孔450 nm波长处的吸光度(A)值,绘制生长曲线。(2)克隆形成实验。收集转染不同质粒的2种结肠癌细胞,按照2 000个/孔接种到6孔板中,加入新鲜的DMEM,每隔2天换1次培养液,培养2周后,弃去培养液,加入4%多聚甲醛固定15 min,弃去固定液,加入0.1%结晶紫染色液2 mL,染色30 min,拍照并采用Image J软件(美国国立卫生研究院)进行计数分析。
1.2.9 细胞死亡和脂质过氧化的测定 采用碘化丙啶(美国Invitrogen公司)染色确定细胞是否死亡。HCT-116细胞和SW480细胞转染不同质粒后用胰蛋白酶消化,清洗2次,并重新悬浮在500 μL含500 ng/mL碘化丙啶的磷酸盐缓冲液中,37 ℃孵育20 min后,采用LSRFortessa X-20流式细胞仪(美国BD公司)检测细胞活力。采用2 μmol/L BODIPY-C11(美国Invitrogen公司)对转染不同质粒的2种结肠癌细胞进行染色,并用LSRFortessa X-20流式细胞仪检测细胞的脂质过氧化水平。
1.2.10 谷胱甘肽检测 采用还原型/氧化型谷胱甘肽试剂盒(美国Dojindo Molecular Technologies公司)检测细胞内谷胱甘肽水平。收集1×106个细胞重悬于5%磺基水杨酸中,并用玻璃珠涡旋混匀(混匀4次,每次1 min),随后冰水浴15 min,以17 900×g离心10 min,收集上清液,用蒸馏水稀释5倍,然后测定谷胱甘肽水平。
1.3 统计学方法
采用R 4.0.3软件和Graphad Prism 9.0软件进行统计分析和作图。组间比较采用Wilcoxon秩和检验和Kruskal-Wallis检验。采用Kaplan-Meier生存曲线分析结肠癌患者的生存情况。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价预后风险模型预测结肠癌患者1、3、5年生存的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 差异表达的铁死亡相关基因的生物学功能分析结果
通过TCGA数据库对428例结肠癌组织和41例正常结肠组织进行基因差异表达分析,筛选出72个差异表达的铁死亡相关基因,其中表达上调47个、表达下调25个。GO聚类分析结果显示,差异表达的铁死亡相关基因主要涉及缺氧反应、脂肪酸代谢和铁离子反应等;KEGG通路富集分析结果显示,差异表达的铁死亡相关基因主要涉及不饱和脂肪酸生物合成、P53和白细胞介素-17(interleukin-17,IL-17)等信号通路。见图1。

图1 差异表达的铁死亡相关基因涉及的生物学功能
2.2 结肠癌患者铁死亡相关lncRNA鉴定结果
相关性分析结果显示,共有2 423个lncRNA与72个差异表达的铁死亡相关基因显著相关。单因素Cox回归分析结果显示,2 423个lncRNA中,有20个与结肠癌患者的总体生存率相关。进一步比较这20个lncRNA在结肠癌组织和正常组织中的表达,发现其在结肠癌组织与正常组织中的表达不同(P<0.01、P<0.001)。见图2。
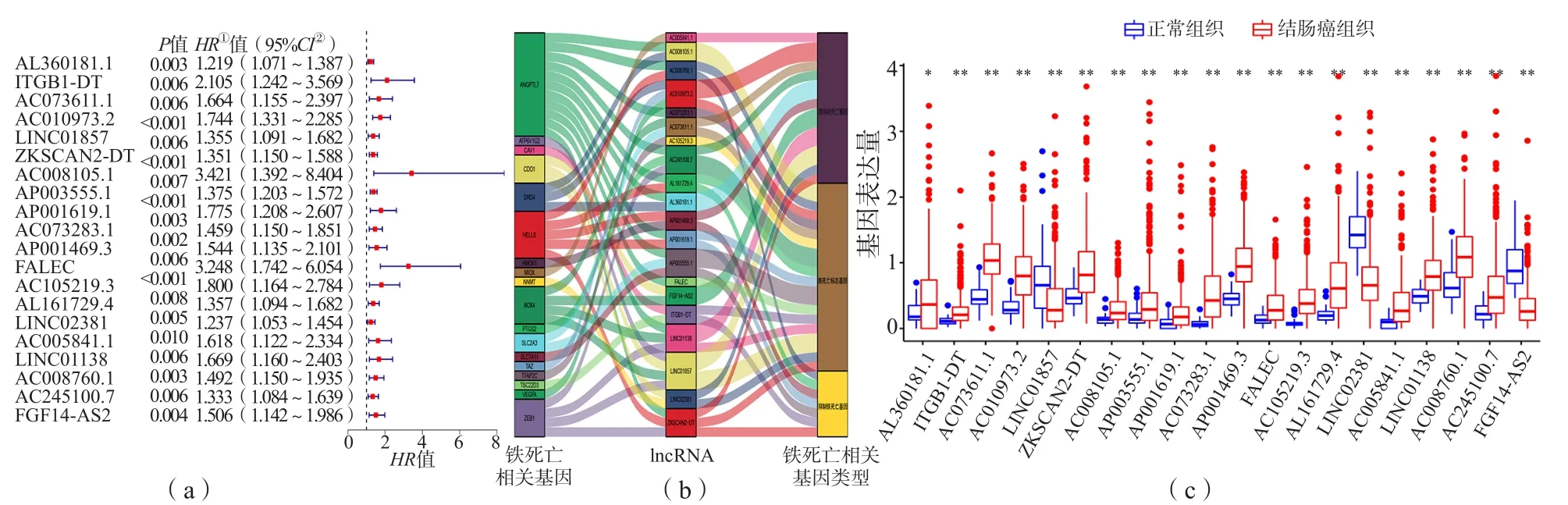
图2 铁死亡相关lncRNA的鉴定
2.3 结肠癌预后相关铁死亡lncRNA的共识聚类分析结果
共识聚类分析结果显示,当k=2时,具有最佳的聚类稳定性。根据k值将结肠癌患者分为2个集群:集群1(333例)和集群2(89例)。Kaplan-Meier生存曲线分析结果显示,集群2的总体生存率显著低于集群1(P<0.001)。见图3。
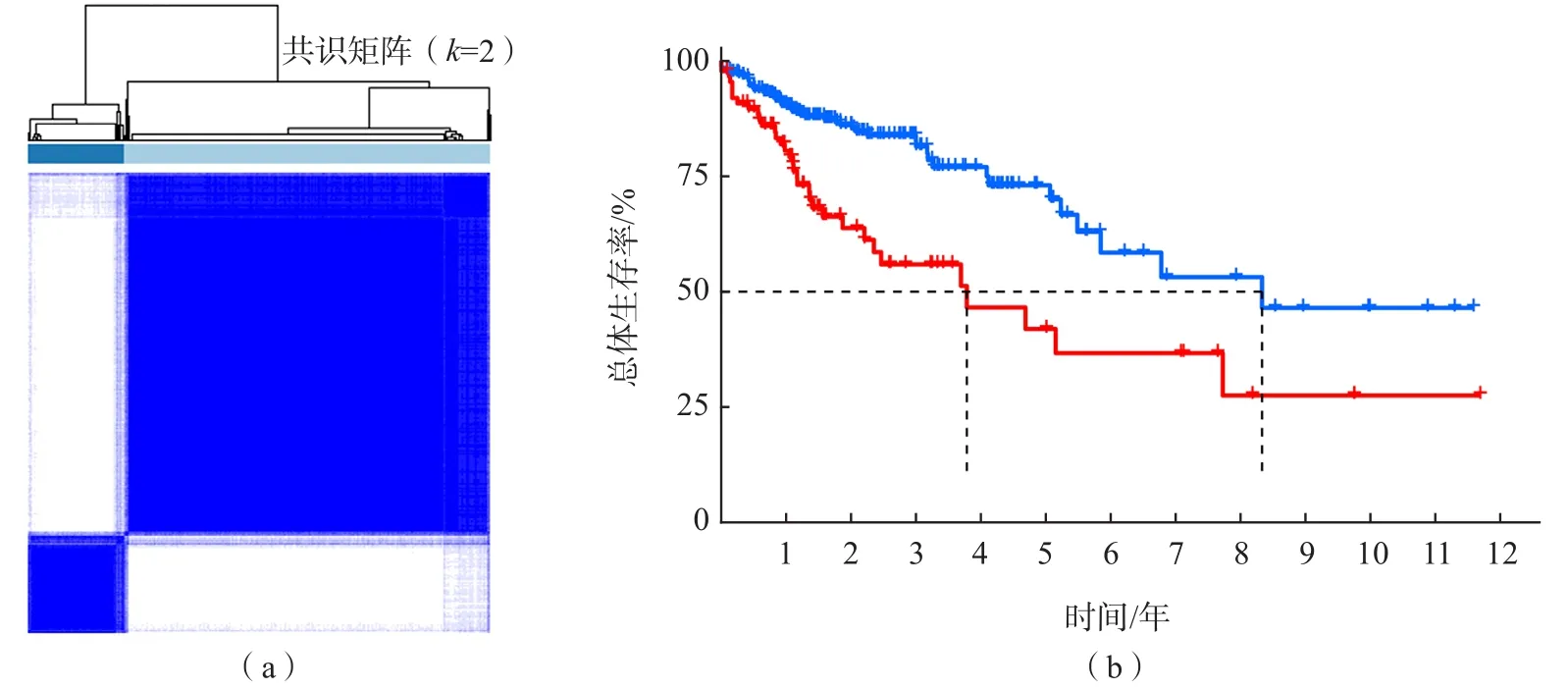
图3 铁死亡相关lncRNA的共识聚类分析
2.4 铁死亡相关lncRNA风险评分的构建
根据LASSC-Cox回归分析结果,按最小λ值标准,共筛选出10个lncRNA用于构建预后风险模型,见图4(a)、(b),模型中每个lncRNA的风险系数见图4(c)。根据这10个lncRNA的表达量和系数计算出每个结肠癌患者的风险评分,计算公式为:风险评分=0.036 7×AL360181.1+0.798 9×ITGB1-DT+0.038 3×AC073611.1+0.112 1×AC010973.2+0.159 3×AP003555.1+0.010 6×AP001469.3+0.671 0×FALEC+0.137 8×AC105219.3+0.188 6×AC005841.1+0.367 4×FGF14-AS2。根据风险评分的中位数,将训练组中的患者分为高风险组和低风险组,Kaplan-Meier生存曲线分析结果显示,高风险组总体生存率显著低于低风险组(P<0.001),见图4(d)。在验证组中得到了相同的结果,见图4(e);ROC曲线分析结果显示,在训练组中,该预后风险模型预测结肠癌患者1、3和5年生存的曲线下面积(area under curve,AUC)分别为0.733、0.790、0.776,见图4(f);在验证组中,该预后风险模型预测结肠癌患者1、3和5年生存的AUC分别为0.697、0.726、0.722,见图4(g)。
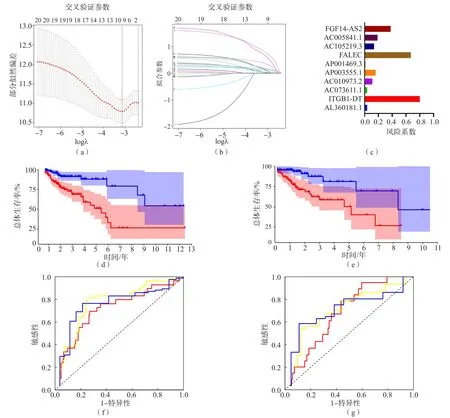
图4 铁死亡相关lncRNA预后风险模型的构建及验证
2.5 预后风险模型在结肠癌预后判断中的价值
对于结肠癌患者总体,Kaplan-Meier生存曲线分析结果显示,高风险组总体生存率显著低于低风险组(P<0.001),见图5(a)。ROC曲线分析结果显示,预后风险模型判断结肠癌患者1、3和5年生存的AUC分别为0.717、0.759、0.735,见图5(b)。单因素Cox回归分析结果显示,年龄、肿瘤Stage分期、肿瘤T分期、远隔转移、淋巴转移和风险评分与结肠癌患者的总体生存率相关(P<0.01);多因素Cox回归分析结果显示,年龄、肿瘤T分期和风险评分是影响结肠癌患者的总体生存率的独立危险因素,见表2。

表2 结肠癌患者总体生存率的Cox回归分析

图5 预后风险模型在结肠癌患者预后判断中的价值
2.6 铁死亡lncRNA预后风险模型和临床病理因素列线图的构建
将患者的风险评分与临床参数结合,构建诺模图。通过计算患者临床参数和风险评分获得总分,预测患者的1、3和5年生存率分别为96.1%、90.3%和83.3%。见图6。

图6 结肠癌患者列线图的构建
2.7 ITGB1-DT lncRNA在结肠癌中的功能的验证结果
ITGB1-DT在预后风险模型中的风险系数最高。结肠癌组织ITGB1-DT相对表达量显著高于癌旁组织(P<0.001)。在HCT-116细胞和SW480细胞中,sh-ITGB1-DT#1组和sh-ITGB1-DT#2组ITGB1-DT表达、细胞增殖能力均显著低于sh-NC组(P<0.001、P<0.01),细胞的死亡率、活性氧水平和细胞内还原型GSH/氧化型GSH比值均显著高于sh-NC组(P<0.01、P<0.01、P<0.001)。见图7。
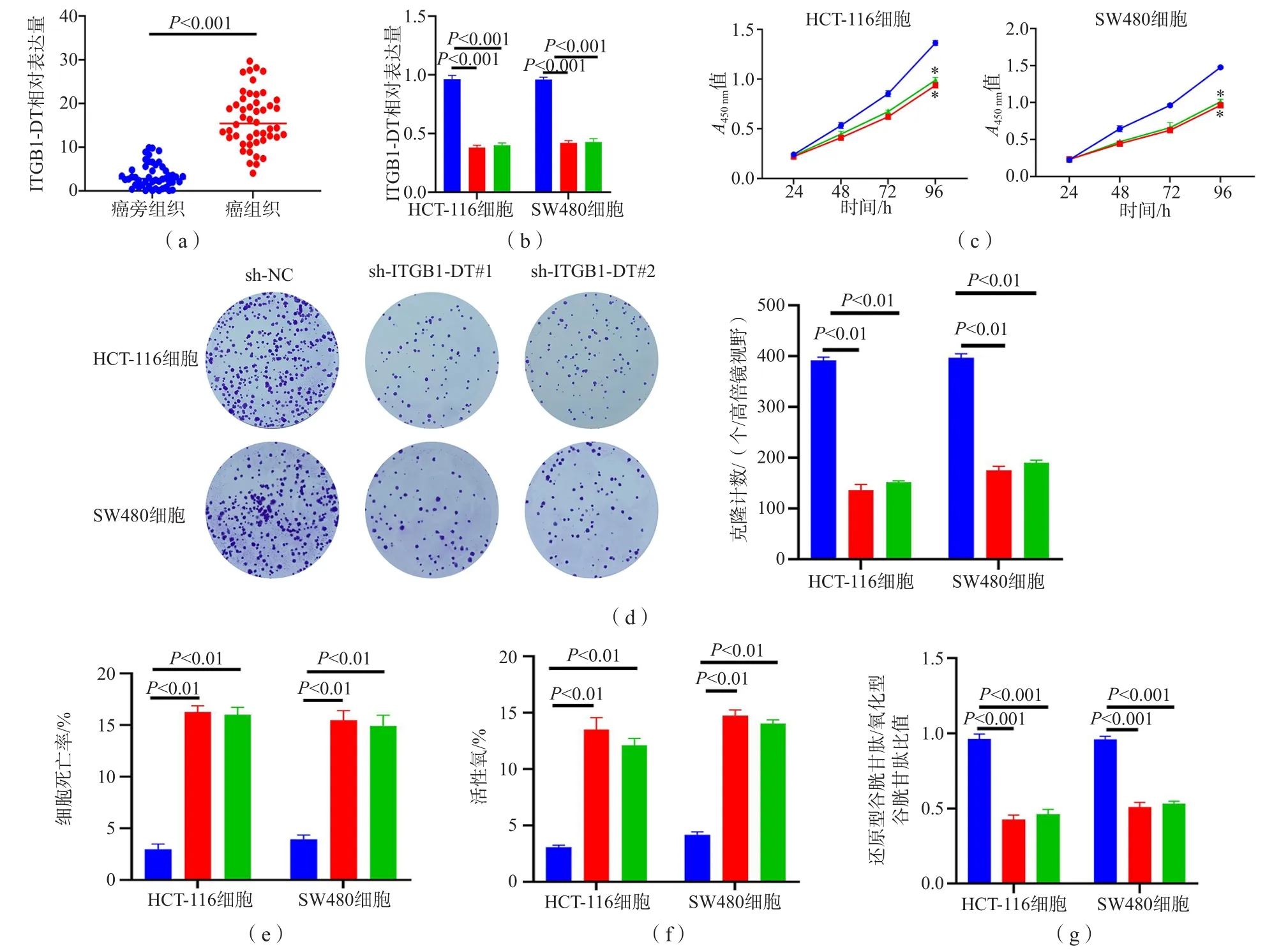
图7 ITGB1-DT对结肠癌细胞增殖及铁死亡的影响
注:(a)癌组织与癌旁组织中ITGB1-DT相对表达量的比较;(b)各组ITGB1-DT相对表达量比较;(c)干扰ITGB1-DT对HCT-116和SW480细胞增殖的影响;sh-NC;sh-ITGB1-DT#1;sh-ITGB1-DT#2;与sh-NC比较,*P<0.01;(d)干扰ITGB1-DT对HCT-116和SW480细胞克隆形成的影响;(e)干扰ITGB1-DT对HCT-116和SW480细胞死亡的影响;(f)干扰ITGB1-DT对HCT-116和SW480细胞活性氧的影响;(g)干扰ITGB1-DT对HCT-116和SW480细胞还原型谷胱甘肽/氧化型谷胱甘肽比值的影响;sh-NC;sh-ITGB1-DT#1;sh-ITGB1-DT#2。
3 讨论
结肠癌是一种具有高度异质性的恶性肿瘤,发病率高,病亡率高[7]。目前尚缺乏可用于结肠癌诊断和预后判断的特异性生物标志物。因此,探索结肠癌的分子机制,并筛选可靠的预后生物标志物,以准确预测患者的临床结果,指导个性化治疗成为临床研究的热点。
铁死亡被认为是一种铁依赖的调节性细胞死亡形式,在促进肿瘤发展和对抗肿瘤治疗反应中扮演着重要的角色[8]。有研究发现,lncRNA在调控肿瘤细胞的铁死亡过程中发挥了关键作用,如lncRNA可通过调控铁死亡相关蛋白的形成过程参与肿瘤的发生、发展[9]。WU等[10]的研究结果显示,lncRNA APCDC1L-AS可以通过抑制上皮细胞生长因子受体(epidermal growth factor receptor,EGFR)的自噬降解来诱导肺腺癌对埃克替尼(EGFR-酪氨酸激酶抑制剂)的耐药。细胞质中的lncRNA P53RRA影响一些代谢基因的转录,并通过激活P53促进铁中毒[11]。lncRNA P53RRA在增强铁诱导细胞死亡激活剂Erastin诱导生长抑制作用的同时,也增加了细胞内铁和脂质活性氧的浓度,这种机制与肿瘤的铁死亡密切相关。lncRNA LINC00336是铁死亡的关键抑制因子,通过与胚胎致死性异常视觉1(embryonic lethal,abnormal visionlike 1,ELAVL1)蛋白的相互作用降低细胞内铁和脂质活性氧水平,在肺癌中发挥了较好的抗肿瘤作用[12]。以上结果均提示,lncRNA作为铁死亡的关键调节因子在肿瘤治疗中发挥着重要作用。
本研究从TCGA数据库中筛选出72个差异表达的铁死亡相关基因,其中表达上调47个、表达下调25个。GO富集分析和KEGG通路分析结果显示,这些基因广泛参与了铁代谢和脂肪酸代谢等生物学过程。根据Pearson相关分析结果和独立预后分析结果进一步筛选出了20个与结肠癌预后相关的铁死亡lncRNA。通过共识聚类分析将所有结肠癌患者分为2个亚组,采用Kaplan-Meier生存曲线分析不同亚组的生存情况,结果显示,集群2患者的总体生存率明显低于集群1患者的总体生存率(P<0.001)。本研究还根据LASSO-Cox回归分析结果筛选出10个lncRNA,用于构建预后风险模型,并在训练组、验证组和总体结肠癌患者中进行验证,结果显示,在训练组、验证组和总体结肠癌患者中,高风险组的总体生存率均显著低于低风险组(P<0.001)。本研究ROC曲线分析结果显示,在训练组中,预后风险模型判断结肠癌患者1、3和5年生存的AUC分别为0.733、0.790和0.776;在验证组中,预后风险模型判断结肠癌患者1、3和5年生存的AUC分别为0.697、0.726和0.722。这表明本研究构建的铁死亡相关lncRNA预后风险模型可较准确地评估结肠癌患者的预后情况。本研究列线图分析结果显示,通过患者临床特征和风险进行评分,可准确评估患者的总体生存率,对结肠癌患者的临床管理有一定的参考价值。此外,本研究还发现,结肠癌组织中ITGB1-DT相对表达量显著高于癌旁组织(P<0.001);有细胞学实验结果显示,ITGB1-DT可促进结肠癌的增殖,并抑制其铁死亡,从而对肿瘤的进展进行正向调控。
综上所述,本研究成功构建了铁死亡相关lnRNA的预后风险模型,可对结肠癌患者的预后进行准确评估;证实了ITGB1-DT通过促进结肠癌细胞增殖来抑制铁死亡,发挥促癌作用。这将为结肠癌患者的治疗和预后评估提供新的思路。

