酸性普鲁兰酶显著提升淀粉酶法制备葡萄糖的效率
丛慧慧,张亚楠,牛丹丹,赵继华,王正祥
(天津科技大学 化工与材料学院,天津,300457)
淀粉酶法制备葡萄糖是淀粉深加工工业的重要组成,在我国已形成千万吨级规模的大型产业[1-2]。淀粉酶法制备葡萄糖工艺路线一般为:高温α-淀粉酶介导下,通过喷射液化将淀粉分子从内部酶解为低分子质量的糊精和低聚合度的麦芽寡糖,再在葡糖淀粉酶和普鲁兰酶的协同作用下对淀粉液化液进行糖化,最大限度地释放出葡萄糖[3-5]。
现有的研究揭示,所有植物合成和储存的淀粉分子皆含有分支结构,即淀粉分子在通过α-1,4糖苷键连接葡萄糖单体分子形成直链分子的同时,通过α-1,6糖苷键进行分支扩展[6]。因此,淀粉酶法制备葡萄糖(高葡糖浆)时,需要对淀粉液化后分子中的α-1,4糖苷键和α-1,6糖苷键进行高效水解,才能实现高葡糖浆的高效制备。现今,来源于黑曲霉或埃默森篮状菌(Talaromycesemersonii)的葡糖淀粉酶,是目前为止成功实现商业化应用的葡糖淀粉酶酶制剂[7]。两者的催化活性相似,皆为淀粉外切酶,主要通过水解直链淀粉分子及其低聚麦芽糖分子末端的α-1,4糖苷键,形成葡萄糖产物。尽管研究显示葡糖淀粉酶对淀粉分子中α-1,6糖苷键也具有一定水解活性[8],但其活性不足以满足对淀粉制备高葡糖浆的工业要求。因此,专一水解淀粉分支部位α-1,6糖苷键的关键酶制剂普鲁兰酶,则成为淀粉酶法制糖的关键酶制剂[9-12]。此外,在淀粉酶法制葡萄糖的工业生产过程中,酶促反应条件基本上是依据葡糖淀粉酶的最适作用属性而设定,特别是控制酶解过程在较酸性pH值(pH 4.3)条件下进行,以保证在淀粉糊精被充分水解为葡萄糖的同时,降低葡糖淀粉酶的转苷副反应,从而提升淀粉到葡萄糖的转化率和收得率。因此,普鲁兰酶在酸性淀粉糖化条件下的高活性就显得尤为重要[13-14]。
在前期的研究中,我们成功完成了长野芽胞杆菌普鲁兰酶高产菌株的构建与工业生产应用[15]。但在运用此酶进行淀粉高葡糖浆工业化制备中发现,淀粉糖化后糖液中葡萄糖含量即转化率有待进一步提升,可能原因在于此普鲁兰酶的最适作用pH与现有葡糖淀粉酶不一致,需要对其糖化工业应用属性进一步改进或提升。为此,在前期研究的基础上,本研究重点对普鲁兰酶的酸性突变体在高葡糖浆制备中的应用属性和应用价值进行研究,以期对普鲁兰酶酶制剂工业属性的进一步分子化提供指导意义,并推动我国复合葡糖淀粉酶制剂制造和质量的提升。
1 材料与方法
1.1 材料
1.1.1 菌株
产普鲁兰酶酸性突变体LoPulA的地衣芽胞杆菌(Bacilluslicheniformis)BL-LoPulA为本实验室前期构建并保藏,用于普鲁兰酶酸性突变体的制备。
1.1.2 酶与试剂
葡糖淀粉酶商品酶制剂(290 000 U/mL)、普鲁兰酶商品酶制剂(6 000 U/mL),山东隆科特酶制剂有限公司;葡萄糖、麦芽寡糖、异麦芽糖等标准品,江苏锐阳生物科技有限公司;麦芽糊精(DE值:12),美国罗盖特公司;其他试剂均为分析纯。
1.1.3 培养基和相关溶液
LB培养基(g/L):蛋白胨10.0,酵母膏5.0,NaCl 10.0;若配制固体培养基则添加15~20 g/L琼脂粉。
发酵培养基(g/L):乳糖20.0,豆粕粉15.0,棉籽粉10.0,CaCl20.3,(NH4)2SO43.0,K2HPO420.0,KH2PO410.0;pH 7.2。
1.2 实验方法
1.2.1 酸性普鲁兰酶的制备与纯化
按照本实验室常规方法,在含有50 mL发酵培养基的250 mL摇瓶中,通过摇瓶发酵进行[16]。接种量为10%,37 ℃、220 r/min下摇床培养120 h,发酵结束后,8 000 r/min离心10 min收集上清液即为粗酶液,粗酶液用于进一步研究。
粗酶液经过硫酸铵分级沉淀、PD-10脱盐柱脱盐、超滤管(Millipure)超滤,收集的样液进一步通过AKTAprime系统(Cytiva)进行纯化。蛋白浓度的测定采用Bradford法进行[17],以牛血清蛋白(上海生工)为蛋白质质量标准参照。
1.2.2 酶活力测定
葡糖淀粉酶酶活力按照GB 1886.174—2016的方法测定。酶活力定义为:在40 ℃、pH 4.6条件下,1 g酶粉(或1 mL酶液)1 h分解可溶性淀粉产生1 mg葡萄糖,即为一个酶活力单位,以U/g(或U/mL)表示。
普鲁兰酶酶活力按照GB 1886.174—2016的方法测定。酶活力定义为:在60 ℃、pH 4.5条件下,1 g酶粉(或1 mL酶液)1 min分解普鲁兰多糖产生1 μmol葡萄糖,即为一个酶活力单位,以U/g(或U/mL)表示。
1.2.3 温度和pH对酶活力的影响
按照本实验室常规方法进行[16]。适当稀释的酶液分别在不同温度或不同pH下,按照上述酶活力测定方法测定其酶活力,以最高酶活力为100%,计算相对酶活力。
1.2.4 葡萄糖浆的制备
称取30 g麦芽糊精溶于0.2 mol/L Na2HPO4-柠檬酸缓冲液中,搅拌混匀,用缓冲液最终定容到100 mL,配制成300 g/L的麦芽糊精溶液作为底物。反应体系中葡糖淀粉酶的添加量为150 U/g,普鲁兰酶的添加量为1 U/g,即葡糖淀粉酶与普鲁兰酶用酶量质量之比为150∶1。糖化条件:温度控制在61 ℃,pH控制为4.3。在糖化过程中,以一定的时间间隔取样,进行葡萄糖含量测定,并按公式(1)计算葡萄糖当量(dextrose equivalent,DX值):
(1)
1.2.5 糖谱分析
淀粉葡萄糖浆中组分定量分析,采用HPLC法进行[18-19]。色谱条件:色谱柱为Alltech Prevail Carbohydrate Es 5u,流动相为65%(体积分数)的乙腈,流速为1 mL/min,示差检测器为Shodex RI-201H,柱温为35 ℃,进样量为20 μL。以保留时间定性出峰组成,以外标法通过出峰面积(Y=326.91X-22.522,R2=0.999 5)计算糖浆中葡萄糖的含量。葡萄糖、麦芽寡糖和异麦芽糖标准品,用ddH2O配制成10 mg/mL的标准品。
2 结果与讨论
2.1 淀粉糖化用酶的酶学性质分析
2.1.1 pH对淀粉糖化用酶的影响与最适作用pH范围
在60 ℃下,分别测定不同pH下淀粉糖化用酶的酶活力,获得了pH对淀粉糖化用酶酶活力的影响,结果汇总于图1。葡糖淀粉酶的最适作用pH为4.0,并且在pH 4.0~4.5内均能具有90%以上的酶活力;商品普鲁兰酶(PulA)的最适作用pH为4.8~5.0,在pH 4.5、4.3、4.0下的酶活力分别为其最高酶活力的83%、71%和56%。可见,与商品葡糖淀粉酶一起在较低的pH下进行淀粉糖化时,PulA的脱支酶活力无法充分呈现;前期研究获得的PulA酸性突变体LoPulA的最适作用pH为4.5,在pH 4.3和4.0下的酶活力分别为其最高酶活力的96%和85%。可见,LoPulA的最适作用pH范围应该有利于葡糖淀粉酶主导的淀粉糖化。
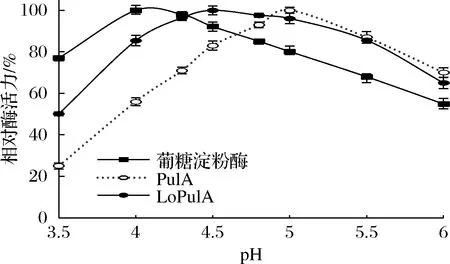
图1 pH对淀粉糖化用酶活力的影响Fig.1 Effect of pH on activities of enzymes for starch saccharification
2.1.2 温度对淀粉糖化用酶的影响与最适作用温度范围
分别在50~75 ℃下测定淀粉糖化用酶的酶活力,结果如图2所示。葡糖淀粉酶的最适作用温度为60 ℃,在65 ℃时保持其最高酶活力的93%左右。PulA的最适温度为58 ℃,但在60和65 ℃下仅具有78%和50%的酶活力,可见,在葡糖淀粉酶最适温度下进行淀粉脱支时,其酶解作用也无法充分发挥。酸性LoPulA的最适作用温度也为60 ℃,但在65 ℃下能保持其最高酶活力的94%以上,其最适作用温度范围与葡糖淀粉酶相似。可见,LoPulA的最适作用温度也十分有利于配合葡糖淀粉酶的淀粉糖化。
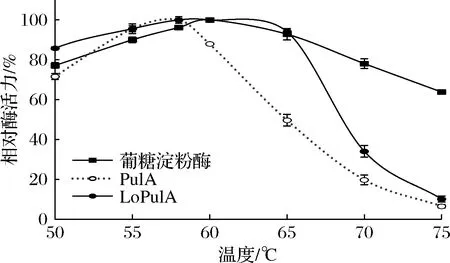
图2 温度对淀粉糖化用酶的影响Fig.2 Effect of temperature on activities of enzymes for starch saccharification
在淀粉酶法制备葡萄糖浆时,葡糖淀粉酶需要与普鲁兰酶复配使用才能获得较高葡萄糖收得率。葡糖淀粉酶的主要作用是水解α-1,4糖苷键生成葡萄糖,普鲁兰酶则水解α-1,6糖苷键生成支链多糖,并进一步为葡糖淀粉酶提供易水解底物[20]。由于葡糖淀粉酶本身具有较弱的转苷活性,在尽可能酸性的条件下进行淀粉糖化可减低葡糖淀粉酶的转苷副作用所形成的异麦芽糖的量,有利于获得更好水平的葡萄糖当量(DX值)。可见,酶学性质与葡糖淀粉酶相似的酸性普鲁兰酶LoPulA,极有可能改善现有商品普鲁兰酶PulA的淀粉到葡萄糖的收得率。
2.2 酸性普鲁兰酶在淀粉制备葡萄糖浆中的作用
以300 g/L麦芽糊精为底物,在61 ℃、pH 4.3下用葡糖淀粉酶和普鲁兰酶酶解72 h,定时取样进行葡萄糖含量测定,并计算DX值,结果汇总于图3。当糖化时间为5 h时,反应体系中添加PulA和LoPulA的DX值已经达到了70%以上;继续糖化到12 h时,淀粉糖化液的DX值分别达到了89.82%和91.37%;糖化24 h后,淀粉糖化液的DX值达到最大值,分别为95.26%和96.66%,采用酸性普鲁兰酶可以将淀粉到葡萄糖的转化率提高了1.4%。葡萄糖浆中葡萄糖的含量是评价淀粉糖化的核心指标,不仅决定了高葡糖浆的质量和产品收得率,也是葡萄糖后续纯化和精制的主要成本构成。因此,淀粉糖工业常常将葡萄糖液的DX值是否高于96%,作为界定淀粉糖化和高葡糖浆制备质量以及评价复合葡糖淀粉酶质量的主要依据。可见,运用普鲁兰酶酸性突变体,明显有利于葡糖淀粉酶的淀粉糖化和葡萄糖的释放,对后续以本研究的酸性普鲁兰酶与现有葡糖淀粉酶间组成高效复合葡糖淀粉酶,也具有重要应用价值。

图3 酸性普鲁兰酶LoPulA对淀粉制葡萄糖的作用Fig.3 Effect of acidic pullulanase LoPulA on starch saccharification
在淀粉糖化过程中,由于葡糖淀粉酶的转苷副反应,会将已经形成的葡萄糖转为异麦芽糖等[21-22]。从图3也可以明显看出,当糖化接近完成后,葡萄糖浆的DX值呈现缓慢下降的变化。为此,进一步对淀粉制备葡萄糖过程中形成的糖谱组成进行分析,结果如图4和表1所示。在淀粉糖化液DX值达到最大值时(本试验条件下为淀粉糖化24 h时),糖液中仍含有微量麦芽糖和极微量的麦芽三糖。随着糖化时间的进一步延长,糖液中的麦芽糖和麦芽三糖被进一步水解直至全部被水解;但与此同时,异麦芽糖缓慢形成并随糖化时间的延长并逐渐增加。
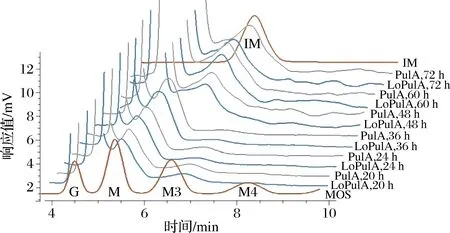
G-葡萄糖;M-麦芽糖;M3-麦芽三糖; M4-麦芽四糖;IM-异麦芽糖图4 淀粉糖化后期形成异麦芽糖Fig.4 Isomaltose formation in the late saccharification
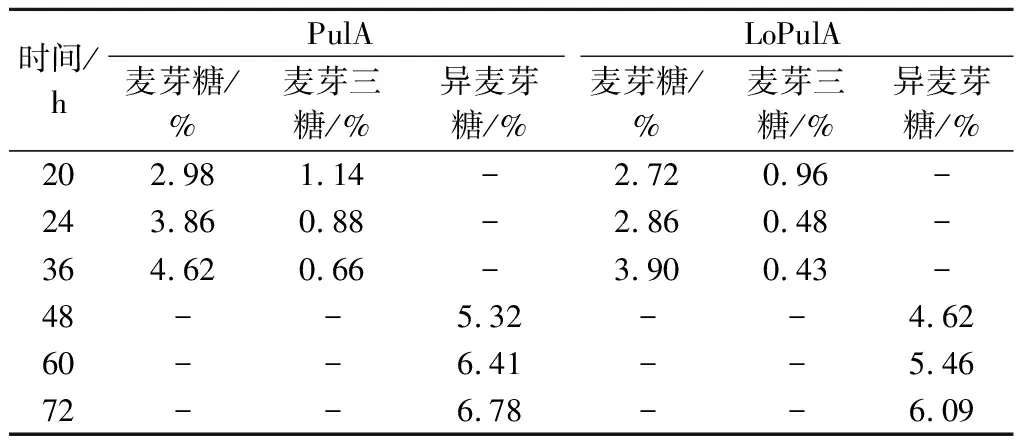
表1 淀粉制备葡萄糖过程中其他糖份组成与含量Table 1 The type and contents of other sugars existed during starch saccharification
早期研究已经确定葡糖淀粉酶由于存在较弱的转葡萄糖苷活性,其在淀粉糖化后期会催化生成异麦芽糖并在糖液中积累,影响高葡糖浆的质量。此外,异麦芽糖不为绝大多数工业发酵菌种所代谢,会在发酵培养基中积累为不可发酵的“残糖”[23-24]。可见,运用复合葡糖淀粉酶的淀粉糖化,有效控制糖化终点对高质量高葡糖浆的制备是有意义的。此外,酸性普鲁兰酶的研制成功,可保证葡糖淀粉酶在淀粉糖化时处于其最适作用条件下进行。此外,随着高质量普鲁兰酶的低成本生产完成,进一步降低复合葡糖淀粉酶中葡糖淀粉酶的添加量可以实现,后续将对此进行进一步研究。
3 结论
本研究对普鲁兰酶酸性突变体LoPulA在葡糖淀粉酶淀粉糖化制备葡萄糖的作用与应用价值进行了分析。LoPulA具有与现有葡糖淀粉酶商品酶制剂相似的酶学性质,可与葡糖淀粉酶一起高效水解淀粉为葡萄糖,最高葡萄糖收得率可以达到96.66%,有利于我国高效复合葡糖淀粉酶制剂的研发,并推动其在淀粉糖工业中的高效应用和淀粉制糖技术进步。

