多异瓢虫气味结合蛋白HvarOBP2的基因克隆及配体结合特性分析
唐浩宇, 刘靖涛, 谢佼昕, 羿超群,3, 刘晓旭,3, 张永军,*, 孙 洋
(1. 安徽师范大学生命科学学院, 重要生物资源保护与利用研究安徽省重点实验室, 分子酶学与重大疾病机理研究安徽省重点实验室,安徽芜湖 241000; 2. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室,北京 100193;3. 河北农业大学植物保护学院, 河北保定 071000)
昆虫嗅觉系统主要由中枢嗅觉系统和外周嗅觉系统两部分组成(Ong and Stopfer, 2012),在昆虫识别外界信号过程中,气味结合蛋白(odorant-binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、气味受体(odorant receptors, ORs)、离子型受体(ionotropic receptors, IRs)、味觉受体(gustatory receptor, GRs)以及昆虫感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)等嗅觉相关蛋白发挥着至关重要的作用(Clyneetal., 1999; Coutoetal., 2005; Bentonetal., 2009; Leal, 2013; Joseph and Carlson, 2015; Zhangetal., 2016; Wangetal., 2017)。
1981年,第一个昆虫OBPs在多音天蚕蛾Antheraeapolyphemus触角中被鉴定,此后发现OBPs广泛存在于其他不同的昆虫种中(Vogt and Riddiford, 1981)。 OBPs是一类水溶性酸性蛋白,全长约120~160个氨基酸,相对分子量较小,一般为15~20 kD, 序列中有6个保守的半胱氨酸位点(Pelosi and Maida, 1995)。OBPs的主要功能是特异性识别并结合外界环境中的气味分子,运输脂溶性的气味分子穿过水溶性的感受器淋巴液到达嗅觉神经元树突膜上的受体,引发后续的感受行为(Fanetal., 2011)。目前已经从鞘翅目瓢甲科的七星瓢虫Coccinellaseptempunctata(杨雪娇等, 2020)、异色瓢虫Harmoniaaxyridis(韩世鹏等, 2019)、孟氏隐唇瓢虫Cryptolaemusmontrouzieri(潘畅等, 2016)等鉴定了大量OBPs。研究发现,孟氏隐唇瓢虫的CmonOBP2(潘畅等, 2016)、异色瓢虫的HaxyOBP2(Quetal., 2021)以及铜绿丽金龟Anomalacorpulenta的AcorOBP2(Chenetal., 2019)均在头部或触角中高表达。体外竞争结合实验数据表明,大黑鳃金龟Holotrichiaoblita的HoblOBP2重组蛋白与α-紫罗兰酮、β-紫罗兰酮、苯甲酸乙酯以及月桂烯等植物挥发物组分有较强的结合能力(Dengetal., 2011)。
多异瓢虫Hippodamiavariegata属鞘翅目(Coleoptera) 瓢甲科(Coccinellidae),是北方农田中优势捕食性天敌昆虫。田间的多异瓢虫通过其敏锐的嗅觉系统,追踪植物和植食性害虫释放的挥发物信号来准确定位多种猎物,在这一过程中多异瓢虫气味结合蛋白等相关化学感受蛋白发挥了重要作用。近年来,有关多异瓢虫的研究多集中在生物学特性 (姜岩等, 2022)、杀虫剂毒性研究以及捕食功能反应(Maryametal., 2020)等方面,而多异瓢虫的嗅觉相关蛋白的功能研究鲜有报道。
本研究团队前期通过成虫触角转录组测序和生物信息学分析,从多异瓢虫鉴定出包括HvarOBP2在内的12个OBP基因,并陆续开展功能研究。组织表达谱分析发现HvarOBP2在雌雄成虫触角中特异性高表达(未发表数据),推测其可能具有重要的化学感受功能。本研究围绕HvarOBP2的配体结合特性进行研究,克隆了HvarOBP2开放阅读框(open reading frame, ORF),原核表达并纯化后得到了重组HvarOBP2蛋白,通过荧光竞争结合实验研究了重组HvarOBP2蛋白与40种候选植物挥发物组分以及24种蚜虫相关挥发物组分的结合能力,解析其配体结合特征,以期阐明多异瓢虫气味结合蛋白的化学感受功能,为天敌昆虫保护利用提供理论依据。
1 材料与方法
1.1 供试昆虫及组织收集
多异瓢虫成虫采自新疆库尔勒地区,在中国农业科学院植物保护研究所廊坊科研中试基地建立室内种群,饲养条件为温度24±1℃,相对湿度60%±10%,光周期16L∶8D,以桃蚜Myzuspersicae饲喂并维持种群。收集羽化2-5 d的多异瓢虫雌雄成虫(各200头)触角,放入无RNA酶的1.5 mL离心管中,液氮迅速处理后置于-80℃中保存备用。
1.2 HvarOBP2基因的鉴定和序列分析
利用Illumina HiSeq 2500技术平台对5日龄多异瓢虫成虫触角进行转录组测序,共3次生物学重复,每重复准备雌、雄成虫触角各300对。根据转录组数据建立本地数据库,并在GenBank中下载其他鞘翅目昆虫的OBPs核酸序列作为“query”,利用软件TBtools 1.098685中 BLASTN程序确定多异瓢虫的候选OBPs基因,所有候选OBPs再通过NCBI网站上的BLASTX程序进行验证(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)(Wangetal., 2020),使用Expasy(https:∥web.expasy.org/compute_pi/)(苏旭等, 2019)预测蛋白分子量及等电点,使用SignalP-5.0 Server(http:∥www.cbs.dtu.dk/services/SignalP/)预测信号肽(Bendtsenetal., 2004)。
1.3 总RNA提取及cDNA合成
用匀浆器在液氮中研磨收集好的多异瓢虫触角,采用Trizol试剂提取总RNA,通过1.2%琼脂糖凝胶电泳和IMPLEN超微量分光光度计NanoPhotometer N60检测总RNA的质量和浓度。以提取的总RNA为模板,采用FastKing一步法反转录合成cDNA第1链。
1.4 HvarOBP2开放阅读框扩增
根据HvarOBP2序列设计特异性引物(正向引物: 5′-ATGTTCAAATTTTTATTTTTGGTTTCTTG-3′; 反向引物: 5′-TCAATGGATAAAAGCTGCATTCAA-3′),以1.3节合成的cDNA第1链为模板,扩增其ORF。PCR反应体系: 2×Phanta Max Master Mix 25 μL, 正反向引物(10 μmol/L)各2 μL, ddH2O 17 μL, cDNA模板4 μL。PCR扩增程序: 94℃预变性3 min; 94℃变性30 s, 56℃退火30 s, 72℃延伸30 s, 35个循环;最后72℃延伸10 min。用1.2%琼脂糖凝胶电泳检测扩增产物,通过Axygen胶回收试剂盒(康宁公司)回收PCR产物,然后连接至pCloneEZ-NRS-BluntAmp/HC(中美泰和公司)克隆载体上,转化入TreliefTM5α(擎科生物公司)感受态细胞,测序获得序列正确的质粒。然后用信号肽预测程序SignalP-5.0 Server去除HvarOBP2基因的信号肽序列,设计特异性引物(正向引物: 5′-CACCGTGAGCGAACAATGGA-3′; 反向引物: 5′-TCAATGGATAAAAGCTGCATTCAA-3′),以序列正确的质粒为模板采用上述同样PCR程序扩增其编码区CDS。最后将PCR产物连接到pBM30(博迈德公司)表达载体,转化至TreliefTM5α感受态细胞,测序验证获得序列正确质粒。
1.5 HvarOBP2重组蛋白表达与纯化
将pBM30/HvarOBP2重组质粒转化入蛋白表达宿主细胞BL21(DE3)中,挑取单克隆菌株于含有30 mg/mL卡那霉素的LB培养基中,置于摇床37℃ 220 r/min震荡培养3~4 h。当大肠杆菌Escherichiacoli细胞数达到对数生长期(OD值0.6~0.8)时,加入异丙基硫代半乳糖苷(IPTG),使其终浓度为1 mmol/L,加入质量浓度10%的葡萄糖溶液使其终浓度为1%。于37℃ 200 r/min摇床中诱导8 h。超声波破碎菌体,分别收集上清和沉淀,经20% SDS-PAGE电泳检测,发现目的蛋白以包涵体的形式存在于沉淀中。采用氧化还原法(Prestwich, 1993)进行包涵体的复性和重折叠,然后用通过亲和层析、超滤以及透析等步骤进行纯化(Guetal., 2013),获得目的HvarOBP2重组蛋白。
1.6 荧光竞争结合实验
以40种植物挥发物组分和24种蚜虫相关挥发物组分作为候选配体 (表1),在F-380型荧光分光光度计上检测HvarOBP2重组蛋白与荧光探针及配体的结合能力。荧光探针N-苯基-1-萘胺(N-phenyl-1-naphthylamine, 1-NPN)溶于HPLC级的甲醇中,所用容器为石英荧光比色皿。仪器激发波长设置337 nm,扫描发射波长范围380~500 nm。在10 mmol/L的PBS缓冲液中加入HvarOBP2重组蛋白,使其终浓度为2 μmol/L,随后加入荧光探针1-NPN,使终浓度由2 μmol/L递增至20 μmol/L,记录荧光值最大读数,3次重复,计算HvarOBP2重组蛋白与1-NPN的解离常数(Ki)。
在荧光石英比色皿中加入PBS缓冲液,分别加入HvarOBP2重组蛋白与荧光探针1-NPN,使其终浓度均为2 μmol/L,等待约30 s,待荧光强度稳定后,记录最大荧光强度,然后将溶于甲醇的气味配体逐次加入到比色皿中,浓度由2 μmol/L递增至 32 μmol/L,记录荧光强度变化情况,3次重复。利用Scatchard方程计算HvarOBP2重组蛋白与气味配体的Ki。计算公式为:Ki=[IC50]/(1+[1-NPN]/K1-NPN),其中[1-NPN]为未结合的1-NPN浓度,K1-NPN代表HvarOBP2与探针的Ki(Guetal., 2011)。
1.7 HvarOBP2三维结构模拟及分子对接
将HvarOBP2氨基酸序列以FASTA格式输入到三维模型预测工具trRosetta (https:∥yanglab.nankai.edu.cn/trRosetta/),在蛋白质数据库(PDB)中筛选适当的模板。然后用软件AutoDock Vina 1.1.2解析HvarOBP2与配体(β-紫罗兰酮、邻苯二甲酸二丁酯、油酸和橙花叔醇)的结合方式,最后使用PyMOL1.9.0 (http:∥ www.pymol.org/)进行分子对接模拟。
2 结果
2.1 HvarOBP2基因的克隆及序列特征
扩增获得多异瓢虫HvarOBP2(GenBank登录号: OK340816)的开放阅读框,长约447 bp,与预期结果一致,编码148个氨基酸残基,N端有17个氨基酸组成的信号肽,预测成熟蛋白分子量为14.56 kD,等电点为5.48,具有6个保守的半胱氨酸位点(图1),符合公式C1-X20-66-C2-X3-C3-X21-43-C4-X8-14-C5-X8-C6,属于classical OBPs亚家族。

图1 多异瓢虫HvarOBP2与其他鞘翅目昆虫OBPs序列多重比对
2.2 HvarOBP2的重组表达
SDS-PAGE电泳检测结果表明,HvarOBP2重组蛋白主要以包涵体形式表达,纯化后的蛋白分子量约14.5 kD,与预测结果一致(图2)。
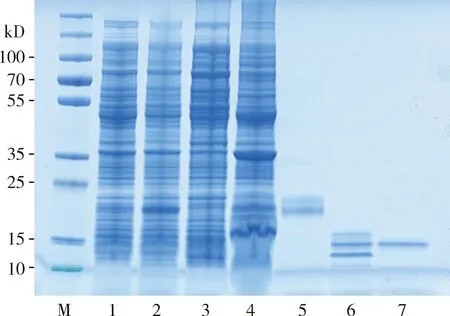
图2 HvarOBP2重组蛋白SDS-PAGE分析
2.3 HvarOBP2气味配体结合特征
重组蛋白HvarOBP2与荧光探针1-NPN的结合曲线及Scatchard方程(图3: A)显示两者具有结合能力且具有饱和效应,(Ki值)为 5.23±0.54 μmol/L。HvarOBP2与植物挥发物组分油酸(Ki=1.68±0.04 μmol/L)、邻苯二甲酸二丁酯(Ki=8.77±0.19 μmol/L)、橙花叔醇(Ki=15.93±0.33 μmol/L)和β-紫罗兰酮(Ki=10.79±0.24 μmol/L)的结合能力较强,与其他候选的蚜虫相关挥发物组分及植物挥发物组分的IC50值均大于50 μmol/L(图3: B; 表1),判定为不结合。

图3 HvarOBP2重组蛋白与1-NPN(A)和候选配体(B)的结合曲线
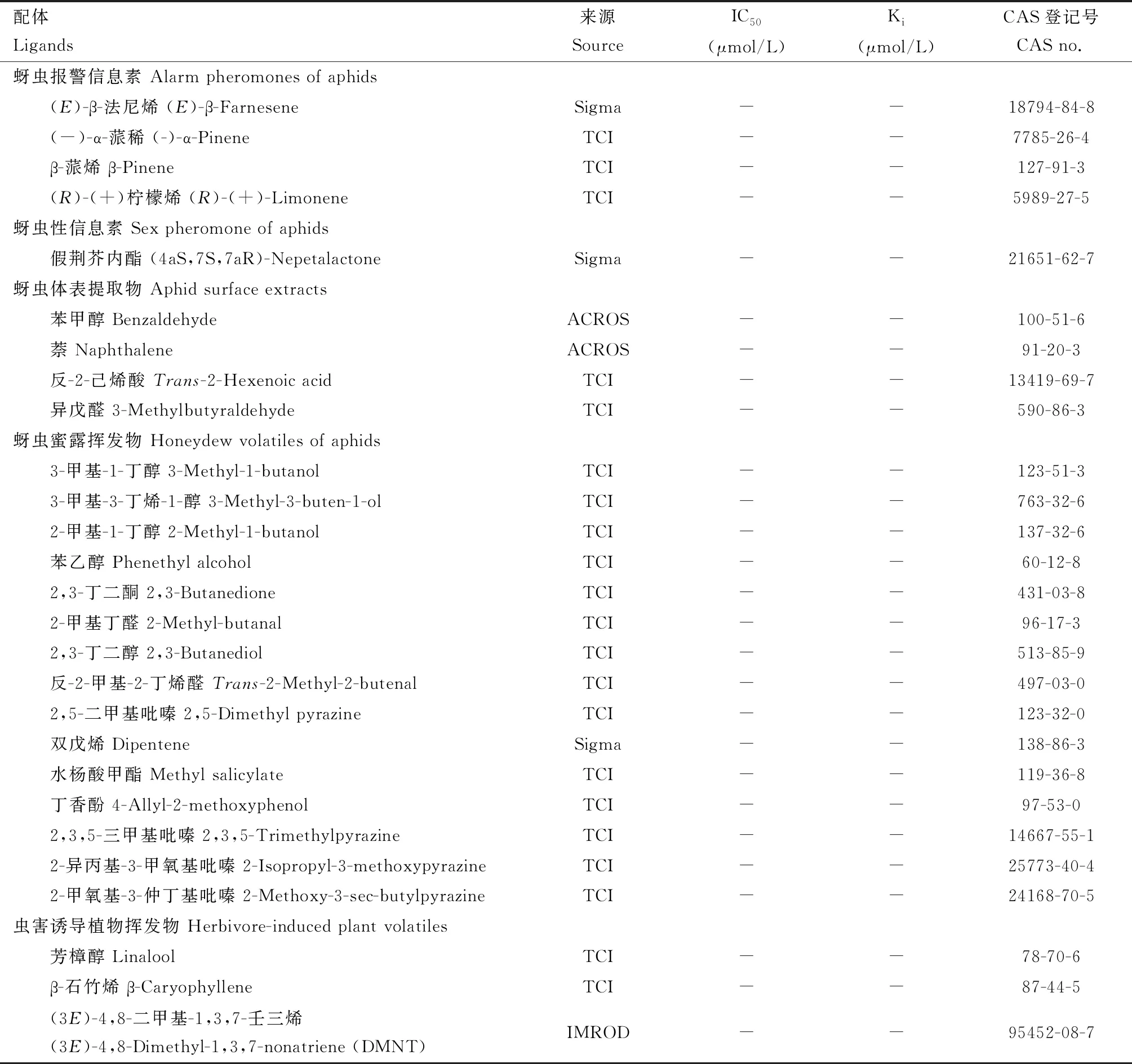
表1 不同配体对重组蛋白HvarOBP2重组蛋白的IC50值和解离常数(Ki值)

续表1 Table 1 continued
2.4 HvarOBP2三维结构预测及分子对接
从蛋白三维模型预测工具trRosetta推荐的模板中选择家蚕信息素结合蛋白(PDB ID:1DQE)为HvarOBP2最合适的模板,TM-score为0.831,并使用蛋白结构验证服务器SAVES v6.0(https:∥saves.mbi.ucla.edu/)评价HvarOBP2模型的质量,结果表明有85.81%的氨基酸残基3D-1D得分大于等于0.2,表明该模型可被使用。预测的HvarOBP2模型由7个α-螺旋组成,分别位于Phe2-Ala17(α1), Glu20-Val41(α2), Glu45-Gly53(α3), His60-Leu73(α4), Lys84-Ala96(α5), Pro99-Ala117(α6), Lys122-Met140(α7)残基之间。
选择β-紫罗兰酮、邻苯二甲酸二丁酯、油酸以及橙花叔醇与预测的蛋白模板进行分子对接模拟(图4),结果显示这些化合物能够结合在HvarOBP2的疏水空腔内并靠近大量疏水残基。预测HvarOBP2重组蛋白与β-紫罗兰酮、邻苯二甲酸二丁酯、油酸、橙花叔醇的结合能分别为-8.1, -7.6, -7.2和-7.6 kcal/mol。HvarOBP2与不同配体对接过程中的关键结合氨基酸残基均为疏水性残基(表2),其中Phe12和Phe118是与多个配体结合的氨基酸残基,表明这两个残基在HvarOBP2和配体的结合过程中发挥重要作用。
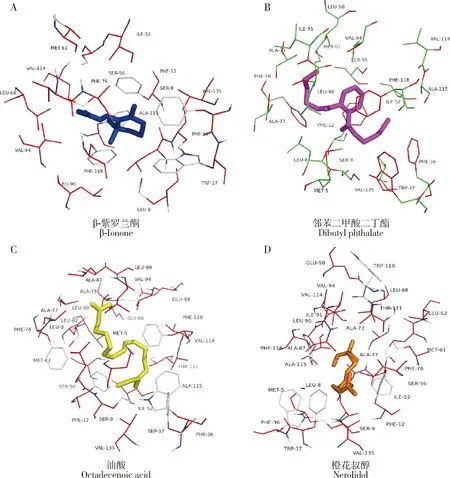
图4 利用PyMOL1.9.0进行的重组蛋白HvarOBP2与配体的分子对接模拟

表2 重组蛋白HvarOBP2对配体的关键氨基酸残基的预测
3 讨论
昆虫气味结合蛋白在与气味分子的结合及传递过程中发挥重要作用,调控了昆虫对化学信号的响应,因此,功能性OBPs可作为筛选昆虫引诱剂或驱避剂的作用靶标(张雪等, 2021)。本研究发现多异瓢虫HvarOBP2重组蛋白与β-紫罗兰酮、邻苯二甲酸二丁酯、油酸和橙花叔醇均具有较强的结合能力(图3: A; 表1)。
β-紫罗兰酮是植物体内类胡萝卜素底物氧化裂解产生的一种挥发性物质,天然存在于番茄、棉花、甘蓝、油菜等植物中(Gruberetal., 2009)。已有大量研究报道昆虫气味结合蛋白OBPs与β-紫罗兰酮具有较强的结合能力。例如,苜蓿盲蝽Adelphocorislineolatus的OBP5与β-紫罗兰酮有很强的结合 (朱晓强等, 2015);甜菜夜蛾Spodopteraexigua的OBP1和OBP7与β-紫罗兰酮也有不同程度的结合能力(Liuetal., 2017)。淡足侧沟茧蜂Microplitispallidips的OBP8能够与β-紫罗兰酮强烈结合,随后的Y型嗅觉仪及田间试验证明β-紫罗兰酮能够吸引淡足侧沟茧蜂(Zhangetal., 2022)。本研究发现多异瓢虫HvarOBP2重组蛋白与β-紫罗兰酮有较强的结合能力,Ki值为10.79±0.24 μmol/L(表1),这一结果与秀丽金龟甲Hylamorphaelegans和中华蜜蜂Apisceranacerana的OBPs与β-紫罗兰酮有较高结合力的结论 (Venthuretal., 2016; 吴帆等, 2016)是相似的。β-紫罗兰酮在植物与昆虫化学通讯的相互作用过程中发挥了重要作用。
邻苯二甲酸二丁酯是桃Prunuspersica、梨Pyrusspp.及黑杨Populusnigra等植物叶片中的挥发性物质(凌娜等, 2014; 李中珊, 2019),先前的研究发现小地老虎Agrotisipsilon的AipCSP8及AipGOBP1和AipGOBP2均能够与邻苯二甲酸二丁酯有不同程度的结合能力(Huangetal., 2018; 苏旭等, 2019)。本研究也发现HvarOBP2重组蛋白与邻苯二甲酸二丁酯的结合能力较强,Ki值为 8.77±0.19 μmol/L(表1)。橙花叔醇与油酸分别属于植物花香化合物与植物挥发物,其对HvarOBP2重组蛋白均有较强的结合能力,Ki值分别为15.93±0.33和1.68±0.04 μmol/L(表1)。
综上,多异瓢虫能够通过HvarOBP2感受植物挥发物组分β-紫罗兰酮、邻苯二甲酸二丁酯、橙花叔醇与油酸等来定位寄主植物和蚜虫栖息地。后续的研究中我们将进一步利用RNAi或基因编辑手段明确HvarOBP体内调控功能,获得与HvarOBP强结合的β-紫罗兰酮、邻苯二甲酸二丁酯、油酸、橙花叔醇等植物挥发物组分可以用来设计引诱组合增强多异瓢虫猎物搜寻和定位的能力。

