Keratin 5-IRES-eGFP敲入的人胚胎干细胞系的构建
郑雯, 钟亚丹, 王炫, 刘慧婷, 杨斌, 刘军
1.南方医科大学皮肤病医院,广东 广州 510091;2.佛山市第一人民医院,广东 佛山 528010
人胚胎干细胞(human embryonic stem cell,hESCs)是早期胚胎或原始性腺中分离出来的一类细胞,具有体外培养无限增殖、自我更新和多向分化的特性,能被诱导分化成机体内几乎所有的细胞类型[1-2]。基底层角质形成细胞(basal keratinocyte)位于表皮最底层细胞,可通过不断自我更新,分化为角质层的无细胞核鳞状细胞,维持表皮的屏障作用[3-4]。目前认为,基底层角质形成细胞属于表皮干细胞的一类,具有增殖与分化的潜能,对维持表皮的稳态具有重要作用[5]。基底层角质形成细胞表达角蛋白14(keratin 14,K14)和角蛋白5(keratin 5,K5),对维持细胞骨架结构的稳定发挥重要的作用,K5和K14均可作为基底层角质形成细胞的标志物[6-8]。但现有的技术方法难以将基底层角质形成细胞分离培养,且尚无利用标志物成功分离培养基底层角质形成细胞技术的相关报道,其研究和应用都受到限制。
CRISPR/Cas系统是在原核生物中存在的一种天然免疫系统。原核生物在遭到病毒入侵后,能够把病毒DNA的一小段序列提取并存储到自身基因组上的特定区域。当病毒再次入侵时,原核生物能够根据存储的DNA片段对病毒进行识别,对病毒的基因组DNA进行切割,进而消灭病毒[9-10]。根据CRISPR/Cas系统的生物学特性优化的CRISPR/Cas9技术可实现对基因组的精确编辑,针对目的基因实现点突变、基因敲除或敲入等操作,具有高效、便捷、低脱靶的优点[11-13]。因此,本研究利用CRISPR/Cas9技术构建一种keratin 5-IRES-eGFP 敲入的hESCs细胞系,并诱导hESCs分化为角质形成细胞,实现对keratin 5阳性的基底层角质形成细胞的标记,为后续分选获得keratin 5阳性的基底层角质形成细胞等研究打下基础。
1 材料与方法
1.1 质粒、菌株及细胞株
CRISPR/Cas9质粒 pSpCas9n(BB)-2A-GFP(PX461)购自Addgene公司,HEK-293T及hESCs细胞由本实验室保存。感受态菌购自北京全式金公司。质粒图谱可于http://www.addgene.org网站查询。
1.2 实验试剂
DNA连接酶(T4 DNA ligase、10×T4 Ligation Buffer)购自NEB公司;质粒保护的核酸外切酶(Plasmid Safe exonuclease、10×Plasmid Safe Buffer)购自 Epicentre公司;胶回收试剂盒QIAquick Gel Extraction Kit、质粒小提试剂盒QIAGEN Plasmid Mini Kit、PCR纯化试剂盒QIAquick PCR Purification Kit购自 QIAGEN公司;Lipo2000转染试剂购自Invitrogen公司;快速限制性内切酶(Fast Digest Bbs I、FastAP、10× TM Fast Digest Buffer)、基因组DNA纯化试剂盒(Gene JET Genomic DNA Purification Kit)。
1.3 实验方法
1.3.1 sgRNA质粒与打靶Donor载体的构建 UCSC Genome Browser网站(http://genome.ucsc.edu/)中检索人源keratin 5的基因序列,找出终止密码子,参考张锋实验室团队的sgRNA预测网站(http: ∥crispr.mit.edu/),针对目的基因keratin 5终止密码子下游设计并合成相应的sgRNA序列,将sgRNA连入pU6-EFsgRNA2.1scaffold载体(本实验室保存),筛选出正确的克隆,得到sgRNA质粒。针对目的基因keratin 5断裂位点设计上游同源臂keratin 5 Arm 1及下游同源臂keratin 5 Arm 2,将线性的Donor质粒载体与keratin 5 Arm 1及keratin 5 Arm 2连接,再将本实验室保存的IRES-eGFP连至带有同源臂的Donor质粒中,得到打靶Donor载体。
针对目的基因keratin 5终止密码子下游设计并合成相应的sgRNA序列,将sgRNA连入pU6-EFsgRNA2.1scaffold载体(本实验室保存),筛选出正确的克隆,得到sgRNA质粒。针对目的基因keratin 5断裂位点设计上游同源臂keratin 5 Arm 1及下游同源臂keratin 5 Arm 2,将线性的Donor质粒载体与keratin 5 Arm 1及keratin 5 Arm 2连接,再将本实验室保存的IRES-eGFP连至带有同源臂的Donor质粒中,得到打靶Donor载体。
1.3.2 293T细胞培养、转染及基因组DNA的提取 以每孔5×105个细胞接种至6孔板中,使用DMEM培养基(含10%胎牛血清)进行培养。细胞生长达到30%~40%时加入PEI转染试剂与上述构建的sgRNA质粒,并设置一个无转染sgRNA质粒的293T细胞作为阴性对照。细胞转染后48 h收取HEK293T细胞,用血液/细胞/组织基因组DNA提取试剂盒按照说明书操作步骤提取细胞基因组DNA。
1.3.3 sgRNA切割效率检测 针对sgRNA切割点上下游100~200 bp处设计PCR引物,进行PCR扩增,反应条件为:96 ℃ 30 s;94 ℃,5 s,60 ℃,30 s,72 ℃,10 s,40个循环;72 ℃ 10 min,16 ℃放置。配置10%的聚丙烯酰胺凝胶(polyacrylamide gel electrophoresis,PAGE),具体配方为:3%聚丙烯酰胺 3 mL;1%AP 55 μL;10×TAE 750 μL;TEMED 5 μL;水 3.69 mL。进行聚丙烯酰胺凝胶电泳,内外槽加入1×TAE,电泳条件为12 mA,120 min;1×gelred液体浸泡凝胶5 min,自来水浸泡2 min后凝胶成像仪显影。
1.3.4 电转方法 将sgRNA质粒,cas9质粒(购自Addgene,编号:#44719),打靶Donor载体共同电转至hESCs细胞,其中sgRNA、cas9质粒、打靶Donor载体电转的数量比例为1∶4∶10。所用电转仪为ECM 830型细胞电转仪,电转条件为300 mA,4 ms。
1.3.5 筛选keratin 5-IRES-eGFP敲入的hESCs细胞系 电转后继续培养细胞,待细胞系稳定,用1 μg/mL的嘌呤霉素筛选2 d,通过有限稀释法将80个左右的克隆铺于96孔板中,培养半个月后,挑取单克隆细胞至24孔板进行培养,收取细胞提取基因组DNA,随后进行PCR测序初步筛出阳性单克隆细胞。将初步鉴定为阳性单克隆细胞培养至稳定后,通过电转法转入本实验室保存的pCMV-cre的质粒,待细胞系稳定后,通过有限稀释法将80个左右的克隆铺于96孔板中,培养半个月后,将挑取的单克隆细胞至24孔板进行培养后,收取细胞提取基因组DNA,随后进行PCR测序以及Sanger测序,筛出阳性克隆。
1.3.6 将hESCs诱导分化成为角质形成细胞 在分化前3 d,将筛选的keratin 5-IRES-eGFP细胞系铺在Matrigel包被的6孔板中培养,其中加入的培养液为ES培养基。在第0天时,将hESCs细胞移至Ⅰ型胶原蛋白包被的12孔板上培养,用含有1 μM RA和25 ng/mL BMP4的DMEM/F12的培养基维持培养;第8~15天用含有1 μM RA和25 ng/mL BMP4的KSFM培养基培养;第15天后,采用含25 ng/mL BMP4的KSFM的培养基,持续培养至第30天后检测。
2 结果
2.1 成功构建sgRNA质粒
将sgRNA连入pU6-EFsgRNA2.1scaffold载体后挑取单克隆,通过Sanger测序验证,筛选出正确克隆,得到sgRNA质粒(图1A)。sgRNA质粒制备完成后转染293T细胞,通过DNA-PAGE凝胶电泳验证,选取切割效率最高的sgRNA进行后续实验。
2.2 成功构建打靶Donor质粒
为获取针对keratin 5目的基因的打靶Donor载体,通过PCR扩增获得携带酶切位点的上、下游同源臂keratin 5 Arm 1和keratin 5 Arm 2。首先将上、下游同源臂克隆至线性化Donor载体中,再将IRES-eGFP连至带有同源臂的Donor质粒中并通过Sanger测序验证(图1B)。筛选出正确的打靶Donor载体,将其命名为keratin 5-IRES-eGFP-LoxP-neo(图1C)。
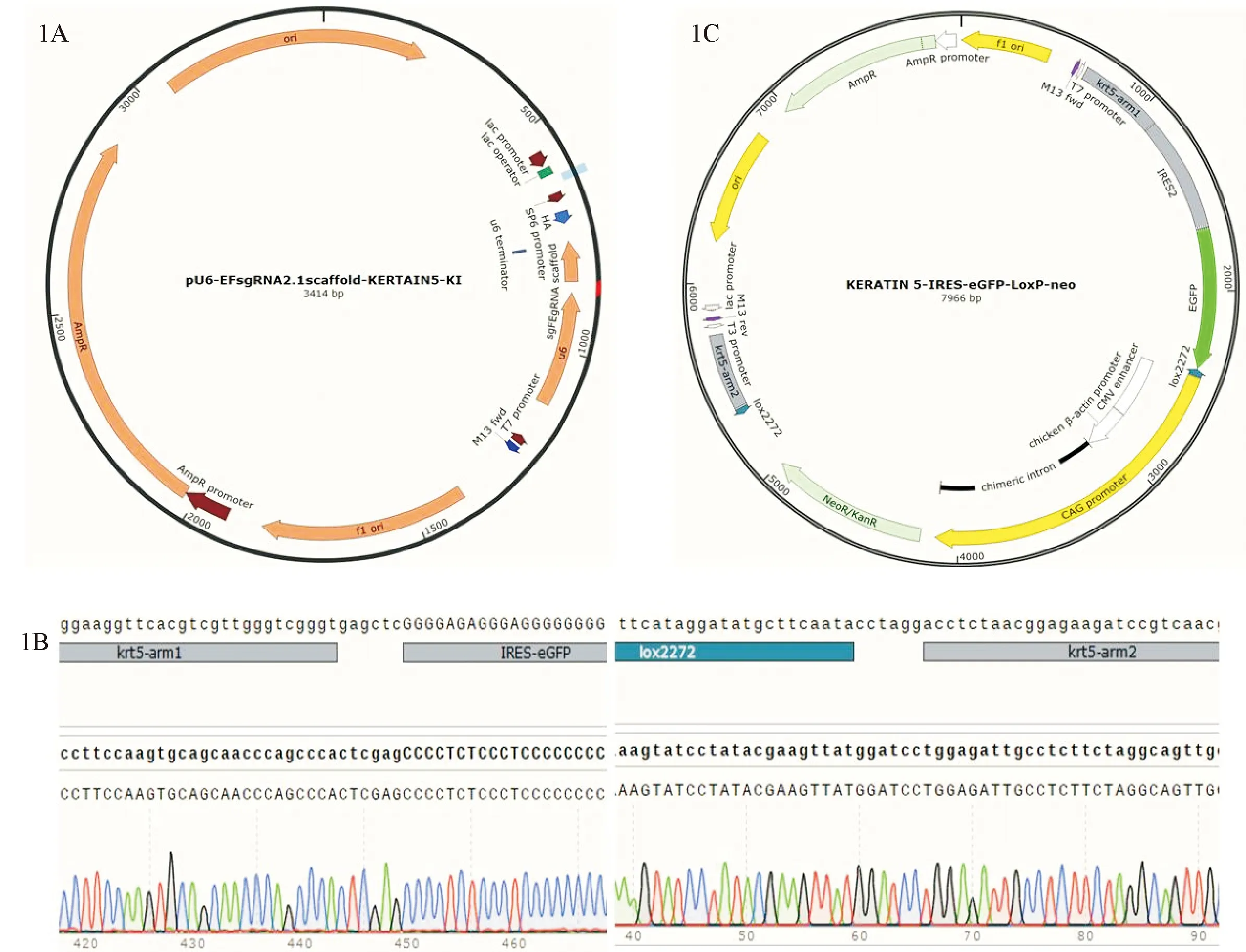
图1 sgRNA质粒图谱(1A)、打靶Donor载体keratin 5-IRES-eGFP-LoxP-neo的测序结果(1B)及其图谱(1C)
2.3 成功挑选keratin 5-IRES-eGFP敲入的单克隆hESCs细胞株
PCR鉴定电泳结果显示单克隆细胞系keratin 5-IRES-eGFP#3为纯合敲入的hESCs细胞系,表明成功将IRES-eGFP-lox2272-CAG-NeoR-lox2272片段整合至keratin 5的两条等位基因终止密码子之后(图2A)。获得初步筛选的阳性细胞克隆keratin 5-IRES-eGFP#3后电转表达Cre蛋白的质粒pCMV-cre,删除细胞克隆中除IRES-eGFP以外其它多余的Donor质粒元件。再次挑取单克隆进行PCR鉴定,通过Cre-band条带初步鉴定出删除了多余的质粒元件的细胞克隆(图2B),将其命名为keratin 5-IRES-eGFP#3-16。对PCR产物进行Sanger测序,与打靶Donor载体进行序列对比,可证实该细胞克隆中其它多余元件确已成功删除(图2C)。
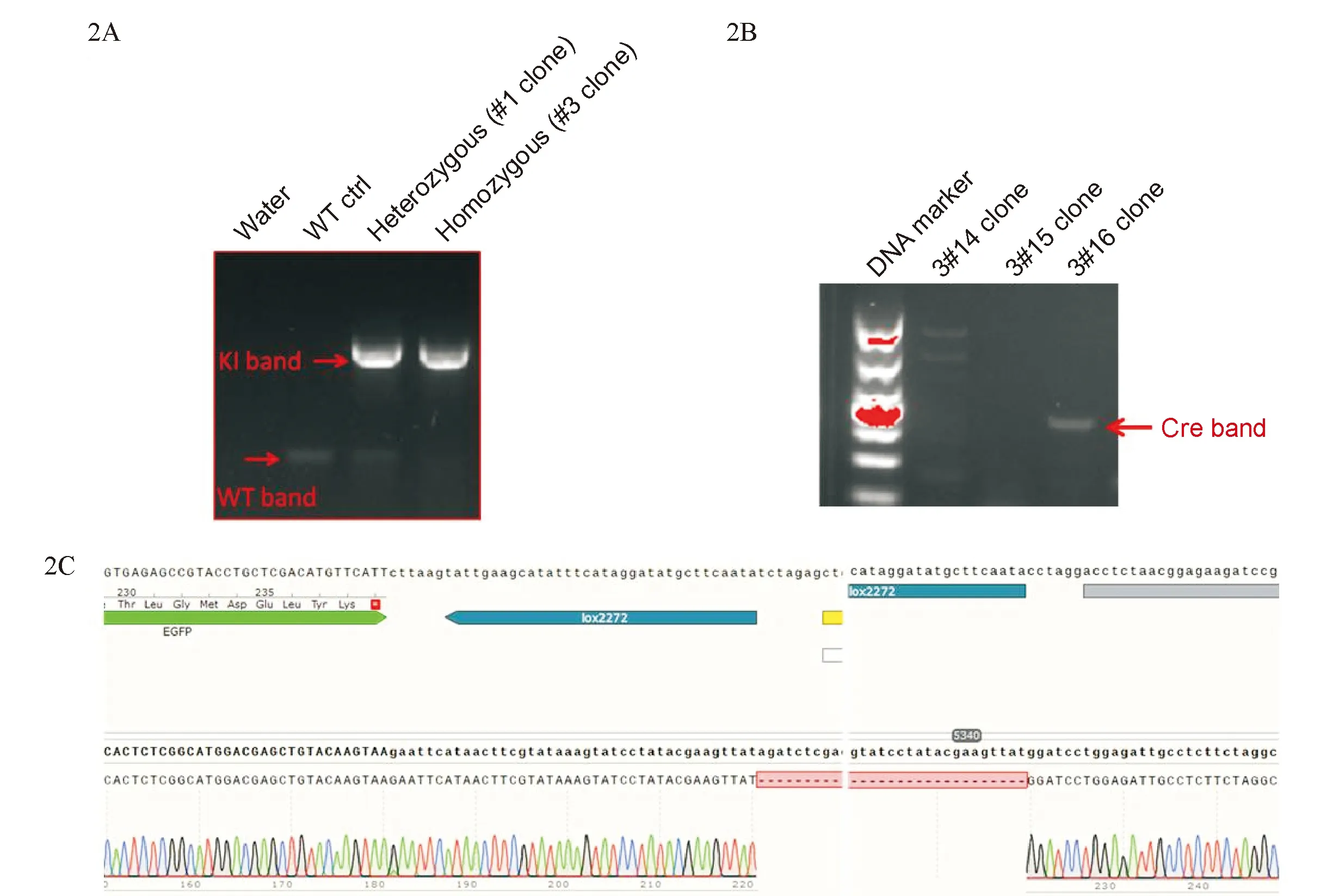
图2 纯合敲入IRES-eGFP的单克隆细胞系keratin 5-IRES-eGFP#3 的PCR鉴定结果(2A)、成功删除除IRES-eGFP以外其它多余的质粒元件的单克隆细胞系keratin 5-IRES-eGFP#3-16的PCR鉴定结果(2B)及Sanger测序结果(2C)
2.4 将hESCs诱导成为角质形成细胞
为诱导keratin 5-IRES-eGFP敲入的hESCs细胞系分化为基底层角质形成细胞,在不同时间点加入多种细胞因子,进行为期30 d的诱导分化培养(图3A)。分化培养30 d后,在白光视野下观察该分化获得的角质形成细胞系ES-KC的细胞形态,可见其与角质形成细胞系HaCaT在形态上一致(图3B)。通过免疫荧光染色鉴定,分化获得的ES-KC细胞系稳定表达GFP与keratin 5,表明可将keratin 5-IRES-eGFP敲入的hESCs细胞系诱导分化为表达绿色荧光蛋白的基底层角质形成细胞(图3C)。
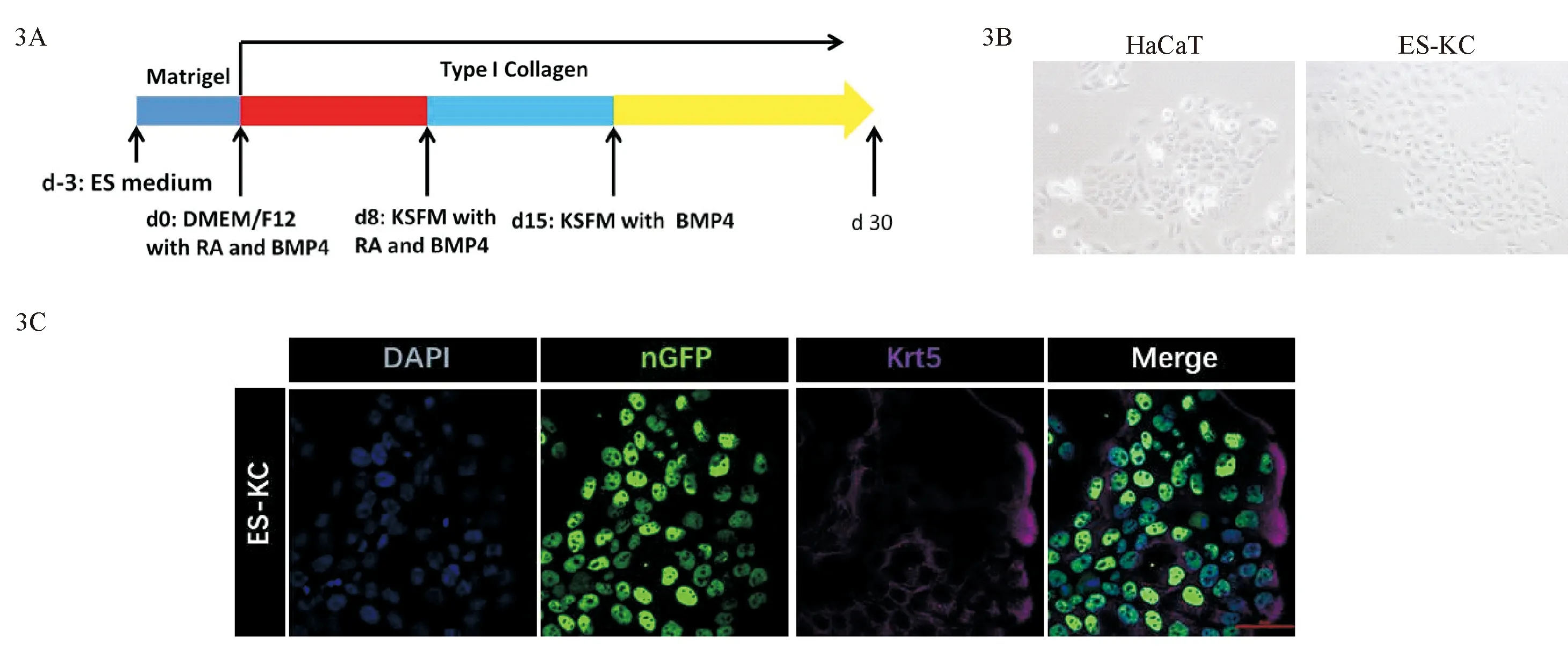
图3 keratin 5-IRES-eGFP敲入的hESCs细胞系的分化培养方案(3A)、角质形成细胞系HaCaT和分化获得的角质形成细胞系ES-KC的白光视野图(3B)及ES-KC的免疫荧光图(3C)
3 讨论
hESCs是经体外分离、培养形成的一种原始多能干细胞,具有分化形成各种组织细胞的潜能,hESCs可经诱导分化为基底层角质形成细胞[14-15]。角蛋白14和角蛋白5可作为基底层角质形成细胞的标志物,可以利用角蛋白14和角蛋白5实现对角质形成细胞的标记,但目前对基底层角质形成细胞分离培养的研究及应用仍有一定限制[16-18]。本研究试图利用基底层角质形成细胞的标志物角蛋白5完成对角质形成细胞的标记。首先通过CRISPR/Cas9技术靶向目的基因keratin 5对hESCs细胞系基因组进行精确编辑,将绿色荧光蛋白报告基因整合至keratin 5下游,制备出keratin 5-IRES-eGFP敲入的hESCs细胞系keratin 5-IRES-eGFP#3-16。在不同时间点加入多种细胞因子培养该细胞系,通过为期30 d的分化培养将hESCs细胞诱导分化为带有绿色荧光蛋白的基底层角质形成细胞,实现了对keratin 5阳性的人表皮基底层角质形成细胞的标记。
综上所述,目前研究尚缺少对基底层角质形成细胞分离培养的细胞模型,本研究建立了keratin 5-IRES-eGFP#3-16细胞系及分化培养方案,可筛选出keratin 5 阳性的基底层角质形成细胞,后续实验中可以利用细胞流式技术将其分选出来,从而为临床上表皮基底层角质形成细胞异常的皮肤病研究提供细胞模型,用于疾病的机制研究。

