丹参酮ⅡA对雷帕霉素诱导自噬M2巨噬细胞共培养的皮肤黑素瘤A375细胞EMT的影响
韩昭, 高艳玲, 李志锋, 张建忠, 张伶, 刘钊, 徐艳艳, 李小静
1.河北工程大学附属医院皮肤科,2.邯郸市中心医院急诊科,河北 邯郸 056002
黑素瘤是一种高转移与高侵袭性的恶性肿瘤,其主要特征是病情进展迅速,易侵袭其他组织器官,患者预后较差,生存率也极低[1]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是浸润于肿瘤间质中的巨噬细胞,在肿瘤微环境中,巨噬细胞极化为M2型TAMs后调节炎症微环境和肿瘤免疫反应是其发挥促肿瘤效应的关键环节,自噬则是介导巨噬细胞极化的重要条件。有证据表明,TAMs对黑素瘤的生长、血管生成、远处侵袭和转移具有重要作用[2]。上皮间质转化(epithelial-mesenchymal transition,EMT)作为重要的细胞生物学进程之一,在肿瘤转移的多个环节发挥关键作用。发生EMT后的上皮细胞,其表型特性向具有干性、侵袭性、耐药性及远端器官转移性的方向转化[3],是诱导肿瘤体内转移与复发的重要病理学因素。尽管黑素细胞并非传统的上皮成分,但黑素瘤向真皮间质侵袭过程中存在EMT现象。丹参酮ⅡA(Tanshinone ⅡA,TanⅡA)为一类脂溶性菲醌化合物,近年来,许多实验研究显示TanⅡA可抑制食道癌、肝癌、肺癌、结肠癌等多种肿瘤细胞生长,诱导其凋亡和分化,具有良好的抗肿瘤前景[4]。我们前期研究发现:Tan Ⅱ A通过下调CXCR7表达抑制黑素瘤A375细胞的侵袭迁移能力并促进黑素瘤细胞发生自噬[5]。本研究拟在成功诱导并鉴定TAMs的前提下,通过TAMs与A375细胞体外共培养,应用流式细胞学、免疫荧光、Western blot、迁移侵袭等实验方法,研究雷帕霉素(Rap)对TAMs自噬调控作用及Tan Ⅱ A作用于A375细胞后对其EMT和侵袭转移能力的影响,并了解Tan Ⅱ A通过TAMs自噬调控皮肤黑素瘤A375细胞EMT的机制。
1 材料与方法
1.1 材料
人恶性黑色素瘤细胞A375由江苏凯基生物技术股份有限公司提供,完全培养基DMEM购自美国GIBCO。THP-1由江苏凯基生物技术股份有限公司提供,CD68、CD204、CD206一抗购自赛默飞,LC3-Ⅱ及Beclin-1抗体购自英国Abcam,羊抗兔IgG-HRP及Western blot检测试剂盒购自江苏凯基生物技术股份有限公司,Transwell小室购自美国Corning Incorporated。
1.2 方法
1.2.1 细胞培养、巨噬细胞的诱导及M2型巨噬细胞的诱导活化 人恶性黑素瘤细胞A375、人单核细胞株THP-1,90%DMEM+10%FBS,于37 ℃、5%CO2、饱和湿度的培养箱中培养。取对数生长期的人单核细胞株THP-1细胞,1×106/孔接种于6孔板,加入PMA(20 ng/mL),孵育48 h,诱导形成巨噬细胞(M0)。取1个贴壁生长的巨噬细胞(M0)的培养皿,培养基中加入IL-4溶液(20 ng/mL)进行诱导M2。
1.2.2 流式细胞术及免疫荧光法鉴定M2巨噬细胞 实验分为3组:未经任何药物处理的THP-1细胞(空白组);经佛波酯(PMA)作用48 h的THP-1细胞(M0组);经PMA、IL-4序贯作用总计达72 h的细胞(M2组)。①流式细胞实验:分别收集3组不同条件诱导的巨噬细胞,得到细胞沉淀,加入90 μL PBS重悬细胞;按抗体说明书加入适量抗体混匀后,37 ℃避光孵育30 min;加入400 μL PBS混匀,后用流式细胞仪检测细胞表型,同样方法对实验进行重复3次。②免疫荧光法实验:向每孔内加入Triton X-100,室温下透膜20 min,加入封闭液封闭细胞滴加一抗(1∶200稀释),4 ℃冰箱过夜,避光加入相应的荧光二抗,加入DAPI溶液,激光共聚焦观察细胞中蛋白的表达情况,取3个高表达区域拍照保存,该实验重复3次。
1.2.3 免疫荧光染色法及免疫印迹法检测雷帕霉素对M2型TAMs自噬的影响 将步骤1诱导后的M2型TAMs分成两组:空白对照组(M2组),即未加任何自噬调节药物;加入雷帕霉素组(M2+Rap组),置于培养箱中24 h。①24 h后,将各组培养基更换为同样的没有药物普通培养基,继续培养48 h后按免疫荧光步骤制作好细胞玻片,相继滴加一抗LC3-Ⅱ(1∶200稀释)、Beclin-1(1∶200稀释)和荧光二抗及DAPI后封片,显微镜下观察细胞中蛋白的表达情况,取3个高表达区域拍照保存。②24 h后,按细胞培养方法收集各组细胞。各加入200 μL冰预冷裂解缓冲液,混匀后冰浴30 min,每隔5 min涡旋震荡10 s,充分裂解。取上清液,测定总蛋白浓度。蛋白质经聚丙烯酰胺凝胶电泳分离后转移到NC膜,5%脱脂奶粉封闭非特异性抗原后,分别加入一抗(1∶1 000稀释)、二抗,1∶3 000稀释的GAPDH为内参标准,化学发光,显影,定影。使用G:BOX-chemiXR5成像,使用Gel-Pro32软件对结果进行灰度分析,将各基因和GAPDH比值作为蛋白相对表达水平。每组实验重复3次,取平均值。
1.2.4 TanⅡA作用于A375细胞与巨噬细胞非接触式共培养体系 取一瓶良好生长状态的人黑色素瘤细胞(A375),按传代方法,接种在6孔板内,密度约20×104/mL,步骤2中对THP-1进行诱导,获得M2巨噬细胞,经雷帕霉素诱导后,以20×104/mL的密度接种于Transwell小室的上室(半透膜孔径为0.4 μm)中;将该上室放入预先已接种A375细胞的6孔板中,构建两者的非接触共培养体系,并放在37 ℃、5% CO2的培养箱中常规培养48 h。用含10%小牛血清的DMEM制备成2×105个/mL细胞悬液,分组加入不同浓度TanⅡA进行实验,分组为低浓度组(1 mg/L)、高浓度组(4 mg/L),空白对照组加入等体积的培养液,分别处理细胞48 h后进行实验。
1.2.5 Western blot 实验检测共培养体系中A375细胞的EMT变化 用RIPA试剂盒提取细胞总蛋白,用二辛可宁酸法测定蛋白质含量。蛋白质经聚丙烯酰胺凝胶电泳(PAGE)分离后转入NC膜,室温下用5%的BSA封闭,分别加入1∶1 000稀释的单克隆抗体,1∶3 000稀释的GAPDH为内参标准,孵育过夜,用PBS洗涤5次,每次5 min。加入1∶5 000羊抗兔IgG二抗,温育1.5 h,用TBST清洗4次,每次10 min。化学发光,显影,定影。使用G:BOX-chemiXR5成像,使用Gel-Pro32软件对结果进行灰度分析,将分子和GAPDH比值作为蛋白相对表达水平。
1.2.6 Transwell 实验检测共培养体系中A375细胞侵袭及迁移能力 Matrigel胶用无血清DMEM培养基1∶1稀释,按60 μL/孔铺于Transwell小室的上室面,37 ℃孵育过夜。每孔加入80 μL无血清培养基,37 ℃孵育30 min,吸去培养基;将共培养后的A375细胞用无血清培养基以5×106/mL浓度按200 μL/孔接种于上层小室,下层小室加入含10%胎牛血清的完全培养基500 mL,继续培养24 h,吸尽培养基,PBS清洗3次,加入4%甲醛,室温固定20 min,PBS清洗3次;风干后0.3%结晶紫染色,显微镜下观察滤膜下表面蓝紫色胞质细胞,随机取10个(×400视野)分别拍照、计数,取均值。以穿膜细胞的数目表示细胞的侵袭能力。实验重复3次。迁移能力实验步骤同侵袭实验,但不需铺Matrigel胶。
1.2.7 统计学处理 所有上述实验程序独立进行并重复3次或以上,所得数据以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较使用独立样本t检验,用SPSS 21.0统计分析软件分析数据,P<0.05为差异具有统计学意义。
2 结果
2.1 M2巨噬细胞的诱导及鉴定
人单核细胞THP-1被PMA刺激作用48 h后分化为M0表型巨噬细胞,可见细胞生长状态由悬浮转变为贴壁,细胞形态由类圆形变为略不规则并伸出少量伪足;继续应用IL-4刺激诱导24 h后,经流式细胞术检测发现M2表面分子CD206、CD68、CD204阳性细胞数明显增多(均P<0.05,表1);免疫荧光实验发现M2表面CD206的表达显著高于M0组(均P<0.05,图1)。表明PMA和IL-4连续刺激能够成功诱导人单核细胞THP-1的分化并极化为TAMs。

表1 流式细胞术检测TAMs的膜标记物CD206、CD68、CD204的表达情况 (mean±SD)

图1 免疫荧光实验检测各组CD206表达
2.2 雷帕霉素对M2型TAMs自噬的影响
免疫荧光发现,M2型TAMs在去除雷帕霉素刺激后48 h仍能够维持LC3-Ⅱ、Beclin-1高表达水平(图2),Western blot实验显示,经雷帕霉素刺激后的TAMs中LC3-Ⅱ、Beclin-1的表达明显增加,差异具有统计学意义(图3、表2,P<0.05)。
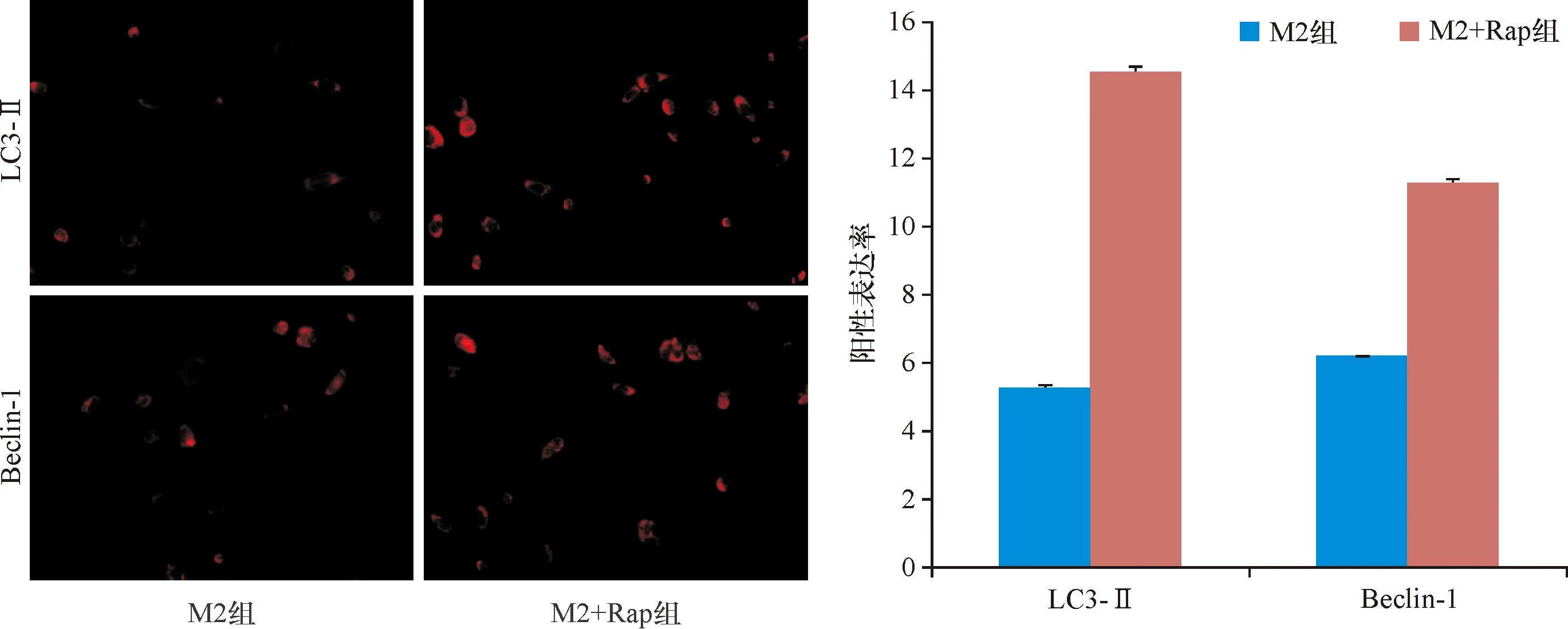
图2 去除雷帕霉素48 h后,各组M2型TAMs中LC3-Ⅱ、Beclin-1的表达
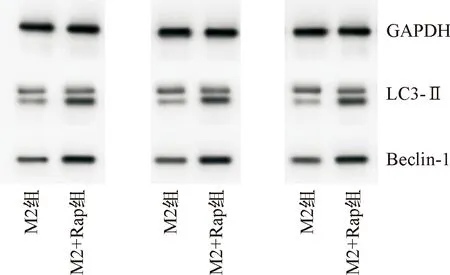
图3 去除雷帕霉素48 h后,Western blot实验检测各组LC3-Ⅱ、Beclin-1的蛋白表达水平

表2 Western blot实验检测去除雷帕霉素48 h后,各组LC3-Ⅱ、Beclin-1的蛋白表达水平 (mean±SD)
2.3 Western blot验证经TanⅡA作用后共培养体系中A375细胞的EMT表达变化
Western blot检测经TanⅡA作用后共培养体系中A375细胞,结果显示(图4、表3),相对于空白组,TanⅡA低浓度组、TanⅡA高浓度组Beclin-1、LC3-Ⅱ和E-cadherin蛋白表达均显著升高(均P<0.05),N-cadherin蛋白表达均显著降低(均P<0.05),组间差异具有统计学意义。

表3 Western blot检测不同TanⅡA浓度组作用后共培养体系中A375细胞LC3、Beclin1、N-cadherin和E-cadheirn的蛋白表达比值 (mean±SD)
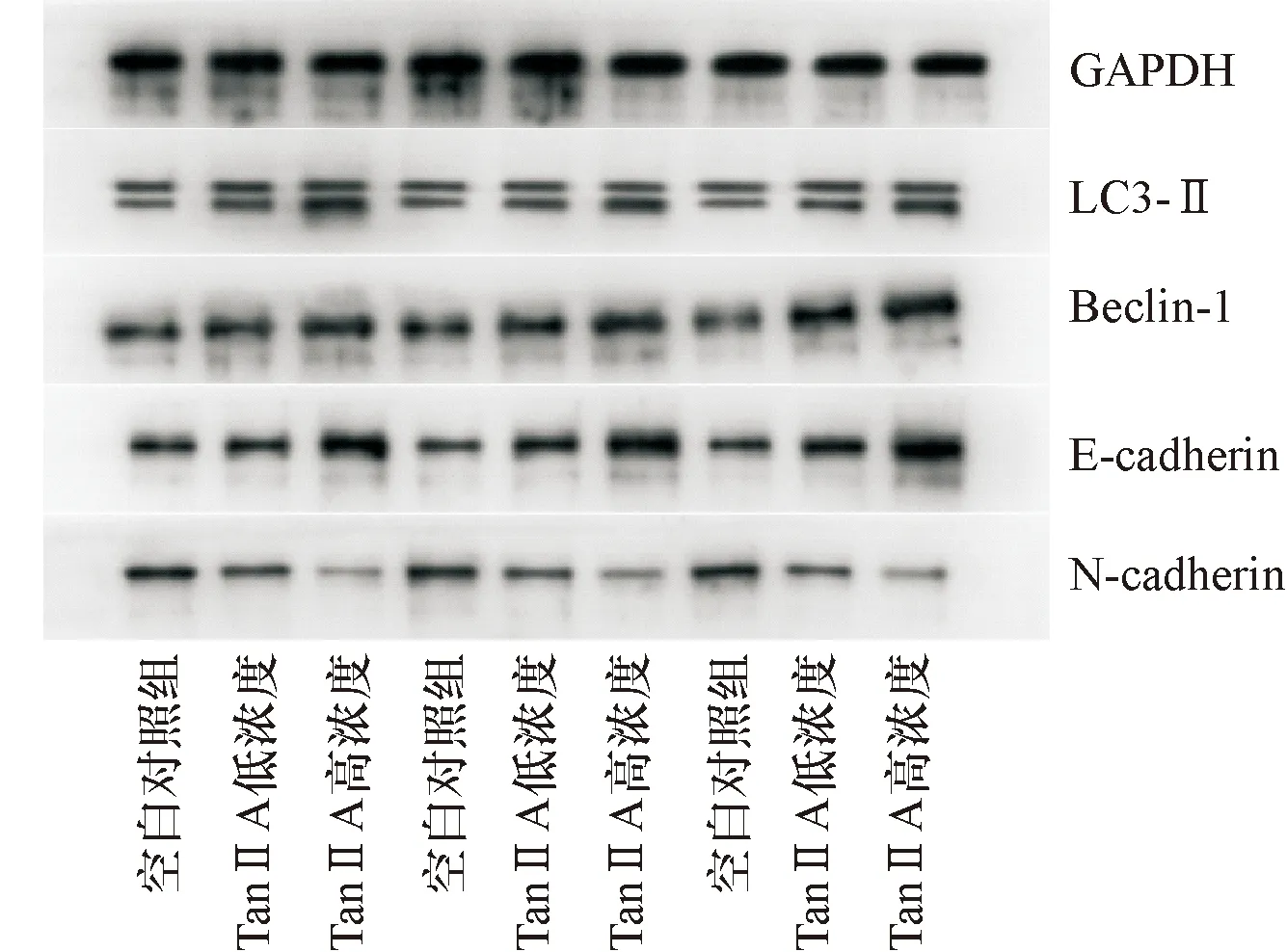
图4 Western blot检测不同TanⅡA浓度组作用后共培养体系中A375细胞LC3-Ⅱ、Beclin-1、N-cadherin和E-cadherin的蛋白表达
2.4 Transwell迁移、侵袭实验
Transwell实验结果表明(图5、表4),经TanⅡA作用后共培养体系中A375细胞的侵袭、迁移能力降低,且TanⅡA高浓度组处理的细胞侵袭、迁移能力较低浓度组明显降低,差异具有统计学意义(P<0.05)。
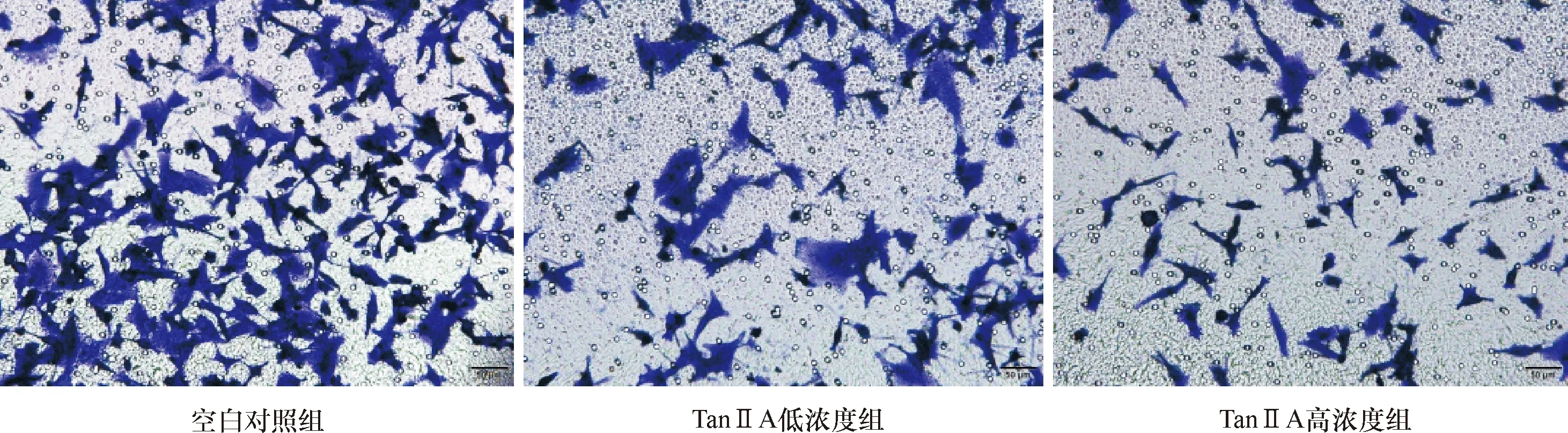
图5 Transwell实验检测不同浓度TanⅡA处理A375细胞的侵袭及迁移
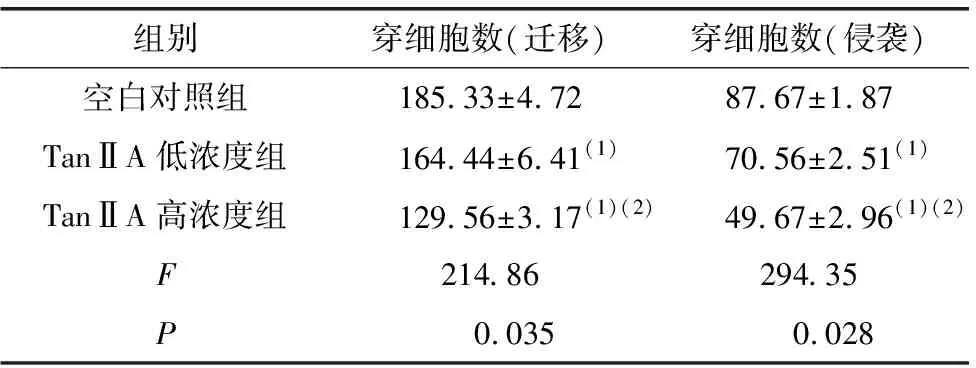
表4 Transwell实验检测不同浓度TanⅡA处理A375细胞的侵袭能力及迁移能力 (mean±SD)
3 讨论
肿瘤的进展伴随着微环境的改变,如肿瘤细胞、间质细胞和免疫细胞分泌的趋化因子、细胞因子和其他因子[6],以及局部缺氧、炎症和高水平乳酸的存在,可使血液中的单核细胞系列被招募到肿瘤微环境中成为TAMs[7],发育成具有不同免疫防御和免疫监视功能的两大类,即经典激活的巨噬细胞(M1)和交替激活的巨噬细胞(M2),M1具有促炎和抗肿瘤、防止肿瘤免疫逃逸的作用,M2具有抗炎和促肿瘤、帮助肿瘤免疫逃逸的作用[8]。多数研究显示,在已形成的肿瘤体系中,M2型TAMs占比较高,高表达CD163、CD206并分泌抗炎细胞因子、管生长因子等,从而抑制肿瘤微环境免疫、促进肿瘤血管生成[9-10]。流行病学研究表明,肿瘤微环境中M2型TAMs浸润数量与肿瘤细胞的远端转移具有相关性,提示TAMs参与了肿瘤的侵袭、转移。Wu等[11]研究发现,外泌体介导的M2型TAMs通过表达CD11b/CD18来活化肝癌细胞金属基质蛋白酶9信号通路,从而诱导肿瘤细胞侵袭和转移。目前,肿瘤微环境中M2表型的TAMs对肿瘤浸润、转移过程的影响成为近年来的研究热点之一。在本研究中,发现PMA、IL-4对单核细胞系THP-1细胞具有明显的趋化作用,与文献报道相一致。PMA、IL-4刺激THP-1细胞48、72 h后,M2型TAMs表型标记物CD68、CD206、CD204细胞的比例增加,提示IL-4在表型和因子两个方面促进THP-1细胞的表型向M2型TAMs方向极化。
肿瘤细胞与非肿瘤细胞以自噬为媒介对肿瘤微环境产生影响[12],自噬有助于微环境中的肿瘤细胞克服代谢压力,维持其在不良理化环境中的生存。自噬还参与肿瘤微环境中TAMs产生的各个环节,包括调节HSCs持续分化、单核细胞募集、单核细胞向巨噬细胞分化以及巨噬细胞极化成TAMs的所有步骤[13]。研究发现TSC2-mTOR途径调节的自噬是单核细胞分化为TAM M2表型中的决定因素[14]。目前的研究表明肿瘤细胞能以分泌自噬小体的方式,诱导巨噬细胞向M2表型极化,形成免疫抑制的肿瘤微环境[15-16]。雷帕霉素可抑制EFAD小鼠p-mTOR表达,增加自噬标志物LC3-Ⅱ的表达[17]。本研究结果也证实了雷帕霉素作为经典的mTOR抑制剂,显示出具有免疫抑制特性。然而,有关肿瘤自噬水平与肿瘤微环境中不同免疫表型TAM的关系,尤其是对巨噬细胞极化的影响报道罕见。
丹参酮ⅡA是从传统中药丹参根中提取的菲醌类衍生物,具有广谱的抗肿瘤活性,对于大多数的肿瘤细胞系都有效,主要诱导细胞产生周期阻滞、线粒体依赖的凋亡以及自噬等[18]。现代药理研究显示,其所含的丹参酮ⅡA可抑制肺癌、乳腺癌、肝癌等多种肿瘤生长[19]。丹参酮ⅡA可以激活大量M2型巨噬细胞,以减弱M1型巨噬细胞极化引起的炎症反应,增加抗炎细胞因子的产生,有效发挥修复和重塑受损组织的作用;还可以通过miR-375/KLF4途径协调巨噬细胞自噬和M2极化的相互作用[20]。本研究观察不同浓度的丹参酮ⅡA对与TAM M2共培养体系中A375细胞进行处理后LC3-Ⅱ、Beclin-1、E-cadherin、N-cadherin的表达量,推测丹参酮ⅡA可能主要是通过抑制EMT信号通路及其相关蛋白的表达而起到抑制肿瘤细胞增殖和侵袭的作用,且随着丹参酮ⅡA的浓度增加,共培养体系中A375细胞的侵袭能力及迁移能力降低,也表明了丹参酮的抗肿瘤活性。雷帕霉素作为经典的mTOR抑制剂,用于改变TAMs的自噬状态,直接影响TAMs的生物学行为,并能够间接改变肿瘤细胞的迁移、侵袭和EMT相关蛋白的表达水平,从而影响肿瘤细胞的生物学行为。
综上所述,目前已经发现TAMs、自噬、EMT相互之间存在非常复杂的关系,本研究表明雷帕霉素可以诱导TAMs自噬,丹参酮ⅡA能够影响TAMs自噬共培养的A375细胞的EMT改变,并具有抑制肿瘤细胞侵袭和转移的作用,可以推测,丹参有效单体成分在抗肿瘤方面存在较大的研究价值及开发潜力,为抗肿瘤临床药物的研发提供了参考,但还需要在基因转染、在体实验等方面进一步深入了解他们相互之间的作用机制。
——雷帕霉素

