水生动物缺氧诱导因子研究进展
宁冰玉,邹雯静,赵闻卓,康定邦,孙景贤,常亚青,湛垚垚
(大连海洋大学农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
氧气是需氧生物进行各项生理活动的必要条件,氧稳态是机体维持正常生命活动的必要条件[1]。在低氧或缺氧条件下,需氧生物的发育[2]、代谢[3]与免疫[4]等均会受到不同程度的影响,甚至导致炎症和肿瘤等病理性改变[5]。
缺氧诱导因子(Hypoxia inducible factor,HIF)是一种由α 和β 亚基组成的异二聚体转录因子,其中α 亚基(HIF-1α、HIF-2α 和HIF-3α)的表达为氧依赖性,而β 亚基(HIF-1β,又称ARNT)的表达为组成性[5]。自1991 年首次发现以来,大量研究证实,缺氧诱导因子是需氧生物细胞响应低氧或缺氧胁迫的关键因子[6,7]。通常情况下(常氧状态),HIF-α 亚基中的脯氨酸残基会被脯氨酰羟化酶(Prolyl hydroxylase,PHD)羟基化,随后,这些羟基化的HIF-α 亚基会在E3 泛素连接酶作用下通过泛素体系降解;当低氧或缺氧时,随着细胞中的PHD活性降低,泛素体系对胞质中HIF-α 亚基的降解作用减弱,稳定的HIF-α 亚基可通过易位作用进入细胞核,与核内的HIF-β 亚基形成异源二聚体,从转录水平调节许多与炎症、细胞分化以及细胞增殖相关的基因(如血管内皮生长因子和促红细胞生成素等)的相对表达,帮助机体适应或应对低氧或缺氧胁迫[5](图1)。
与陆生环境相比,水生动物赖以生存的水环境中的溶解氧浓度约为8~9 mg·L-1(20℃)远低于大气中的氧含量(约300 mg·L-1),且会随着水流、温度以及季节等因素的变化而波动[8]。因此,水生动物与陆生动物相比,可能更为频繁地遭遇缺氧胁迫。缺氧不仅影响水生动物的摄食、生长与繁殖[1],还影响水生动物的免疫防御能力[6,7]。水体缺氧可显著抑制挪威海鳌虾(Nephrops norvegicus)的摄食量[9];当水体溶解氧浓度为2.6 mg·L-1时,红大马哈鱼(Oncorhynchus nerka)基本不能生长[2];缺氧也会导致软口鱼(Chondrostoma nasus)的胚胎存活率和孵化率显著下降[10]。
关于水生动物缺氧诱导因子的相关研究最早可以追溯到21 世纪初,目前已在软体动物(Mollusks)、节肢动物(Arthropods)、棘皮动物(Echinoderms)和鱼类中取得了一定的研究成果[6,7]。本文通过综述近年来水生动物缺氧诱导因子各亚基的序列特征、进化特点及其生物学功能,旨在系统梳理水生动物中缺氧诱导因子的相关分子生物学数据,为深入了解和掌握水生动物中缺氧诱导因子的生物学功能提供基础。
1 水生动物缺氧诱导因子的序列特征及系统发育特点
按照功能的不同,水生动物中的缺氧诱导因子家族可分为4 种亚基,分别为HIF-1α、HIF-2α、HIF-3α 和HIF-1β。截至2021 年6 月,在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中登陆的水生动物的缺氧诱导因子全长氨基酸序列为380 条,其中,HIF-1α 占62%(234 条)、HIF-2α 占4%(17条)、HIF-3α 占3%(10 条),HIF-1β 占31%(119条)。比较发现,水生动物中的缺氧诱导因子4 种亚基的全长为100~1 571 个氨基酸(aa),其中,HIF-1α 的全长为100~1 571 aa,其中绝大部分(700 aa 左右)比大多数陆生动物(800 aa 左右)短;HIF-2α 的全长为684~1 058 aa,大多与陆生动物(866~874 aa)相近;HIF-3α 的全长为249~643 aa,与陆生动物(333~692 aa)相近;HIF-1β 的全长为150~1 691 aa,其中99%(不超过781 aa)比陆生动物(776~886 aa)短。
通过Pfam 在线服务(http://pfam.xfam.org/)对4种陆生动物和20 种水生动物的缺氧诱导因子(表1)进行保守结构域分析(图2)发现,在鱼类中,除了鳜(Siniperca chuatsi)的保守结构域与陆生动物的相同外,绝大多数鱼类比陆生动物缺少PAS 蛋白结合结构域(Per-Aart-Ser Protein Binding Domain,PAS)。值得注意的是,大西洋鲑(Salmo salar)的HIF-1α中存在PAS 11 结构域,而PAS 3 结构域和HIF-1α C 末端反式结合结构域(HIF-1α C terminal transactivation domain,HIF-1α CATD)均不存在。在贝类中,除太平洋牡蛎(Crassostrea gigas)的HIF-1α 保守结构域与陆生动物相同外,其余种类的种间变异较大,其中,与陆生动物相比,赤贝(Anadara broughtonii)的HIF-1α 中存在PAS 11 结构域,PAS 3 结构域和HIF-1α CATD 结构域均不存在。虾夷扇贝(Mizuhopecten yessoensis)和杂色鲍(Haliotis diversicolor)的HIF-1α 中存在HLH-DNA 结合结构域(Helix-loop-Helix DNA Binding Domain,HLH),而HIF-1α CATD 结构域不存在。与陆生动物相比,甲壳类动物的HIF-1α 中存在PAS11 结构域,缺少了HIF-1 结构域、PAS3 结构域和HIF-1α CATD结构域。对HIF-2α 保守结构域的分析结果显示,鱼类的HIF-2α 比陆生动物的HIF-2α 多了PAS结构域。对HIF-1β 保守结构域的分析结果显示,本研究中所选物种中HIF-1β 的保守结构域均相同,这也从侧面反映出HIF-1β 在物种进化上的高度保守性。
对3 种陆生动物和15 种水生动物缺氧诱导因子的α 亚基(表1)进行系统发育分析(图3)发现,所有物种的HIF-1α、HIF-2α 和HIF-3α 分别优先聚支,提示,HIF-α 不同亚基间的分化较早。但是,大西洋鲑的HIF-1α 优先与其他脊椎动物的HIF-3α 聚支,而与HIF-1α 的进化距离较远。大西洋鲑的HIF-1α 序列较短,可能缺少部分氨基酸,因此,还需要更多的研究来完善大西洋鲑中缺氧诱导因子的系统发育信息。脊椎动物的HIF-1α和HIF-2α 优先聚支,具有较近的亲缘关系,而HIF-3α 则单独聚支,与HIF-1α 和HIF-2α 亲缘关系较远,提示,HIF-1α 和HIF-2α 在进化过程中相对保守。
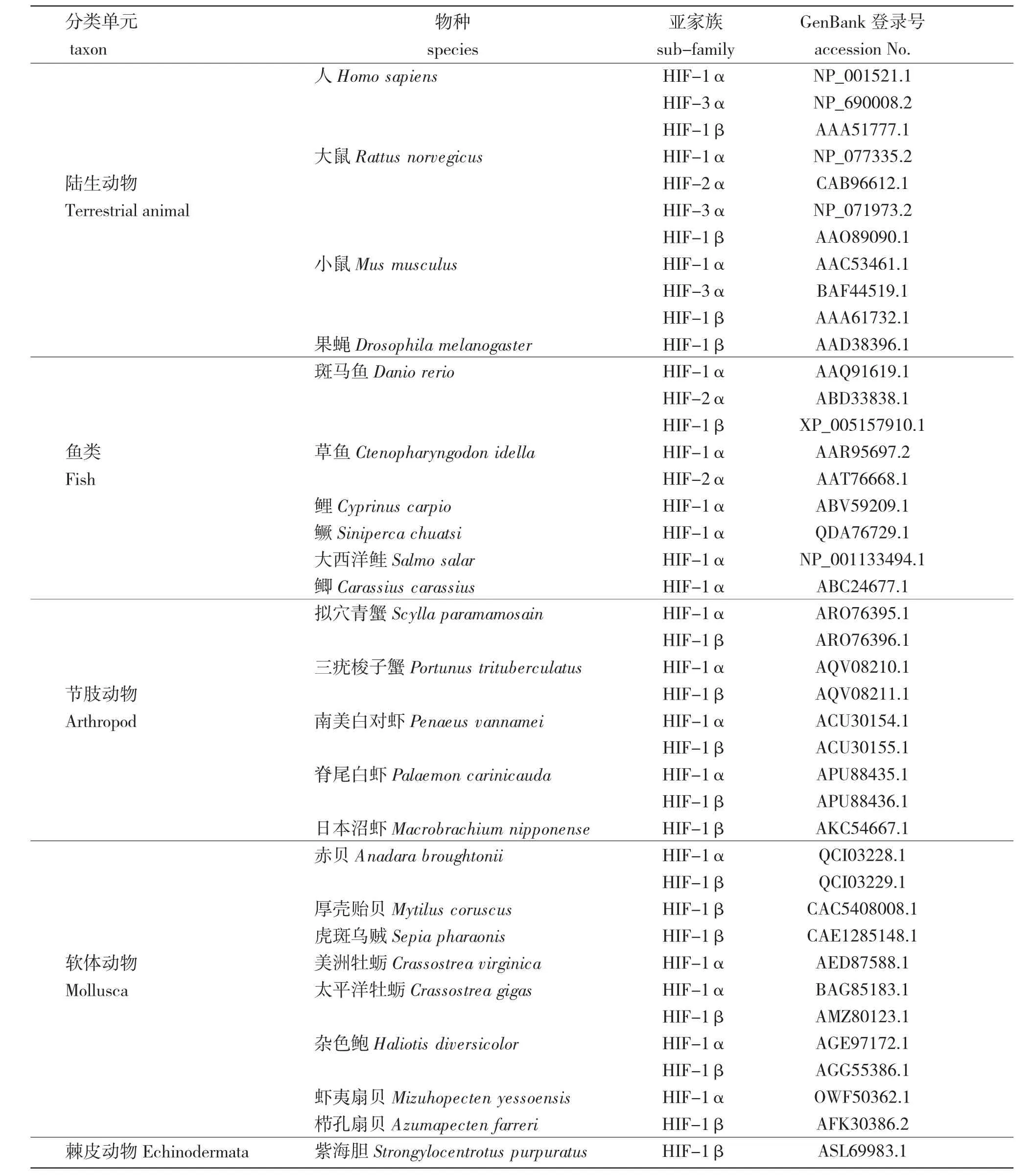
表1 NCBI 数据库中常见水生动物HIF 家族成员氨基酸序列统计及用于构建系统发育树的氨基酸序列信息(截至2021 年6 月)Tab.1 Statistics on the amino acid sequence and amino acid sequence information for domain analysis and constructing phylogenetic tree of HIF family members in common aquatic animals in NCBI database(by June 2021)
对4 种陆生动物和13 种水生动物缺氧诱导因子的β 亚基(表1)进行系统发育分析(图3)发现。不同物种的HIF-1β 优先聚支,提示,HIF-1β 亚基在不同物种中具有明显差异。其中贝类动物中双壳纲的物种优先聚支,说明在双壳纲中可能出现单系发育现象。
2 水生动物中缺氧诱导因子的生物学功能
2.1 维持机体氧稳态
维持水生动物体内的氧稳态是缺氧诱导因子的基本生物学功能。研究显示,缺氧诱导因子家族成员在氧气可利用性变化过程中,对细胞和系统氧稳态主要起调节器作用[11]。Chen 等[11]的研究证实,栖息于氧气较稀薄(DO:2 mg·L-1)的高原鱼硬刺高原鳅(Triplophysa scleroptera)的心脏、肝脏、大脑、脾脏、肾脏五个主要器官中的HIF-1α 蛋白水平显著高于生活于常氧(300 mg·L-1)状态下的大鳞副泥鳅(Paramisgurnus dabryanus),表明高原鱼体内缺氧诱导因子含量高的原因可能与选择压力下hif-1α 转录活性的显著增强有关。在缺氧条件下,鲫体内的HIF-1α 蛋白水平升高,处于缺氧条件下鲫鳃表面积与比常氧状态下的对照组增大了7.5 倍,提示,HIF-1α 可能参与缺氧条件下鲫鳃的形态改变过程,使生物适应缺氧环境[12]。还有研究显示,当受到不同程度缺氧胁迫时,太平洋鲱(Clupea pallasii)、河鲈(Perca fluviatills)、欧洲舌齿鲈(Dicentrarchus labrax)等水生动物肝脏中的hif-1α 的相对表达量均呈现显著增加趋势,表明鱼类肝脏中的hif-1α 具有作为环境缺氧生物标志物的应用潜力[13]。
2.2 调节机体的免疫与应激反应
除了调节机体氧稳态外,HIF-1 在水生动物响应病害侵染及应激源的免疫防御过程中也发挥调控作用。在响应病毒感染方面,鳜HIF-1α 的过量表达可抑制鳜虹彩病毒(Mandarin fish ranavirus,MRV)和鳜弹状病毒(Siniperca chuatsi rhabdovirus,SCARV)感染鳜仔鱼细胞系细胞(Mandarin fish fry-1,MFF-1)的过程,而敲低hif-1α 则可增加鳜感染上述两种病毒的机率[14]。Xu 等[3]发现,在缺氧条件下,草鱼(Ctenopharyngodon idella)鳃中的hif-1α和Toll 样受体4(Toll Like Receptor 4,TLR4)的相对表达量均呈现上调表达趋势。TLR4 通过识别并结合相应病原微生物表面的病原模式相关分子诱导某些免疫效应分子(如炎性细胞因子)表达[15],因此,Xu 等[3]提出草鱼中的hif-1α 可能通过调控TLR4的表达而参与草鱼的免疫防御反应。鲤上皮瘤(Epithelioma papulosum cyprini,EPC)细胞中的hif-1α 具有促凋亡因子的作用[6],而斑马鱼(Danio rerio)中hif-1α 的活化则可抑制细胞凋亡和细胞自噬,减少中性粒细胞的凋亡,增强斑马鱼的免疫能力[16]。鲤(Cyprinus carpio)感染乳酸乳球菌菌株后48 h内,体内hif-1 的相对表达量呈高表达,表明hif-1可能作为转录调控开关,调节鲤体内相关免疫应答因子的表达以响应乳酸乳球菌的早期感染[4]。
在响应应激源方面,Gong 等[17]发现,大口黑鲈(Micropterus salmoides)肝脏和脾脏中的hif-1α 可参与由酵母水解物引起的氧化应激反应,通过介导中性粒细胞炎性浸润,促进大量产生活性氧簇和活性氮簇自由基,增加血浆中超氧化物歧化酶的活性,提高大口黑鲈的抗氧化能力和免疫防御反应。与健康的对照组相比,患高碳酸血症(Hypercapnia)的塞内加尔鳎(Solea senegalensis)头肾中hif-1的相对表达呈显著增加趋势,提示,hif-1 可以作为一种治疗鱼类高碳酸血症的分子靶向基因[18]。Fitzgerald 等[19]发现,hif 的活化和高表达可降低铜等重金属对斑马鱼胚胎的毒性。
2.3 调控机体的能量代谢
有研究显示,缺氧条件下,水生动物体内的hif-1 主要通过上调乳酸脱氢酶(Lactate dehydrogenase,LDH)等关键酶的表达,参与调节糖酵解与三羧酸循环能量代谢过程。Robertson 等[28]发现,低氧胁迫时,大口黑鲈体内的hif-1α 可作为葡萄糖代谢的主要调节因子促进糖酵解代谢[17]。受到缺氧胁迫后,草鱼体内的hif-1 可通过上调细胞中3-磷酸甘油醛脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)和异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)的含量,调控草鱼体内糖的无氧酵解和有氧代谢途径,促进草鱼适应缺氧环境[3]。厚鳍图丽鱼(Astronotus crassipinnis)在受到低氧胁迫后,也是通过上调体内hif-1α 的表达从而激活并上调LDH 含量,促进厚鳍图丽鱼的糖酵解代谢[24]。还有研究证实,瓦氏黄颡鱼(Pelteobagrus vachelli)暴露在缺氧(2 mg·L-1)下,hif-1α 含量上调,脑和肝脏中的糖酵解关键酶(磷酸果糖激酶,己糖激酶,丙酮酸激酶)的活性和LDH 的含量均呈显著上升趋势,而三羧酸循环的关键酶——柠檬酸合酶的含量却显著下降,表明在缺氧状态下,hif-1α参与调控瓦氏黄颡鱼脑和肝脏中的无氧代谢能力增加,有氧代谢能力下降的过程[25]。在甲壳动物也发现,处于低氧胁迫条件下(2 mg·L-1)的日本沼虾(Macrobrachium nipponense)[21]、拟穴青蟹(Scylla paramamosain)[22]和凡纳滨对虾(Litopenaeus vannamei)[23]可通过上调肌肉中hif-1 的相对含量增强LDH 的相对表达,加快体内糖酵解的速率以产生更多能量。
2.4 调控机体发育
在低氧及缺氧条件下,hif-1 的异常表达可以影响鱼类的胚胎发育。与健康鱼相比,患有M74 综合症(卵黄囊鱼苗死亡率异常高的现象)的大西洋鲑卵黄期仔鱼体内的hif-1α 靶基因血管内皮生长因子(Vascular endothelial growth factor,VEGF)下调,提示,患M74 综合症的大西洋鲑仔鱼高死亡率可能与hif-1α 靶向调控VEGF 有关[26]。Robertson 等[28]研究显示,与处于常氧状态下的对照组鱼相比,生活于低氧状态下的斑马鱼胚胎中hif-1α 在各发育阶段始终处于高表达状态[27],而这种胚胎期hif-1 的持续高表达可能对个体后期的表型形成产生复杂而深刻的影响[28]。
研究证实,hif-1 可参与调控鱼类幼鱼或成鱼的整体表型、器官形态及性别分化等。Robertson 等[28]的研究发现,在缺氧条件下,斑马鱼hif-1 的激活与幼鱼或成鱼表型的改变密切相关,推测斑马鱼幼鱼耐缺氧性的增强可能是hif-1 介导的皮肤重塑的结果。斑马鱼的hif-1 在不同发育时期,可以通过靶向调节不同基因的转录,而影响斑马鱼的发育过程[28]。值得注意的是,Robertson 等[28]发现,与常氧状态下的对照组相比,长期生活于低氧条件下的斑马鱼种群中雄性的比例更高,其机制可能是由于受hif-1β调控的芳香酶(Aromatase,CYP19)的活性受损导致睾丸激素生成增加[29]。因此,有学者指出,hif-1 的异常激活可能会间接破坏发育过程中类固醇激素的产生[30]。
3 展望
综上所述,缺氧诱导因子不仅在水生动物应答低氧胁迫中扮演着重要角色,还可反映水生动物遭遇低氧胁迫程度,在环境保护和养殖生产中具有作为水质监测指示分子标记的潜在应用价值。但是,目前水生动物中缺氧诱导因子的研究才刚刚起步,水生动物缺氧诱导因子的序列和结构信息仍不全面、生物功能解析及表达调控的研究仍相对匮乏,今后应重点开展以下三方面的工作:首先,应大范围开展水生动物中缺氧诱导因子基因(特别是hif-2α、hif-3α 和hif-1β)的鉴定工作,在全面获得水生动物缺氧诱导因子基因的序列信息和结构信息的基础上,进一步梳理和分析水生动物中缺氧诱导因子的系统发育特点及规律;其次,充分利用高通量测序和生物信息数据分析技术,深入研究不同水生动物缺氧诱导因子的生物功能,分析和比较不同水生动物缺氧诱导因子表达规律和代谢调节等共性特征以及种属特异性特征,在此基础上,从分子互做层面(如蛋白质-蛋白质互做、miRNA-mRNA 互做)深入挖掘影响水生动物缺氧诱导因子表达的调控元件;最后,系统评估水生动物缺氧诱导因子作为水质环境指示物和生物响应缺氧等胁迫指示物的潜在应用价值,探讨如何通过调控水生动物缺氧诱导因子的表达而增强水生动物耐低氧特性的方法。

