水稻幼穗响应稻曲病菌毒素胁迫早期的转录组分析
伏荣桃 王剑 陈诚 赵黎宇 陈雪娟 卢代华, *
水稻幼穗响应稻曲病菌毒素胁迫早期的转录组分析
伏荣桃1, 2王剑1, 2陈诚1, 2赵黎宇1陈雪娟1卢代华1, 2, *
(1四川省农业科学院 植物保护研究所, 成都 610066;2农业部西南作物有害生物综合治理重点实验室, 成都 610066;*通信联系人, email: daihlfrt@126.com)
【目的】由稻曲病菌引起的稻曲病不仅造成水稻减产,而且还会产生对动物和植物有毒的真菌毒素。探明水稻幼穗对稻曲病菌毒素胁迫响应的分子机制,可为发掘水稻抗稻曲病基因以及抗病分子育种开辟新的思路。【方法】用稻曲病菌毒素处理水稻幼穗,采用转录组测序技术对水稻幼穗进行转录组测序,以水稻9311基因组作为参考基因组进行对比,利用TPM法计算基因表达量,设定参数(差异倍数的绝对值不小于2,且值不大于0.05)筛选差异表达基因。结合基因差异表达分析、富集功能分析,鉴定水稻响应胁迫的关键基因,并利用实时荧光定量PCR技术对差异表达基因进行验证。【结果】在稻曲病菌毒素胁迫12 h后,水稻幼穗出现2526个差异表达基因(DEG);通过GO富集、KEGG代谢途经和KOG功能分析,将差异基因划分为GO功能下的64个条目、32个代谢途径和KOG功能下23个类别,包括淀粉和蔗糖代谢、苯丙类生物合成、碳代谢、糖酵解/糖异生、氨基糖和核苷酸糖代谢等生物学过程。DEG中有66个植物转录因子,分属7种植物转录因子家族,包括WRKY和Myb两大转录因子。分析二萜类生物合成与淀粉和蔗糖代谢途径相关基因发现,、和细胞色素P450等基因表达量上调,而淀粉酶、β-呋喃果糖苷酶和UDP-焦磷酸化酶等基因表达量下调,推测这些基因在水稻响应稻曲病菌毒素胁迫时发挥重要的作用。【结论】稻曲病菌毒素作为非生物胁迫因素对水稻幼穗具有毒性;通过干扰淀粉和蔗糖代谢等途径而影响种子营养物质的合成,降低水稻抵抗病原菌侵染水稻的能力。
水稻;稻曲病菌;真菌毒素;转录组分析
稻曲病是由稻绿核菌(Takahashi)引起的水稻穗部真菌病害,广泛分布于世界各水稻主产区[1]。该病菌侵染水稻穗部形成大于谷粒数倍的稻曲球,不仅造成水稻产量损失,还产生对人畜有害的真菌毒素,对水稻的食用安全造成很大影响[2-4]。稻曲病菌在生长和侵染水稻过程中产生的真菌毒素有稻曲菌素、稻绿核菌素和山梨素等[5-8]。稻曲菌毒素不仅对动物细胞有毒害作用[9-10],而且对植物也有明显的抑制作用。陈美军等[11]用稻曲病菌液体培养产生的粗毒素处理小麦种子胚根和胚芽,发现稻曲菌毒素对小麦胚根胚芽的生长有强烈的抑制作用,即使将滤液稀释40倍后,仍然有强烈的抑制作用。Hamed等[12]用稻曲球粗提液处理浮萍,发现浮萍叶片色泽逐渐变浅,呈现坏死性症状,最终完全死亡。Wang等[13]用稻曲球制备的水浸出液对水稻、玉米和小麦种子的萌发具有强烈的抑制作用,可显著抑制水稻、玉米和小麦胚根和胚芽的生长。Fu等[14]报道,稻曲病菌菌丝液体培养产生的粗毒素对水稻种子胚根和胚芽生长有强烈的抑制作用。
国外学者研究表明,稻曲菌毒素对动物细胞的毒性机理是与动物微管蛋白相互作用,通过对动物微管组装和解聚的潜在抑制作用,从而抑制有丝分裂作用[15]。武斌等[16]分析了稻曲病菌粗毒素对水稻幼根的毒性机制,发现毒素对糖代谢、氨基酸代谢和次生物质代谢有较大影响,明显下调15个植物抗病蛋白编码基因的表达。尽管国内外学者对稻曲病菌毒素作用机制做了一些研究报道,但仍鲜有水稻孕穗末期(稻曲病菌侵染关键期)稻曲菌毒素对水稻幼穗作用机制的研究。转录组测序技术已成功运用到植物与生物和非生物胁迫的互作研究中,可以提供目标生物组织在特定的胁迫条件下较全面的基因表达情况;比较转录组技术分析可以用来寻找特定生理或病理的靶标基因变化[17-18]。本研究采用转录组测序技术分析稻曲菌毒素胁迫早期水稻幼穗基因表达模式和转录调控机制,以期初步阐明稻曲菌毒素在病原菌侵染过程中的作用机制,为水稻抗稻曲病分子育种开辟新的思路。
1 材料与方法
1.1 水稻材料
选用籼型常规稻9311为水稻实验材料(长沙德农正成水稻研究所选育)。试验在四川省农业科学院试验基地温室大棚里进行。种植3行,每行10株,整个生育期管理按常规栽培管理进行。
1.2 稻曲病菌毒素提取
稻曲病菌粗毒素提取方法参考陈美军等[11],稍加改进。将PSA培养基上的稻曲病菌BX-2菌丝转移至PS液体培养液中,28℃、120 r/min下培养14 d。将培养液过滤、离心,收集上清液100 mL。将滤液60℃旋转蒸发至干,再加入100 mL甲醇,振荡、充分萃取,离心去除甲醇不溶物,上清液55℃下旋转蒸发至干,再加入100 mL无菌水溶解,即成为稻曲病菌粗毒素液,保存于4℃下备用。
1.3 稻曲病菌毒素处理
采用人工注射接种方法进行水稻稻曲病菌毒素的接种试验[3]。在水稻孕穗期(抽穗前5~7 d)于傍晚用注射器吸取稻曲病菌毒素注射到穗苞中部直至液体溢出为止,以接种无菌水和未处理的水稻为对照,接种后喷雾保湿48 h,控制湿度在90%以上。为研究稻曲菌毒素对水稻幼穗的影响,选择处理12 h的水稻幼穗取样,每个样品取6穗,做好标记放入取样袋中放到液氮中速冻,带回实验室保存于−80℃下。
1.4 转录组测序与分析
1.4.1 水稻RNA提取
将液氮冷冻的穗子用组织破碎仪迅速粉碎成粉末,用植物RNA提取试剂盒严格按照试剂盒说明书中的步骤提取总RNA。用Nanodrop 2000超微量分光光度计检测其纯度和浓度。最后,用1%的琼脂糖凝胶电泳检测RNA质量,待测水稻样品均达到转录组测序要求后,送至生工生物技术(上海)有限公司测序。
1.4.2 cDNA文库构建与测序
cDNA文库的制备由生工生物技术(上海)有限公司完成,采用Illumina HiSeq™ 2500测序仪对构建的cDNA文库进行双末端测序。
1.4.3 数据分析
将测序得到的原始数据进行测序错误率分布及 GC 含量分布检验,获得高质量的有效序列(clean reads)。用TPM法(Transcripts per Million)对基因表达量进行定量,利用Cufflinks的Cuffdiff 分析模块筛选差异表达基因(differentially expressed genes, DEG),以差异倍数的绝对值不小于2且值不大于0.05为筛选标准[19],将DEG注释到GO、KEGG、KOG数据库中,获得差异表达基因的GO功能注释、代谢途径通路信息以及KOG功能信息。
1.4.4 差异表达基因的qRT-PCR验证
为了验证RNA-Seq数据的可靠性,随机选取稻曲菌毒素处理12 h的6个差异表达基因进行qRT-PCR表达量验证。用在线软件ncbi.primer-blast设计引物,以水稻作为内参基因[20],引物序列见表3。利用2×TSINGKE®Master qPCR Mix(SYBR Green I,擎科生物)试剂盒进行qPCR,总反应体系20 μL,包括2×TSINGKE®Master qPCR Mix 10 μL、前、后引物各0. 4 μL、cDNA样本2 μL、ddH2O 7.2 μL。每个样品3次重复。qPCR程序如下:95℃下1 min;95℃下10 s,60℃下10 s,72℃下15 s,40个循环。仪器采用qTower3G实时PCR系统(德国耶拿)。采用2法计算基因相对表达量[21]。

图1 稻曲病菌毒素处理后的稻穗症状
Fig. 1. Symptoms of rice panicles 14 days after exposure to mycotoxins.
2 结果与分析
2.1 水稻穗子接种稻曲病菌毒素后的症状
在水稻抽穗前5~7 d,用稻曲病菌毒素人工注射接种水稻幼穗结果显示,毒素处理的水稻穗长比对照穗长短,破口时间延后,没有出现灌浆期,小穗穗壳的颜色为乳白色,最后水稻穗子的籽粒为瘪壳,没有形成种子(图1),表明毒素可抑制水稻花器官的发育,阻止子房发育,抑制淀粉的积累,导致瘪粒。
2.2 测序数据质量评估及质控分析
转录组分析共设计6个样本,包括毒素处理和对照组各3个样本。利用MGISEQ-2000测序得到的原始数据(raw data),里面含有带接头的、低质量的序列,为了保证信息分析质量,必须对原始数据过滤,得到有效数据(Clean data)。从整体上看,每个样本最后得到3500~5000万条有效数据,样本平均有效碱基数(Clean bases)约为5.89 G,Q10为99.07%~99.44%,Q20为96.09%~97.58%,Q30为86.91%~90.75%,GC含量为49.21%~52.26%。使用HISAT2,利用93-11参考基因组作为参考序列进行比对,样本中至少有 93.65%的测序序列可以定位到参考序列上(表1)。表明整体测序质量良好,数据可用于后续生物信息学分析。
2.3 差异表达基因分析
利用DESeq2对水稻幼穗各样本的转录组数据进行分析。分析结果从图2可知,毒素处理后12 h和对照组(CL1 vs CK1)中鉴定到表达量发生改变的基因有2526个,其中1164个DEG表达上调,1362个DEG表达下调。
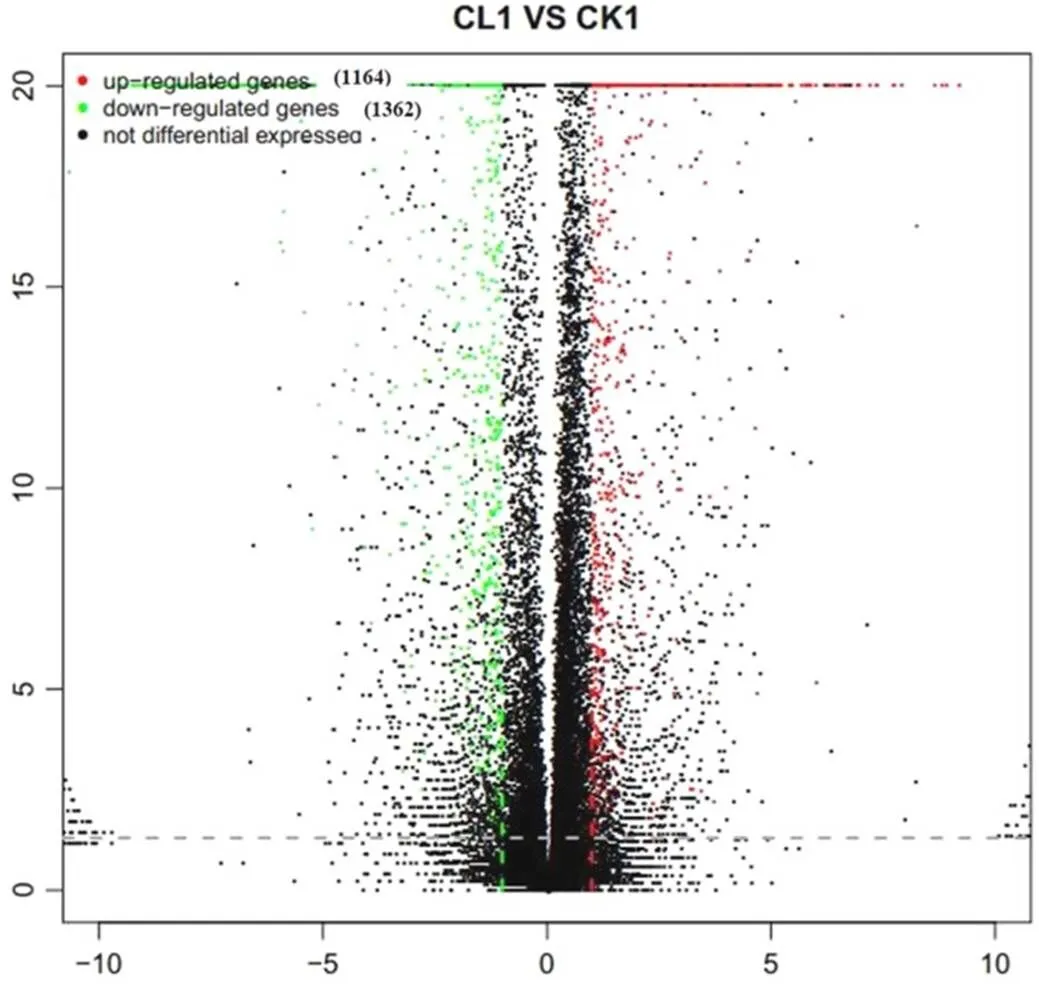
横轴为基因在不同组样本间的差异表达倍数(Log2B/A);纵轴为基因表达量变化的统计学显著程度(P值);图中每个点代表一个基因,其中红色表示上调基因,绿色表示下调基因,黑色表示非差异基因。
Fig. 2. Volcano-plot distribution of DEGs.
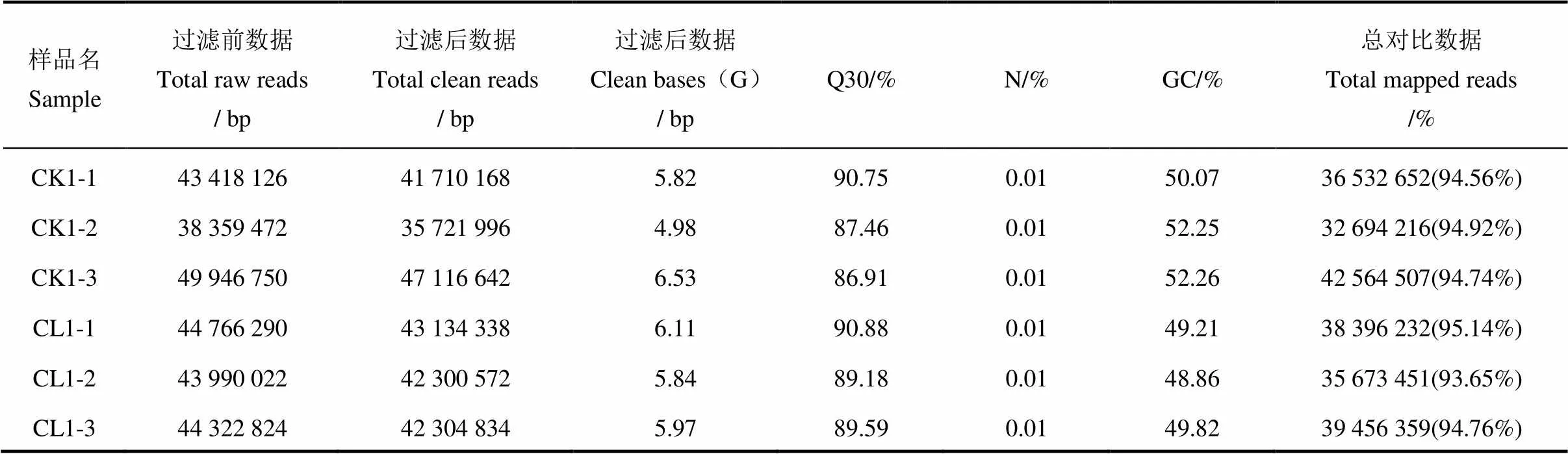
表1 样本测序数据质量控制数据统计
注:Q30%―Phred数值大于30碱基的数及在碱基总数中的百分含量;N/%―不确定碱基数及百分数;GC/%―G和C碱基的总数和及在碱基总数的百分比;样品名中CK、CL分别表示对照和处理,1、2、3表示3个重复。
Note: Q30%, Phred value is greater than 30 bases and the percentage of total bases; N/%, Number and percentage of uncertain bases; GC/%, The sum of G and C bases and the percentage of total bases; In the sample name, CK and CL represent the control and treatment, respectively; and 1, 2, 3 represent the three repetitions.
2.4 差异表达基因的GO分析
为了更好地了解差异表达基因的功能,对鉴定到的差异表达基因进行GO(Gene Ontology)注释。GO共有3个ontology,分别描述基因的分子功能(molecular function)、细胞组分(cellular component) 和生物学过程 (biological process)。对数据进行统计分析,发现本研究挖掘的差异表达基因可注释到GO功能下的64个词条(term)中。其中,生物过程有26个小类,主要集中在细胞过程(cellular process)、代谢过程(metabolic process)和对刺激反应(response to stimulus)、生物调节(biological regulation)、生物过程的调节(regulation of biological process)等;细胞组分有22个小类,主要集中在细胞(cell)、细胞组分(cell part)和膜(membrane)、细胞器(organelle)及膜部件(membrane part)等;分子功能有17个小类,主要集中在催化活性(catalytic activity)和结合位点(binding)等方面(图3)。在稻曲菌毒素胁迫下水稻幼穗的这些细胞分子功能、细胞组分和生物学过程发生了变化。
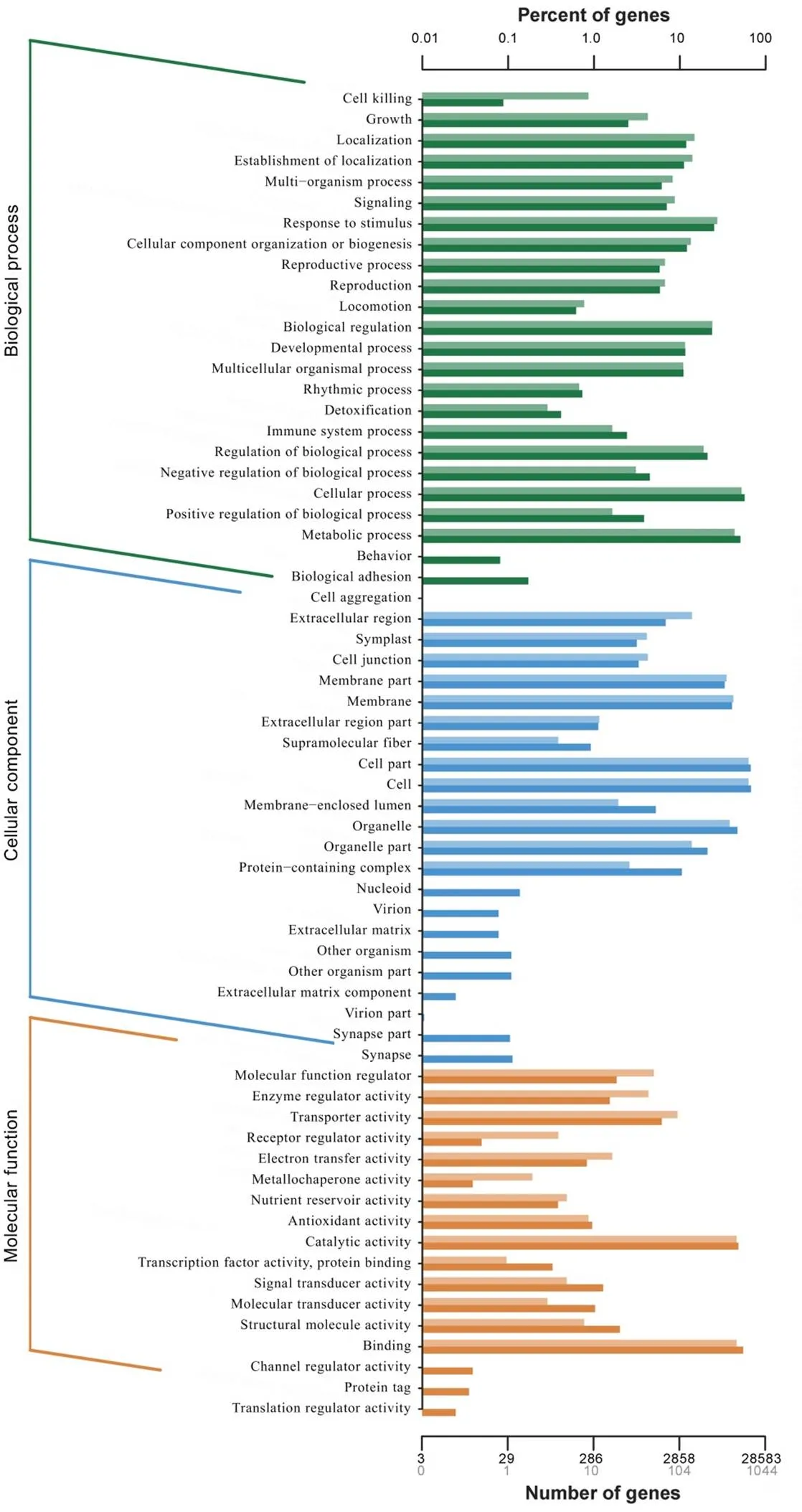
纵轴为功能分类; 横轴为该分类内基因个数(下)及其占被注释上基因总数的百分比(上)。不同颜色代表不同的分类。柱状图和坐标轴上浅色代表差异基因,深色代表所有基因。
Fig. 3. GO function classification of DEGs.
2.5 差异表达基因的KEEG代谢途径富集分析
为了分析在稻曲菌毒素胁迫下水稻幼穗发育过程中体内代谢通路发生的变化,对差异基因进行KEGG分类统计,发现差异表达基因涉及细胞过程(cellular processes)、环境信息处理(environmental information processing)、代谢(metabolism)、生物体系统(organismal systems)等5个大类以及32个通路(图4)。这些差异表达基因显著富集的通路主要是淀粉和蔗糖代谢(Starch and sucrose metabolism,KO00500)、苯丙类生物合成(Phenylpropanoid biosynthesis,KO00940)、碳代谢(Carbon metabolism,KO01200)、植物激素信号转导(Plant hormone signal transduction,KO04075)、植物-病原体相互作用(Plant-pathogen interaction,KO04626)、糖酵解/糖异生(Glycolysis / Gluconeogenesis,KO00010)、氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism,KO00520)、氨基酸的生物合成(Biosynthesis of amino acids,KO01230)、氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism,KO00520)等(图5)。代谢途径分析表明,差异表达基因除了主要富集在与糖代谢相关的途径之外,还富集在与氨基酸和核苷酸代谢相关的途径上,说明稻曲菌毒素对植物的氨基酸代谢和核苷酸代谢有影响
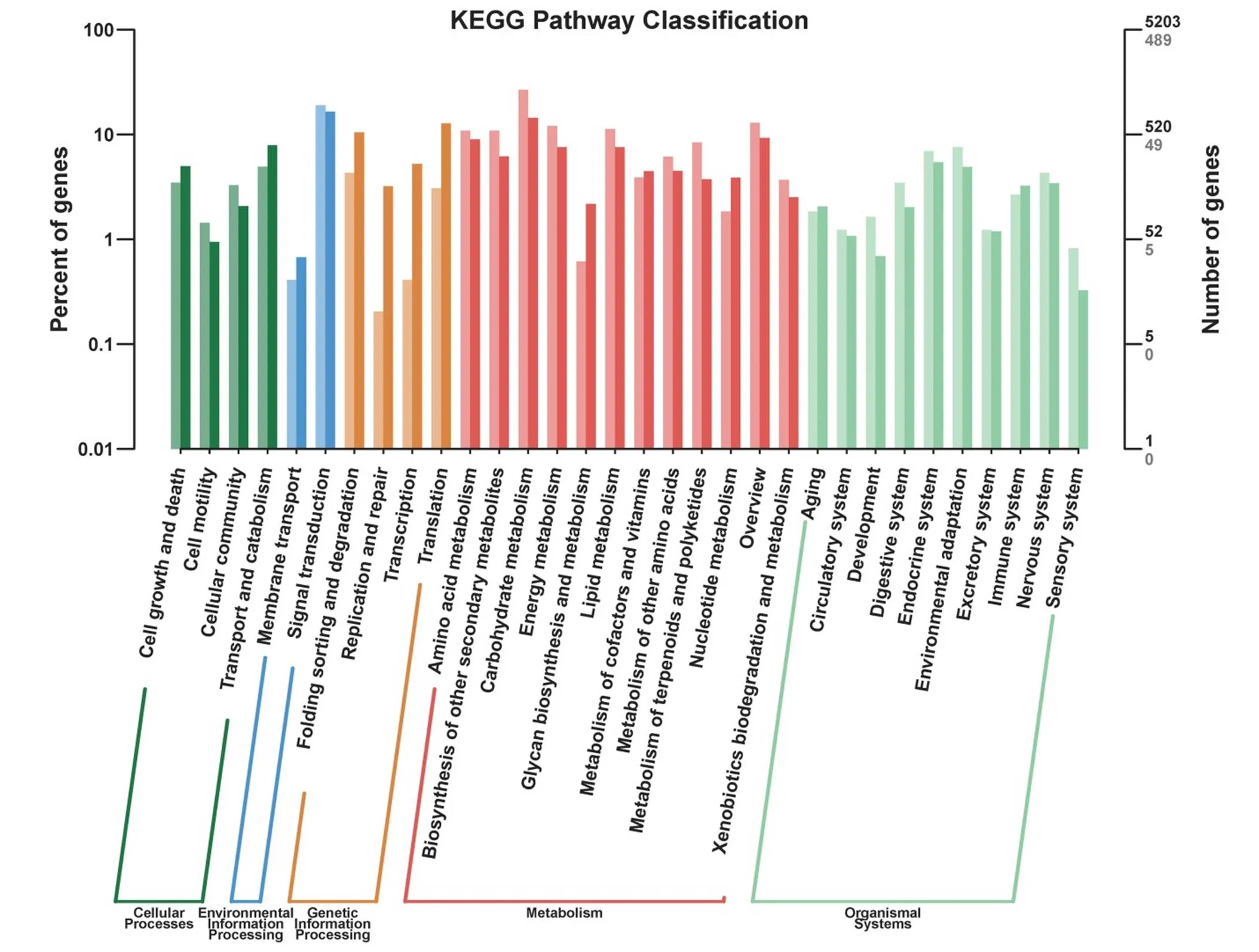
横轴代表的是不同的通路,左侧纵轴代表该通路内基因个数占被注释上基因总数的百分比(左),右侧纵轴代表基因数目(浅色字体代表差异基因,深色字体代表所有基因)。
Fig. 4. KEGG pathway classification of DEGs.
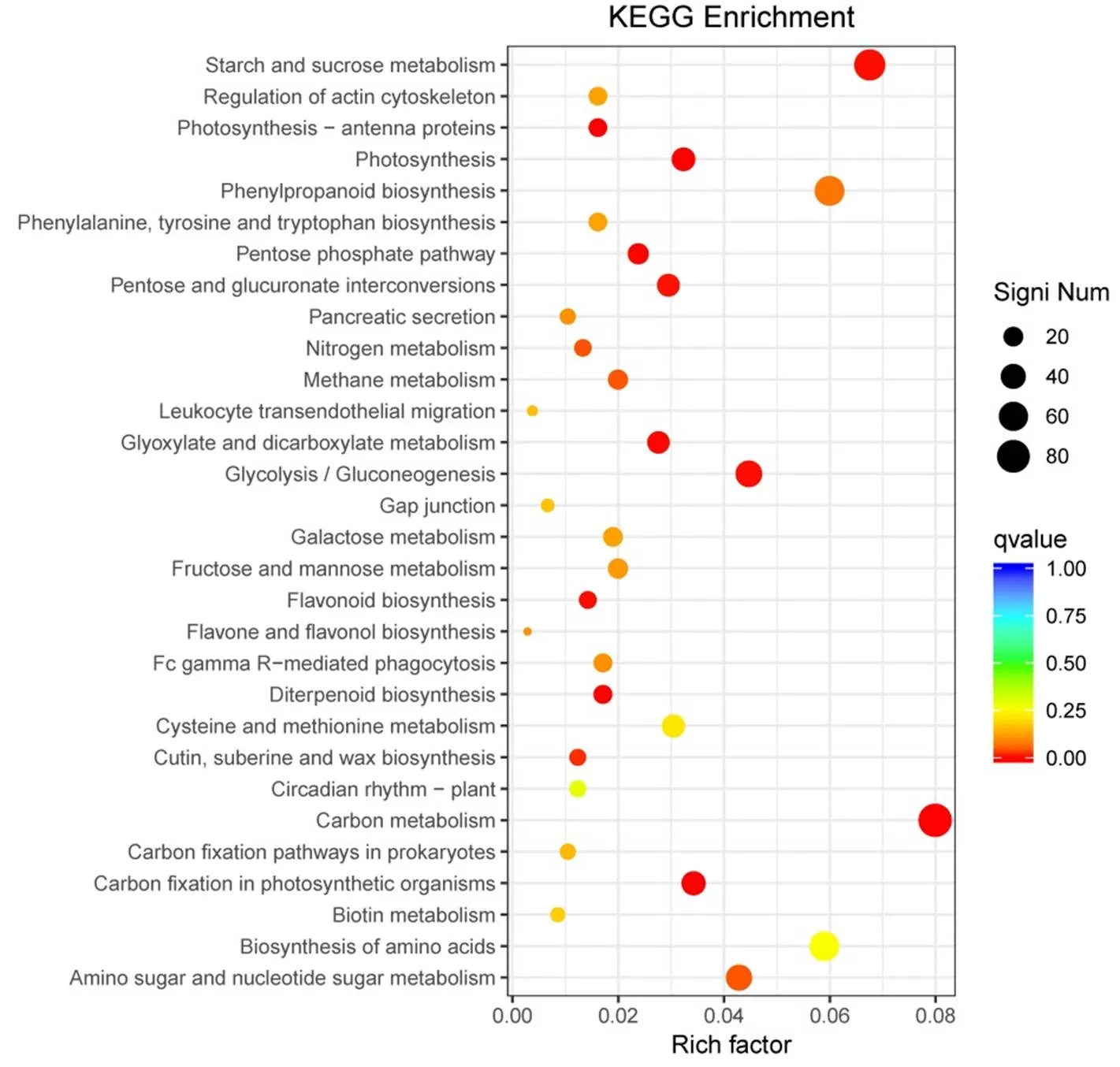
纵轴表示功能注释信息,横轴表示通路对应的富集因子(Rich factor), 富集因子越大,表示富集的程度越高。点的颜色表示q值的大小,q值越小则颜色越接近红色。点的大小表示每个条目下包含的差异基因的个数,点越大则基因越多(富集程度最高的前30个通路)。
Fig. 5. Scatter plot of enriched KEGG pathways for DEGs.
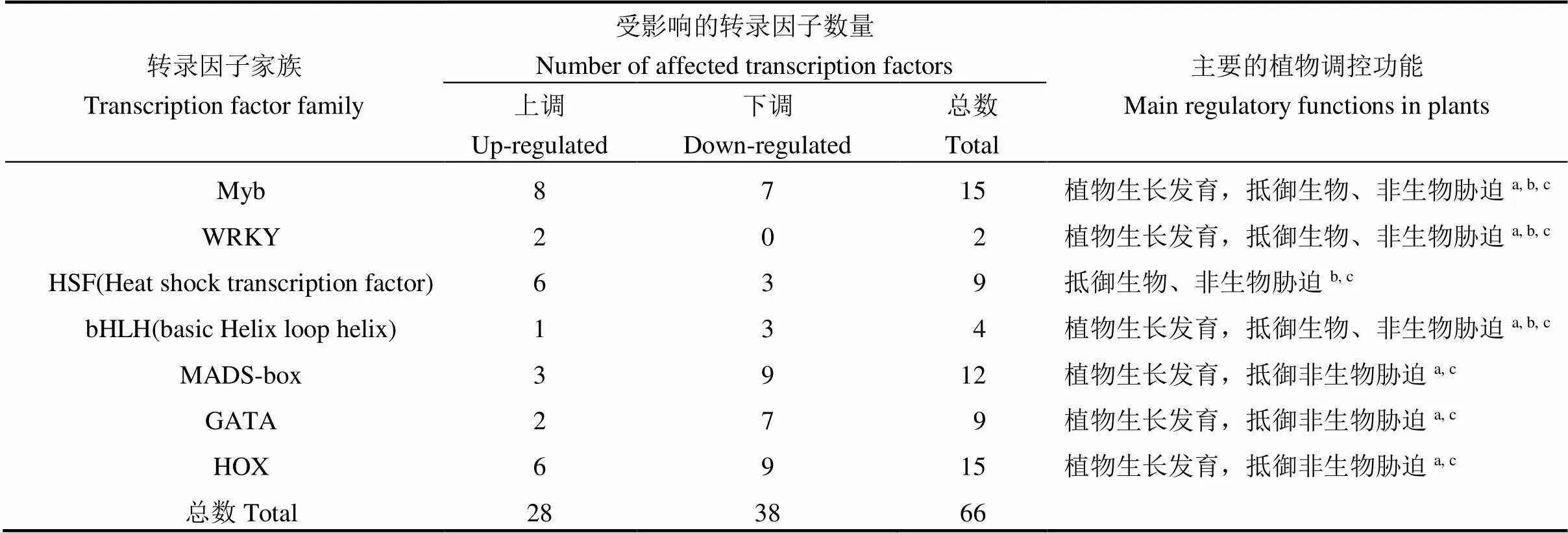
表2 稻曲菌毒素影响的植物转录因子
a, Regulation of plant growth and development;b, Plant resistance to biotic stresses;c, Plant tolerance to abiotic stresses.
2.6 差异表达基因的KOG功能注释分析
为了更好地了解幼穗在稻曲菌毒素胁迫下基因功能变化,对差异表达基因进行KOG功能注释分类,发现差异表达基因可注释到KOG数据库的23个类别(group)下。其中,主要注释到信号转导机制(Signal transduction mechanisms)、一般功能预测(general function prediction only)、次生代谢产物生物合成运输和分解代谢(secondary metabolites biosynthesis, transport and catabolism)、转译后的修改(posttranslational modification)、碳水化合物的运输和代谢(carbohydrate transport and metabolism)以及氨基酸的运输和代谢(amino acid transport and metabolism)等(图6)。在稻曲菌毒素胁迫下幼穗的信号转导系统立即作出响应,合成抗逆的次生代谢物质,增加水稻抗胁迫能力。
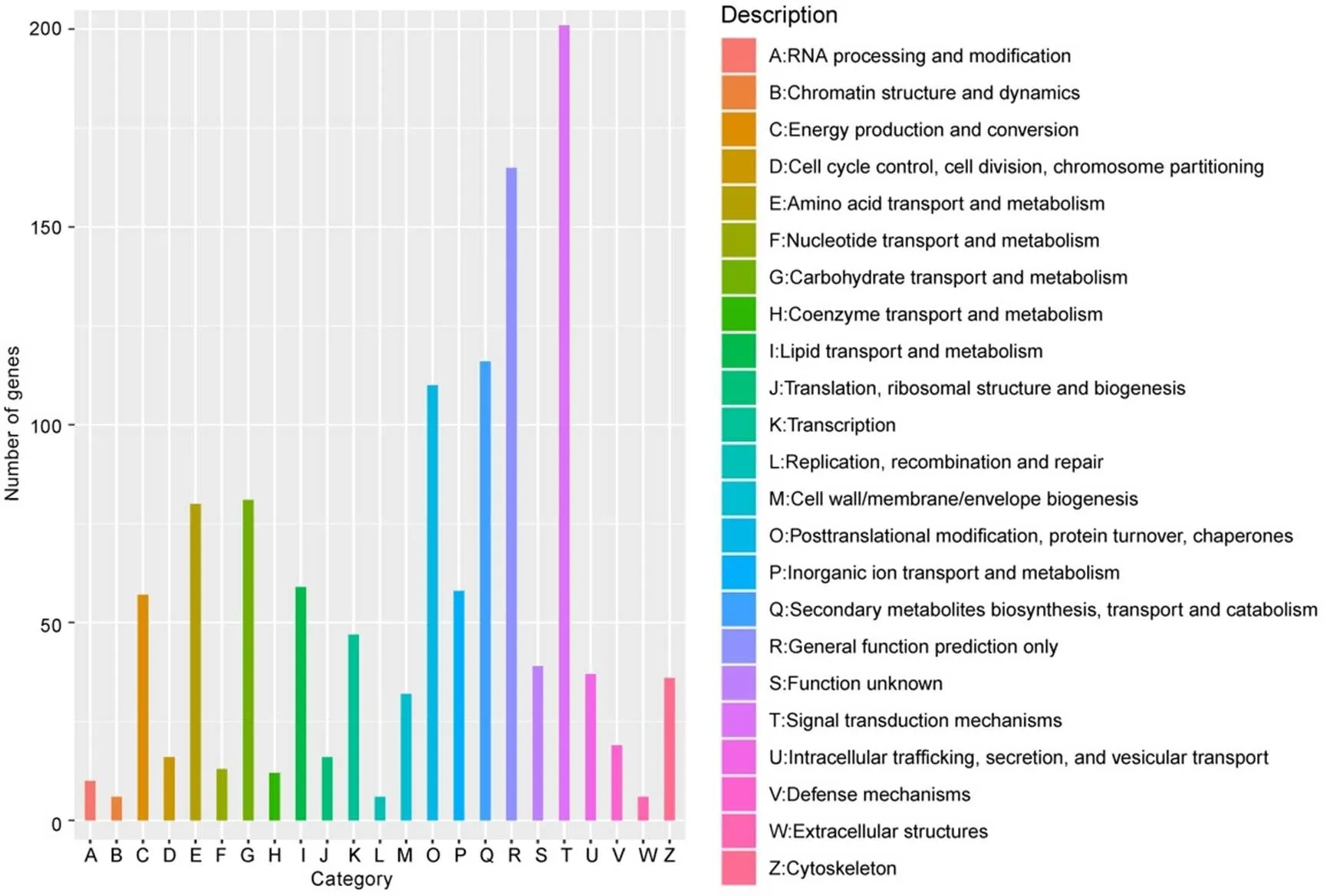
横轴每种颜色代表一个KOG的功能分类;纵轴为注释到该分类下的基因数目。
Fig. 6. KOG function classification of DEGs.
2.7 稻曲菌毒素处理早期幼穗差异表达基因分析
2.7.1 稻曲菌毒素对植物转录因子影响分析
对DEG分析发现,有66个植物转录因子基因表达量发生了变化,分属7种植物转录因子家族:Myb(binding proteins ofDNA)、WRKY、HSF(Heat shock transcription factor)、bHLH(basic Helix loop helix)、MADS-box、GATA、HOX(表2)。上述7种转录因子都参与植物对非生物胁迫调控,除HSF外其余6种都参与植物生长发育调控,除MADS盒、GATA和HOX外其余4种都参与植物对生物胁迫调控。这66个转录因子中有28个表达量上调,38个表达量下调。
WRKY转录因子是高等植物特有的一类转录因子,广泛参与调控多种生理代谢途径,其在植物-病原互作中发挥重要作用。研究表明,WRKY转录因子在水稻与真菌和细菌病原互作过程中扮演重要角色。本研究分析发现,稻曲菌毒素处理12 h后幼穗鉴定出2个基因(BGIOSGA004722和BGIOSGA007670)表达量发生了变化,且表达量均显著上调(图7)。结果表明,WRKY蛋白可能在毒素处理幼穗初期发挥关键正向调控,抵御毒素的胁迫作用。
家族转录因子是植物中最大的一类转录因子家族,广泛分布于植物中,主要参与植物生长发育、次生代谢反应、对生物和非生物胁迫的应答等。本研究发现,15个基因表达量发生了变化,其中8个基因(BGIOSGA006005、BGIOSGA014710和BGIOSGA037216等)表达量上调,7个基因(BGIOSGA035999和BGIOSGA001192)表达量下调(图7)。表明,稻曲菌毒素作为非生物因子对幼穗产生胁迫时,Myb转录因子对毒素的胁迫作出应答调节。

图7 WRKY和Myb的差异表达基因热图
Fig. 7. Heatmap for DEGs ofandgenes.
2.7.2 二萜类生物合成(Diterpenoid biosynthesis)中差异表达基因分析
通过分析二萜类合成途径中DEG,我们发现参与萜类植保素合成的2个关键基因(BGIOSGA008469)、(BGIOSGA015980)在稻曲菌毒素胁迫下显著上调,上调倍数分别为3.16和8.81;另外,6个细胞色素P450(Cytochrome P450)基因和2个铁/抗坏血酸盐氧化还原酶(Iron/ascorbate family oxidoreductases)基因也显著被诱导上调(图8)。因此,我们推测合成植保素过程中的2个关键基因和在植保素合成途径中参与水稻抗稻曲病菌毒素胁迫过程。
2.7.3 淀粉和蔗糖代谢中差异表达基因分析
分析淀粉和蔗糖代谢途径中差异表达基因时,发现富集到此途径中有41个DEG,其中34个DEG显著下调,主要包括1个淀粉酶基因(AMYC2, BGIOSGA023598)、1个β-呋喃果糖苷酶基因(Beta-fructofuranosidase,BGIOSGA016831)、2个β-葡萄糖酶基因(BGIOSGA037299、BGIOSGA011222)、2个糖基转移酶基因(Glycosyltransferase)、3个UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase, UGPase)、3个海藻糖-6-磷酸合成酶基因(TPS1)以及1个己糖激酶(Hexokinase)(图9),这些基因都与淀粉的合成密切相关。表明,稻曲菌毒素可通过下调水稻淀粉和蔗糖代途径中的一些关键酶基因表达,从而抑制淀粉的合成与积累,最终导致籽粒瘪壳。
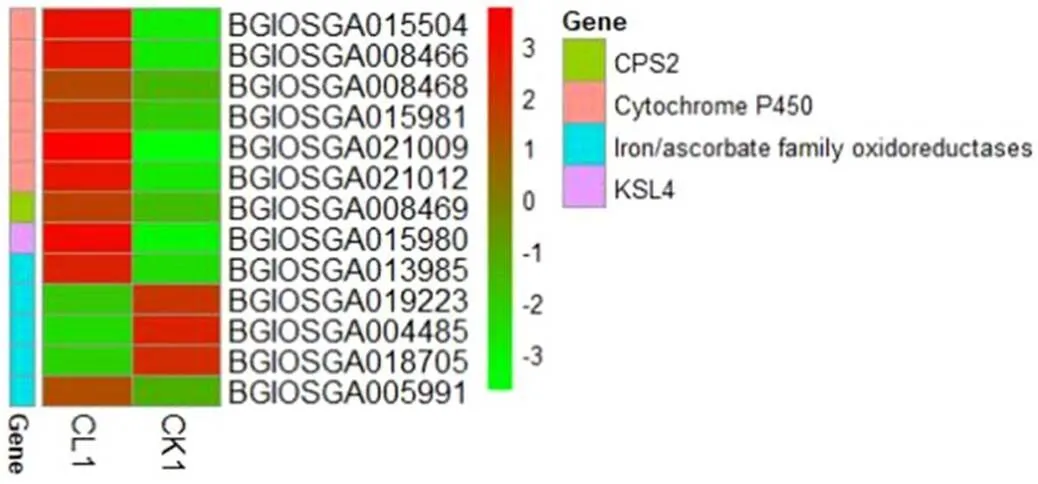
图8 二萜类生物合成途径差异基因分析热图
Fig. 8. Heatmap for DEGs analysis of diterpenoid biosynthesis pathway.

图9 淀粉和蔗糖代谢途径差异基因分析热图
Fig. 9. Heatmap for DEGs analysis of starch and sucrose metabolism.
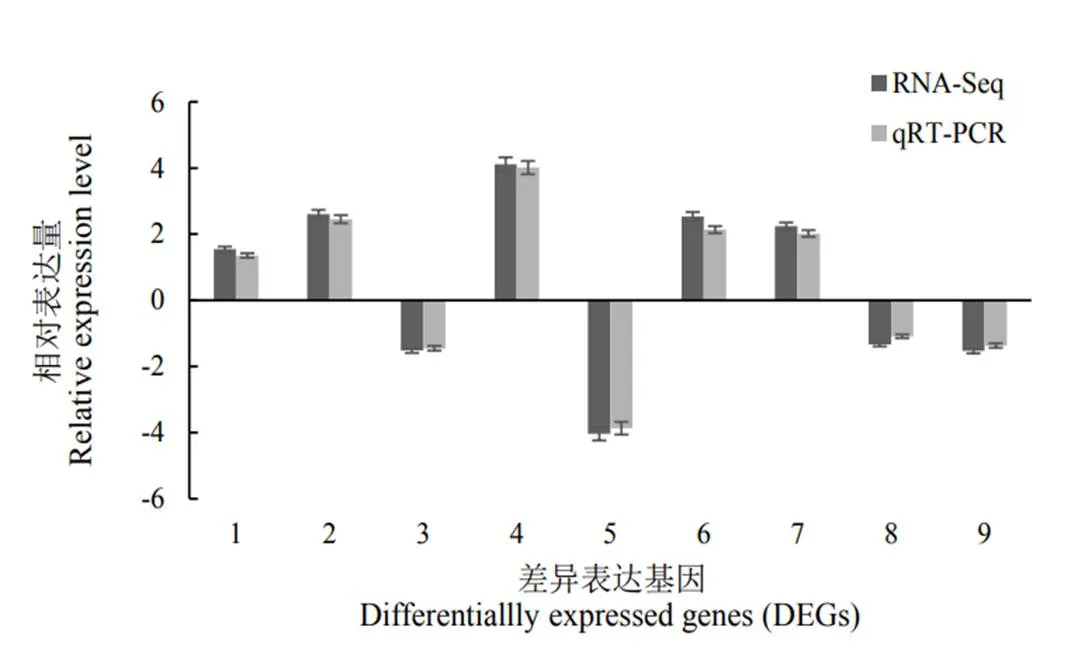
1-9:差异表达基因名称参照表3。
Fig. 10. Validation of DEGs using quantitative real time RT-PCR.
2.8 差异表达基因的qRT-PCR验证
为了验证转录组测序基因差异基因表达的可靠性,随机选取9个DEG,BGIOSGA007670(WRKY71)、BGIOSGA004722(WRKY24)、BGIOSGA004072(Myb)、BGIOSGA006005、BGIOSGA007245(UGPase)、BGIOSGA006087(几丁质酶)、BGIOSGA037333(Peroxidase)、BGIOSGA018719(SBEII)和BGIOSGA037531(NADPH oxidase)进行qPCR验证(引物列于表3)。由图10可看出qPCR测定的9个DEG的表达水平趋势与转录组测序基因的表达趋势是一致,表明本研究中得到的DEG是可信的。
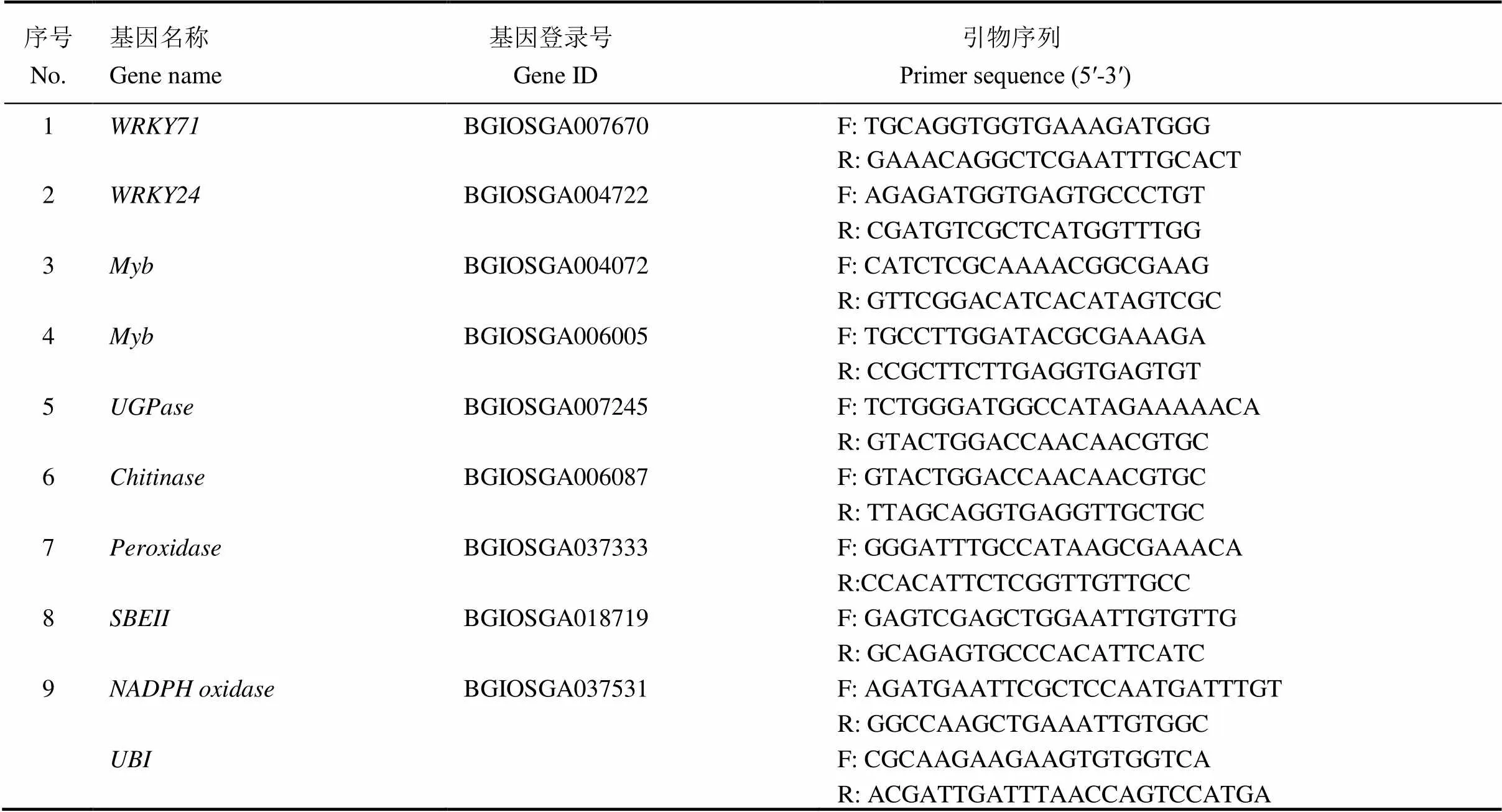
表3 qRT-PCR验证引物
3 讨论
植物病原菌毒素是病原菌生长或侵染宿主过程中产生的一种对植物有毒性的非酶类化合物,在病原菌定植过程中发挥着重要作用,是导致植物病害的主要因素之一[22]。迄今已报道了很多种类植物病原真菌毒素,如由链格孢属真菌产生的细交链孢菌酮酸[23]、禾谷镰孢镰菌产生的脱氧镰刀菌烯醇毒素[24]、黄曲霉菌产生的黄曲霉素[25]。水稻病原真菌除稻曲病菌外,另外两个重要真菌病害立枯丝核菌和稻瘟病菌也都会产生毒素[26-27]。不同的植物病原真菌毒素对植物产生不同的毒性效应和症状。Samuel和Valentine[28]发现黄曲霉毒素对芝麻叶绿素和类胡萝卜素合成具有显著抑制作用,此外,对芝麻种子萌发和幼苗生长有抑制作用。Aver’yanov等[29]发现细交链孢菌酮酸毒素可以诱导叶片上的小棕色坏死斑点,也可促使植物产生活性氧。稻曲病菌毒素可抑制玉米、小麦和水稻胚根和胚芽的生长[13-14]。本研究发现,稻曲病菌毒素可抑制水稻花器官发育,阻止子房发育,最终不能形成种子。
目前,已有多种真菌菌毒素被应用到抗病品种筛选或抗病突变体筛选抗性评价[30-31],然而稻曲病菌毒素在病原菌致病过程中所起作用尚不清楚,同时常规方法在稻曲病抗性评价上存在一定的局限性,这已成为水稻高抗稻曲病品种选育的主要制约因素之一。对稻曲病菌毒素进行深入研究可为深入阐明稻曲病菌的致病机制提供科学依据,为稻曲病抗病育种开辟新的途径。本研究采用转录组测序技术分析稻曲病菌毒素处理水稻幼穗12 h的差异表达基因和转录调控差异。我们发现稻曲病菌毒素处理12 h后,水稻幼穗中至少2526个基因的表达水平与对照样本中相差1倍以上。这些差异表达基因中有66个植物转录因子,其中包括WRKY和Myb两大重要植物转录因子。研究表明,WRKY转录因子和Myb转录因子在水稻与真菌和细菌病原互作过程中扮演重要角色[32-33]。Chao等[20]分析水稻-稻曲病菌互作的细胞学和转录组动力学时发现,水稻的和基因表达量上调。Han等[34]研究抗感水稻对稻曲病菌侵入早期反应转录组时发现,抗感水稻品种中的几个WRKY转录因子表达量存在差异。本研究鉴定出2个基因(BGIOSGA004722和BGIOSGA007670)表达量发生了变化,且表达量均显著上调;此外,鉴定出15个Myb基因表达量发生了变化,其中8个基因表达量上调。因此,稻曲病菌毒素作为非生物因子对幼穗产生胁迫时,WRKY和Myb转录因子对毒素的胁迫作出应答调节。
植物的二萜成分种类众多,其中二萜植保素在植物对病原体的防御机制中具有重要作用[35-36]。植物的二萜植保素合成有两种酶催化方式,一种是Ⅰ类二萜合酶(kaurene synthase like, KSL);另一种是Ⅱ类二萜合酶(copalyⅠ diphosphate synthase, CPS)[37]。韩彦卿等[38]研究水稻幼穗与稻曲病菌互作早期的转录组,分析发现3个植保素合成途径中的重要基因、和在抗病品种中被诱导上调表达。本研究发现2个植保素合成途径的中的重要酶基因和在稻曲病菌毒素处理后均被显著诱导上调表达。因此,推测稻曲病菌毒素在稻曲病菌致病过程中发挥着重要的致病作用,可以刺激水稻幼穗的植保素合成途径相关基因表达量上调,进而参与调控稻曲病抗性。
水稻种子中的淀粉合成是一个非常复杂的过程,有一系列与淀粉合成相关的基因和基因家族,包括淀粉酶、葡萄糖焦磷酸化酶、淀粉合成酶和葡萄糖-6-磷酸转化酶等[39-40]。不同的非生物胁迫对大米淀粉的合成和调控都有影响[41]。本研究发现,1个淀粉酶基因和3个UDP-葡萄糖焦磷酸化酶基因在稻曲病菌毒素处理12 h的幼穗中的表达量显著下调,此外,其他几个淀粉合成相关的基因表达量也被诱导下调。因此,推测稻曲病菌毒素通过下调水稻幼穗淀粉合成途径中一些关键酶基因来破坏淀粉积累。这一研究结果与稻曲病菌侵染时激活籽粒灌浆相关的基因不一致[42],这可能是因为稻曲病菌毒素作为非生物因素胁迫水稻,不同于稻曲病菌需要寄主提供营养来完成菌体本身的生活史,毒素直接作用于水稻,造成水稻幼穗伤害或导致死亡。因此,在利用稻曲病菌培养液接种水稻时,应该在接种前透析掉培养液中的毒素,提高接种成功率[11]。
[1] Tanaka E, Ashizawa T, Sonoda R, Sonoda R, Tanka C.gen. nov., comb. nov., teleomorph of,the causal agent of rice false smut[J]., 2008, 106(1): 491-501.
[2] Fan J, Yang J, Wang Y Q, Li G B, Li Y, Huang F, Wang W M. Current understanding on, a unique flower-infecting fungus causing rice false smut disease[J]., 2016, 17(9): 1321-1330.
[3] 伏荣桃, 王剑, 卢代华, 张鸿, 龚学书, 陈雪娟, 任鸿志, 毛建辉. 水稻稻曲病抗性鉴定技术及影响因子研究[J]. 中国农学通报, 2015, 31(18): 266-272.
Fu R T, Wang J, Lu D H, Zhang H, Gong X S, Chen X J, Ren H Z, Mao J H. Resistance identification and influence factor of rice false smut[J]., 2015, 31(18): 266-272. (in Chinese with English abstract)
[4] Hu M L, Luo L X, Wang S, Liu Y F, Li J Q. Infection processes ofduring artificial inoculation of rice panicles[J]., 2014, 139: 67-77.
[5] Meng J J, Sun W B, Mao Z L, Dan X, Wang X, Lu S, Yang L, Zhou L, Zhang G. Main ustilaginoidins and their distribution in rice false smut balls[J]., 2015, 7(10): 4023-4034.
[6] Lai D W, Meng J J, Zhang X P, Xu D, Dai J G, Zhou L G. Ustilobisorbicillinol A, a cytotoxic sorbyl-containing aromatic polyketide from[J]., 2019, 21(5): 1311-1314.
[7] Fu X X, Xie R S, Wang J. Development of colloidal gold-based lateral flow immunoassay for rapid qualitative and semi-quantitative analysis of ustiloxins A and B in rice samples[J]., 2017, 9(3): 79.
[8] Meng J J, Gu G, Dang P Q, Zhang X P, Wang W X, Dai J G, Liu Y, Lai D W, Zhou L G. Sorbicillinoids from the fungusand their phytotoxic, cytotoxic, and antimicrobial activities[J]., 2019, 7: 435.
[9] Li Y, Koiso Y, Kobayashi H, Hashimoto Y, Iwasaki S. Ustiloxins, new antimitotic cyclic peptides: Interaction with porcine brain tubulin[J].,1995, 49(10): 1367-1372.
[10] Hu Z, Dang Y, Liu C S, Zhou L, Liu H. Acute exposure to ustiloxin A affects growth and development of early life zebrafish,[J]., 2019, 226: 851-857.
[11] 陈美军, 胡东维, 徐颖. 稻曲病菌毒素的活性测定、抗体制备与细胞定位[J]. 实验生物学报, 2004, 37(4): 310-314.
Chen M J, Hu D W, Xu Y. Activity assay, antiserum preparation and cellular localization of ustiloxins[J]., 2004, 37(4): 310-314. (in Chinese with English abstract)
[12] Hamed K A, Wayne T S, Cartwright R D, Sciumbato G L.infection of rice in Arkansas: Toxicity of false smut galls, their extracts and the ustiloxin fraction[J]., 2014, 5(21): 3166-3176.
[13] Wang X H, Wang J, Lai D W, Wang W X, Liu Y. Ustiloxin G, a new cyclopeptide mycotoxin from rice false smut balls[J]., 2017, 9(2): 54-63.
[14] Fu R T, Wang J, Chen C, Gong X S, Lu D H. Effect of crude toxins ofon rice seed germination[J]., 2017, 11(32): 1267-1273.
[15] Luduena R F, Roach M C, Prasad V. Interaction of ustiloxin A with bovine brain tubulin[J]., 1994, 47(9): 1593-1599.
[16] 武斌, 温雪玮, 李衫衫, 胡东维, 梁五生. 稻曲病菌毒素对水稻幼根转录组的影响[J]. 农业生物技术报, 2018, 26(7):1093-1106.
Wu B, Wen X W, Li S S, Hu D W, Lang W S. Influences of mycotoxins ofon the transcriptome of rice () seedling roots[J]., 2018, 26(7): 1093-1106. (in Chinese with English abstract)
[17] Yuan Z, Zhang Y, Xu G,Bi D, Qu H, Zou X, Gao X, Yang H, He H, Wang X, Bao J, Zuo S, Pan X, Zhou B, Wang G, Qu S. Comparative transcriptome analysis of-resistant and -susceptible rice cultivars reveals the importance of pathogen recognition and active immune responses in host resistance[J]., 2018, 61(3):143-158.
[18] 楚乐乐, 罗成科, 李芳兰, 路旭平, 马天利, 李培富. 盐胁迫下RNAi转基因水稻的生理特性及转录组学分析[J].植物遗传资源学报, 2020, 21(4): 954-965.
Chu L L, Luo C K, Li F L, Lu X P, Ma T L, Li P F. Analysis of the physiological characteristics and transcriptome profiles ofRNAi transgenic rice under salt stress[J]., 2020, 21(4): 954-965. (in Chinese with English abstract)
[19] Benjamini Y, Yekutieli D. The control of the false discovery rate in multiple testing under dependency[J].,2001, 29(4): 1165-1188.
[20] Chao J, Jin J, Wang D, Han R, Zhu R S, Zhu Y G, Li S Q, Sun M X. Cytological and transcriptional dynamics analysis of host plant revealed stages specific biological processes related to compatible riceinteraction[J]., 2014, 9(3): e91391.
[21] Livak K J, Schmittgen T D. Analysis of relative gene expression data using realtime quantitative PCR and the 2−ΔΔCTmethod[J]., 2001, 25(4): 402-408.
[22] Ismaiel A, Papenbrock J. Mycotoxins: Producing fungi and mechanisms of phytotoxicity[J].2015, 5: 492-537.
[23] Janardhanan K K, Husain A. Phytotoxic activity of tenuazonic acid isolated from(Fr.) Keissler causing leaf blight ofMill. and its effect on host metabolism[J]., 1984, 111(3-4): 305-311.
[24] McLean M. The phytotoxicity of Fusarium metabolites: An update since 1989., 1996, 133: 163-179.
[25] Ismaiel A A, Tharwat N A. Antifungal activity of silver ion on ultrastructure and production aflatoxin B1 and patulin by two mycotoxigenic strains, Aspergillus flavus OC1 andCM1[J].2014, 24(3): 193-204.
[26] Fujita K, Arase S, Hiratsuka H, Honda Y, Nozu M. The role of toxin(s) produced by germinating spores ofin pathogenesis[J]., 1994, 142(3-4): 245-252.
[27] Vidhyasekaran P, Ruby Ponmalar T, Samiyappan R, Velazhahan R, Muthukrishnan S. Host-specific toxin production by, the rice sheath blight pathogen[J]., 1997, 87(12): 1258-1263.
[28] Samuel A T, Valentine I T. Effect of total aflatoxin on the growth characteristics and chlorophyll level of sesame (L.)[J]., 2014, 7: 8-13.
[29] Aver’yanov A A, Lapikova V P, Lebrun M H. Tenuazonic acid, toxin of rice blast fungus, induces disease resistance and reactive oxygen production in plants[J]., 2007, 54: 749-754.
[30] 齐俊生, 李怀方. 一种检测棉花黄萎菌毒素致萎性的新方法: 叶片针刺涂抹法[J]. 棉花学报, 2006, 18(4): 228-232.
Qi J S, Li H F. A new detection method of wilting induction by phytotoxin fromon cotton through leaf pricking and spreading[J]., 2006, 18(4): 228-232. (in Chinese with English abstract)
[31] 杨艳丽, 肖浪涛, 胡先奇. 马铃薯晚疫病菌与寄主品种抗性关系研究. 中国农业科学, 2009, 42(6): 2202-2210.
Yang Y L, Xiao L T, Hu X Q. Study on the relationship between the toxin ofand resistance of potato[J]., 2009, 42(6): 2202-2210. (in Chinese with English abstract)
[32] Ambawat S, Sharma P, Yadav N R. MYB transcription factor genes as regulators for plant responses: An overview[J]., 2013, 19(3): 307-321.
[33] Wang Y M, Kwon S J, Wu J N, Choi J Y, Lee Y H, Agrawai G K, Tamogami S, Rakwal R, Park S R, Kim B G, Jung K H, Kang K Y, Kim S G, Kim S T. Transcriptome analysis of early responsive genes in rice duringinfection[J]., 2014, 30(4): 343-354.
[34] Han Y Q, Zhang K, Yang J, Zhang N, Zhang Y, Liu Y F, Chen Z Y, Hsiang T, Sun W X. Differential expression profiling of the early response tobetween false smut resistant and susceptible rice varieties[J]., 2015, 16: 955.
[35] 张艺丹, 曾英, 卢山. 水稻二萜合成途径中代谢流调控机制研究进展[J]. 植物生理学报, 2019, 55(12): 1762-1768.
Zhang Y D, Zeng Y, Lu S. Recent progress in the study of metabolic flux regulation in rice diterpene biosynthesis[J]., 2019, 55(12): 1762-1768. (in Chinese with English abstract)
[36] Peters R J. Uncovering the complex metabolic network underlying diterpenoid phytoalexin biosynthesis in rice and other cereal crop plants[J]., 2006, 67: 2307-2317
[37] Zi J, Mafu S, Peters R J. To gibberellins and beyond Surveying the evolution of (di)terpenoid metabolism[J]., 2014, 65: 259-286.
[38] 韩彦卿, 韩渊怀, 张春来, 孙文献. 水稻幼穗与互作早期的转录组分析[J]. 植物病理学报, 2019, 49(3): 296-305.
Han Y Q, Han Y H, Zhang C L, Sun W X. Transcriptomic analysis of early interaction between rice young spikelets and[J]., 2019, 49(3): 296-305. (in Chinese with English abstract)
[39] 彭波, 彭宇, 彭娟, 孔冬艳, 何璐璐, 孙艳芳, 黄雅琴, 宋世枝. 水稻种子主要营养物质合成及调控研究与展望. 热带作物学报, 2018, 39(6): 1241-1251.
Peng B, Peng Y, Peng J, Kong D M, He L L, Sun Y F, Huang Y Q, Song S Z. Research advancement and prospects of main nutritious substances synthesis and regulation in rice seeds[J]., 2018, 39(6): 1241-1251. (in Chinese with English abstract)
[40] Thitisaksakul M, Jiménez R C, Arias M C, Beckles D M. Effects of environmental factors on cereal starch biosynthesis and composition[J]., 2012, 56(1): 67-80.
[41] Fujita N. Starch biosynthesis in rice endosperm[J]., 2014, 4(1): 1-18.
[42] Fan J, Yang L, Zheng A P, Wang W M, Guo X Y, Li L, Huang F, Sun W X, Yan L, Huang Y Y. Infection ofintercepts rice seed formation but activates grain-filling-related genes[J]., 2015, 57(6): 577-590.
Transcriptome Analysis of Young Rice Panicles in Early Response to Exposure to Mycotoxin of
FU Rongtao1, 2, WANG Jian1, 2, CHEN Cheng1, 2, ZHAO Liyu1, CHEN Xuejuan1, LU Daihua1, 2, *
(1Institute of Plant Protection, Sichuan Academy of Agricultural Science, Chengdu 610066, China;2Key Laboratory of Integrated Pest Management on Crops in Southwest, Ministry of Agriculture Science, Chengdu 610066, China;*Corresponding author, email: daihlfrt@126.com)
【Objective】Rice false smut caused bynot only leads to rice yield loss, but also produces mycotoxins which is toxic to animals and plants. In order to elucidate the molecular mechanism behindthe response to exposure to mycotoxin the young panicles of rice were mycotoxin-treated withmycotoxin, which may provide a new idea for exploring rice false smut resistance genes and molecular breeding for disease resistance.【Method】Transcriptome sequencing was performed with mycotoxin-treated young panicles as materials. The genome of 9311 was used as the reference genome to align the sequences. The expression level of genes was calculated by the term of Transcripts Per Million (TPM). According to the database, the differentially expressed genes were screened by parameters (|LOG2fold change|≥1 and-value≤0.05). Combined with differential expression analysis and function annotation, the key genes in response to mycotoxin were identified in rice panicles. The differentially expressed genes were verified by qRT-PCR.【Result】2526 differentially expressed genes (DEG)were identified in young panicles of rice after 12 h treated with mycotoxin. Through GO enrichment, KEGG metabolic pathway and KOG function analysis, the DEGs were divided into 64 terms under GO function, 32 metabolic pathways and 23 categories under KOG function,including starch and sucrose metabolism, phenylpropyl biosynthesis, carbon metabolism, glycolysis/gluconeogenesis, amino sugar and nucleoside sugar metabolism and other biological processes.There were 66 plant transcription factors in DEGs, which belonged to 7 family of plant transcription factors, including WRKY and Myb. The expression levels of,and cytochrome P450 were up-regulated, while the expression levels of amylase, beta-fructofuranosidase and UGPase were down-regulated when we analyzed genes involved in diterpenoid biosynthesis and starch and sucrose metabolism pathways. Therefore, it is speculated that these genes play an important role in rice response to mycotoxin ofstress. 【Conclusion】As an abiotic stress factor, mycotoxin ofhad a toxic effect on young panicles of rice. It affects the synthesis of nutrients in seeds by interfering with metabolism of starch and sucrose, and thus reduces the resistance of rice to pathogen infection.
rice;; mycotoxin; transcriptome analysis
10.16819/j.1001-7216.2022.210714
2021-09-06;
2021-11-10。
四川省科技计划资助项目(2021YFYZ0021, 2022YFYZ0002);四川省财政农作物“卡脖子”技术攻关计划资助项目(2021ZYGG-002);四川省财政自主创新专项(2022ZZCX020)。

