水杨酸通过一氧化氮途径调控水稻缓解低磷胁迫
朱春权 魏倩倩 党彩霞 黄晶 徐青山 潘林 朱练峰 曹小闯 孔亚丽项兴佳 刘佳 金千瑜 张均华,*
水杨酸通过一氧化氮途径调控水稻缓解低磷胁迫
朱春权1, #魏倩倩1, 2, #党彩霞3黄晶1徐青山1潘林1朱练峰1曹小闯1孔亚丽1项兴佳2刘佳4金千瑜1张均华1,*
(1中国水稻研究所 水稻生物学国家重点实验室,杭州 310006;2安徽大学,合肥 230039;3宜宾学院,湖北 宜宾 644000;4江西省农业科学院,南昌 330200;#共同第一作者;*通信联系人,email: zhangjunhua@caas.cn)
【目的】深入剖析水杨酸调控水稻低磷胁迫响应的生理与分子机制具有重要意义。【方法】选取常规水稻品种日本晴,外源添加水杨酸后测定水稻体内总磷含量、酸性磷酸酶活性、木质部汁液磷含量、水稻根系特征参数、磷转运子基因表达水平和一氧化氮含量等指标解析水杨酸缓解水稻缺磷胁迫的生理和分子机制。【结果】1)水杨酸对水稻磷吸收的调控存在剂量效应,1 μmol/L水杨酸显著提高低磷条件下水稻体内总磷含量,5 μmol/L水杨酸则降低水稻体内总磷含量。2)低磷条件下,1 μmol/L水杨酸使酸性磷酸酶活性提高了11.35%,根系总长增加了20.90%,根系表面积增加11.86%,根系体积增加了15.38%,总根数增加了23.55%,木质部汁液中的磷含量提高了22.67%。同时,1 μmol/L水杨酸提高了水稻根系磷转运子基因的表达,从而提高水稻对外界磷的吸收和体内磷的转运。3)水杨酸通过提高硝酸还原酶的活性增加水稻根系的一氧化氮含量,从而通过调控磷转运子基因的表达提高低磷条件下水稻对外界磷的吸收。【结论】水杨酸与信号分子一氧化氮互作缓解低磷胁迫。
水稻;磷;水杨酸;吸收和转运;基因;一氧化氮
磷是植物体内ATP、细胞膜、核酸、酶等物质的重要组成成分,其含量约占植物干质量的0.05%~ 0.5%,同时,磷参与植物光合作用、呼吸作用、酶促反应等过程[1, 2]。然而,我国耕地土壤中磷含量普遍较低,虽然生产上常用增施磷肥的方式保证作物正常的磷需求,但磷肥施入土壤后除了易被土壤微生物转化为有机磷外,还会被土壤颗粒和土壤中的阳离子固定形成难溶的无机磷,导致施入土壤中的磷肥并不能被作物完全利用。据统计,磷肥的当季利用率仅为15%左右[1, 2]。植物缺磷后,其光合磷酸化水平下降,光合速率降低,最终抑制作物生长,导致产量下降[3]。长期进化过程中,植物形成了一系列耐低磷机制响应外界的缺磷胁迫。比如,植物可以通过增加其侧根数量、根毛长度和密度提高对外界磷的吸收,从而增强耐低磷胁迫能力[4];植物体还可以通过向外分泌苹果酸、柠檬酸等有机酸使土壤中的固态磷溶解,或是通过分泌酸性磷酸酶将体外有机态磷转化为有效磷等方式提高植物体对外界磷的吸收[5]。除此之外,植物还会通过绕过需要磷的生理步骤[6],释放水稻根系细胞壁中结合态磷[7],提高细胞膜中不含磷的硫醇和甾醇的含量,减少磷脂含量[8],从而最终增加植株可利用磷的含量。
水杨酸(salicylic acid,SA)作为信号分子,在植物发育和调控植物响应生物或非生物胁迫过程中发挥调节功能[9],比如提高植物光合速率,调节植物气孔闭合[10-12],提高植物耐铝胁迫[13]、耐低温胁迫[14,15]等。目前,水杨酸调控植物响应养分胁迫的研究较少。前期有研究发现,外源添加水杨酸后,与植物氮、钾和硫吸收转运相关基因的表达会发生变化,暗示水杨酸可能参与调控植物养分吸收和转运。同时,有研究发现,在大麦中,水杨酸对磷的吸收存在抑制作用[16],然而,在甜菜和玉米中,外源添加水杨酸不仅可以通过溶解土壤中的磷来提高植物对外界磷的吸收,还能直接提高逆境条件下植物对磷的吸收[17,18]。因此,水杨酸对植物磷吸收的不同调控作用是否与外源水杨酸的浓度相关,在不同种类植物中是否存在不同的调控作用值得进一步研究。
一氧化氮(nitric oxide,NO)是植物体内普遍存在的气体信号分子,除广泛参与调节植物的气孔关闭、种子萌发等生理活动外,还参与调控植物缓解各类非生物胁迫[19]。比如,外源施加硝普钠(SNP)提高了植物体内抗氧化系统酶活性和光合系统效率,并且减少砷在植物体内的积累[20]。外源添加一氧化氮清除剂c-PTIO显著降低水稻体内的磷含量,说明一氧化氮参与调控水稻磷吸收[21]。同时,外源添加一氧化氮的前体物质硝普钠显著提高了水稻根系的果胶含量和果胶甲酯酶活性,从而促进了水稻根系细胞壁磷的再利用,此外,一氧化氮还通过提高磷转运子基因和的表达增强水稻磷吸收[22]。除此之外,在调节植物生长发育和调控植物应对非生物胁迫过程中,一氧化氮常与植物激素水杨酸互相作用。比如促进种子萌发,增强植物光合作用,缓解植物水分胁迫、重金属胁迫和高温胁迫等[23]。
低磷胁迫是限制水稻产量与品质的重要因素。虽然前人对水杨酸参与调控植物应对逆境胁迫有较多的研究,但水杨酸信号是否参与调节水稻响应低磷胁迫还需进一步研究。本研究选用常规水稻品种日本晴作为供试材料,通过外源添加水杨酸,在正常磷和低磷胁迫下测定水稻地上部和根系磷含量变化与生理变化,探究水杨酸调控水稻响应低磷胁迫的生理和分子机制,从而为提高实际生产中水稻磷的利用率提供理论参考。
1 材料与方法
1.1 试验设计
采用水培方法,选择常规粳稻品种日本晴作为实验材料。将水稻种子浸泡后在铺有滤纸的培养皿上催芽,待水稻种子露白后移入1/2的木村培养液继续培养,待水稻长至两叶一心期后进行处理。营养液中包含0.5 mmol/L NH4NO3, 0.18 mmol/L KCl, 0.36 mmol/L CaCl2, 0.6 mmol/L MgSO4·7H2O, 9 mmol/L MnCl2·4H2O, 0.1 mmol/L Na2MoO4·4H2O, 10 mmol/L H3BO3, 0.7 mmol/L ZnSO4·7H2O, 0.3 mmol/L CuSO4和20 mmol/L FeSO4·7H2O-EDTA。使用NaH2PO4·2H2O作为磷源,其中正常磷处理为180 mmol/L,低磷处理为18 mmol/L。为筛选合适的水杨酸浓度,设置三个水杨酸浓度:0、1、5 μmol/L,水杨酸直接添加在培养液中。水稻培养在光照培养间中,条件为白天12 h、28℃,晚上12 h、22℃,光照强度为400 μmol/(m2·s),相对湿度为65%。每3 d换一次营养液,换完营养液后同时添加水杨酸。根据水稻体内的总磷含量确定合适的水杨酸浓度为1 μmol/L,然后进行后续试验(分别标记为P,P+SA,LP和LP+SA)。
在后续与一氧化氮互作试验中,处理分别为P,P+SA+cPTIO,LP,LP+SA+cPTIO。其中,cPTIO的浓度为1 μmol/L,直接添加在培养液中。正常磷和低磷的浓度与前面的处理一致。
1.2 水杨酸含量测定
水杨酸含量采用高效液相色谱-串联质谱测定。将1 g植物鲜样用液氮研磨后加入10 mL提取液(异丙醇∶水∶盐酸,2∶1∶0.002,/),进一步提取离心后过0.22 μm滤膜,然后将最终提取液注入高效液相色谱-质谱(HPLC-MS/MS)串联分析仪进行测定[24,25]。
1.3 总磷的提取和测定
收集水稻根系和地上部装入信封,在105 ℃烘箱中杀青30 min后,取出植物样本,再放入75 ℃烘箱中烘干至恒重。称取烘干后的水稻地上部和根干质量,用过氧化氢(H2O2)和浓H2SO4进行消煮,待其冷却后用超纯水定容,然后用钼蓝比色法测定水稻总磷含量[1]。
1.4 酸性磷酸酶活性测定
取水稻根系鲜样,称量,在液氮中研磨,然后用0.2 mmol/L醋酸钠缓冲液提取根系酸性磷酸酶。将反应液(0.2 mmol/L, pH 5.8的醋酸钠缓冲液,内含0.5 g/L对硝基苯磷酸二钠)与酶粗提液混合并摇匀,在37℃水浴保温30 min,加入6 mol/L的NaOH以终止酶促反应,用紫外可见分光光度计在400 nm波长下比色。酸性磷酸酶活性通过单位时间内单位质量的根催化对硝基苯磷酸二钠生成对硝基苯酚的量来表示[1]。
1.5 木质部汁液磷的提取与测定
切断水稻根上部2 cm处,持续2 h用移液器吸取流出的伤流液。将同一处理中吸取的伤流液放入同一个离心管中并记录伤流液体积,然后将伤流液适当稀释后用电感耦合等离子体(ICP)测定木质部汁液磷含量[1]。
1.6 水稻根系构型参数测定
将水稻根系剪下后平铺在有水的塑料盘中,使用EPSON 10000XL扫描仪扫描获得水稻根系的图片。然后利用WinRHIZO根系分析系统(加拿大Regent仪器公司)计算根系的总根长、总表面积、平均直径、总体积和根尖数等指标[1]。
1.7 水稻硝酸还原酶和一氧化氮合酶活性测定
采用磺胺比色法测定水稻硝酸还原酶活性,根据单位时间内亚硝态氮生成量计算硝酸还原酶的活性[26, 27]。
采用荧光比色法测定水稻一氧化氮合成酶(NOS)活性,根据单位时间产生的一氧化氮与N-乙酰半胱氨酸相互作用生成硝基N-乙酰半胱氨酸的量计算NOS酶活[28]。
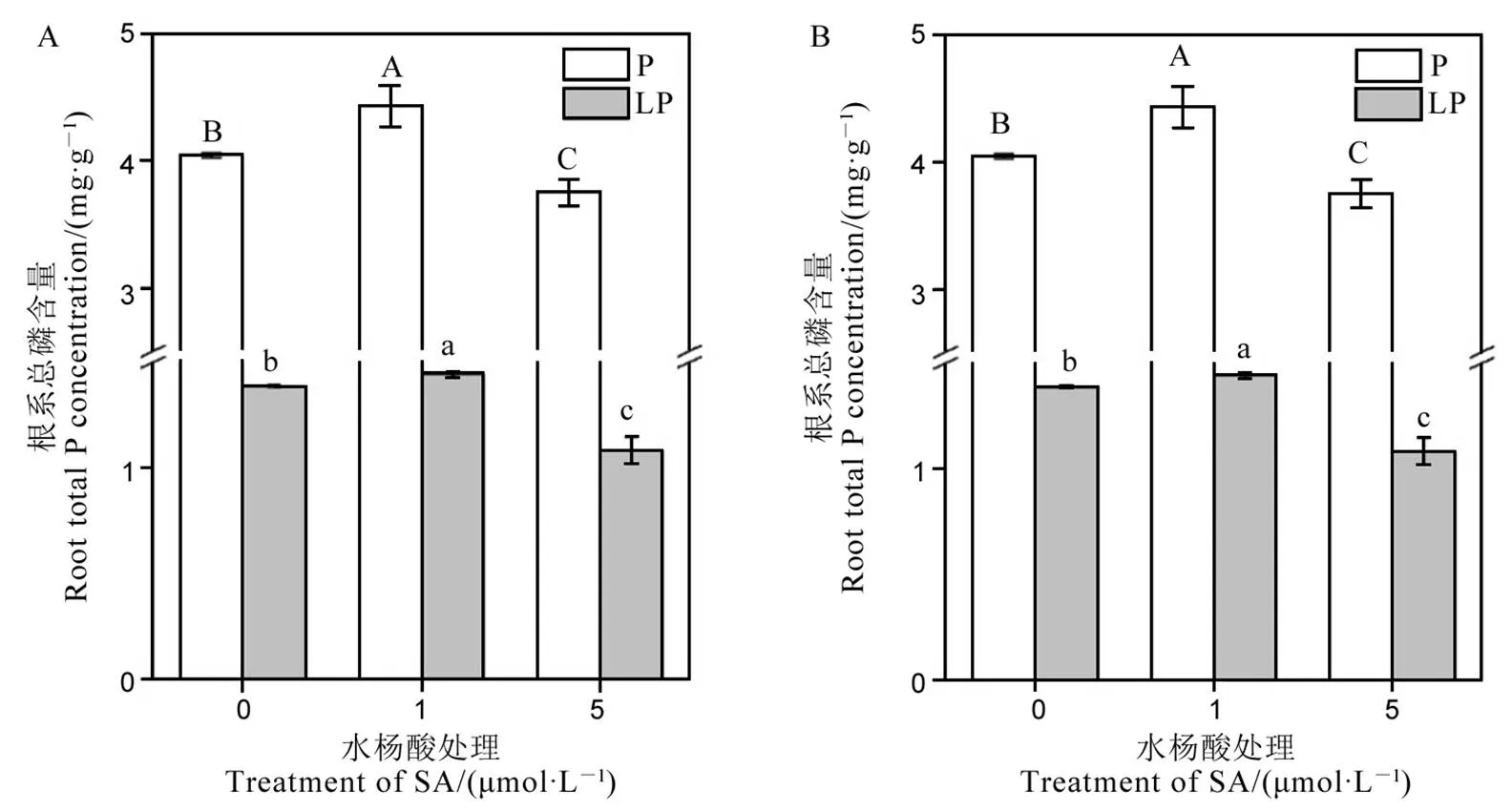
数据用均值±标准差(n = 4)表示。不同的大小写字母代表处理间差异分别在P < 0.01和P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L。
Fig. 1. P contents in roots(A) and shoots (B) under low and normal P levels.
1.8 水稻根系RNA提取和基因表达量测定
水稻根系鲜样取样后用液氮进行研磨,然后用TRizol提取总RNA,用PrimeScript反转录试剂盒进行RNA的反转录,用Sybgreen(TaKaRa,日本)进行实时荧光定量PCR,基因的引物序列和内参基因的引物序列均参考文献[1]。
1.9 数据统计分析
每个实验均含有4个生物学重复。单因素方差分析采用SPSS 21.0.0软件进行,均数采用Tukey检验统计学差异。图表上不同的字母表示平均值在<0.05水平上有统计学差异。
2 结果与分析
2.1 水杨酸对水稻磷吸收的影响
外源添加1 μmol/L的水杨酸后,在正常磷浓度和缺磷条件下,水稻地上部和根部的总磷含量均显著提高(图1)。然而,外源添加5 μmol/L水杨酸后,正常磷条件下,水稻根系和地上部的总磷含量均显著下降,低磷条件下,水稻根系的总磷含量也显著下降(图1)。说明水杨酸对水稻磷吸收的调控存在剂量效应,合适的水杨酸浓度可以增加水稻在正常情况下和低磷条件下对外源磷的吸收,超过合适浓度则抑制水稻对外源磷的吸收。
为确定外源水杨酸是否进入水稻体内发挥作用,我们测定了水稻体内的水杨酸含量和与水杨酸合成相关的苯丙氨酸解氨酶活性[29]。由图2可知,在未添加水杨酸条件下,缺磷后水稻体内的水杨酸含量和苯丙氨酸解氨酶的活性均显著上升,暗示水杨酸可能参与水稻对缺磷胁迫的响应。外源添加水杨酸后,水稻体内的水杨酸含量和苯丙氨酸解氨酶活性随着水杨酸添加量的增加而提高(图2),暗示外源添加水杨酸增加了水稻体内水杨酸的含量,促进水稻体内水杨酸的合成。
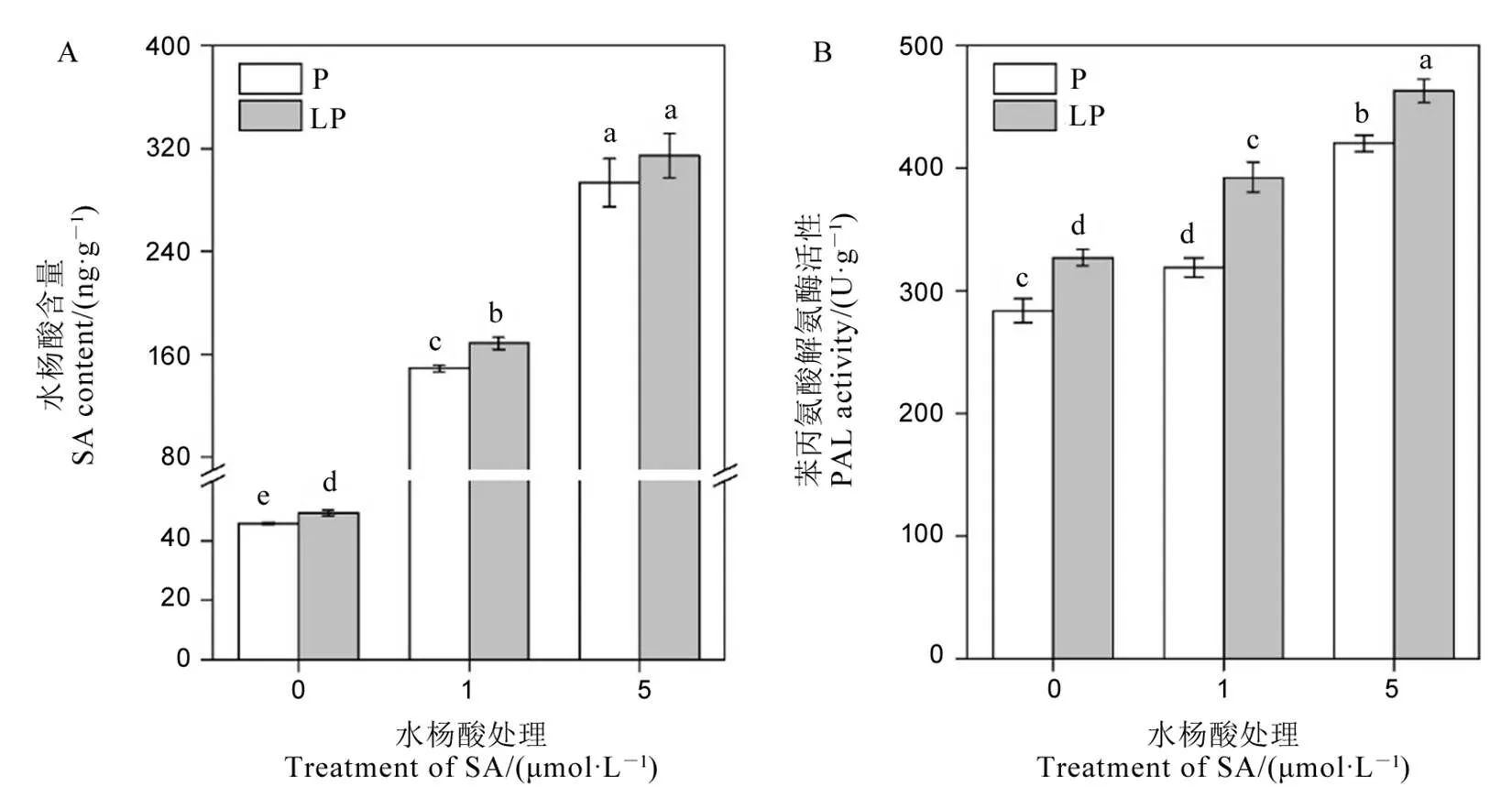
数据用均值±标准差(n = 4)表示。不同的大小写字母代表处理间差异分别在P < 0.01和P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L。
Fig. 2. Salicylic acid content and phenylalanine ammonia lyase activity under different exogenous salicylic acid levels.
因为本研究主要分析水杨酸对水稻外源磷吸收转运的促进作用,因此接下来的实验均采用1 μmol/L的水杨酸进行处理。
2.2 水杨酸调控水稻磷吸收和转运
根系是水稻吸收磷的主要器官。由表1可知,在低磷条件下,水稻根系总长、表面积、根的体积和总根数较正常磷条件均有所提高,分别提高了3.76%、38.82%、18.18%和58.73%。在低磷条件下,与未添加水杨酸处理组相比,添加1 μmol/L水杨酸后,水稻根系总长、表面积、平均直径和总根数均显著提高,分别提高了20.90%、11.86%、15.38%、23.55%。水稻根系的表型同样显示,在外源添加水杨酸后,水稻的根系显著变长(图3-A)。同时,缺磷导致水稻株高显著降低,添加水杨酸对水稻地上部的长势没有显著影响(图3-A)。
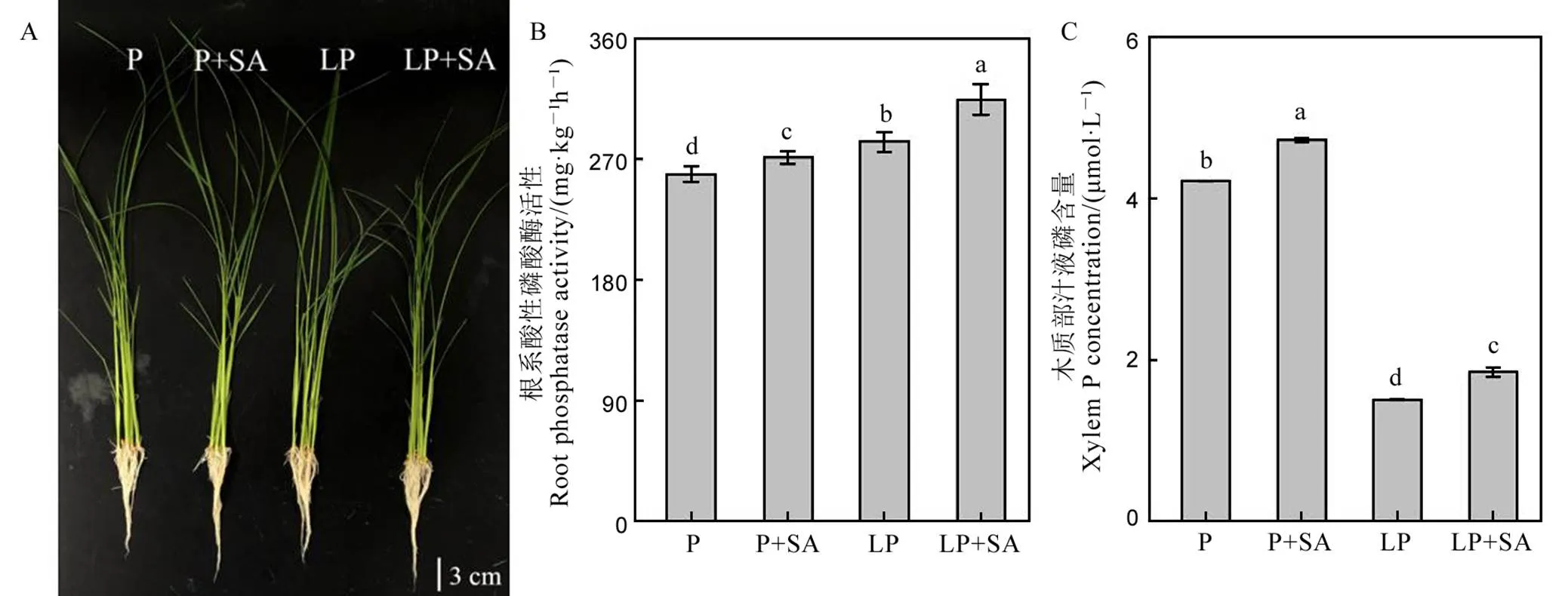
数据用均值±标准差(n = 4)表示。不同的大小写字母代表处理间差异分别在P < 0.01和P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L;SA-1 μmol/L水杨酸。
Fig. 3. Phenotype of rice, acid phosphatase activity in rice roots and xylem P concentration.
正常磷和低磷条件下,外源添加1 μmol/L水杨酸后,水稻根系的酸性磷酸酶活性均显著提高。在正常磷和低磷条件下,外源添加1 μmol/L的水杨酸后,水稻木质部汁液中的磷含量显著提高,增幅为22.67%(图3-B~C)。
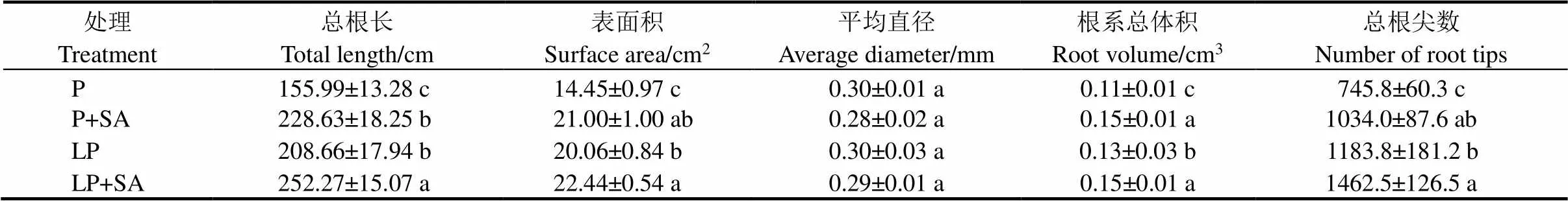
表1 水稻根系发育相关指标
2.3 水杨酸调控水稻体内磷转运子基因的表达
低磷胁迫下,水稻根系的基因家族中,除了表达没有变化,表达显著下降外,其余的磷转运子基因的表达均显著上调。在缺磷条件下,外源添加水杨酸后,水稻根系的,,,,,,,基因的表达均显著上调(图4)。缺磷条件下,和基因的表达不受水杨酸的调控,基因的表达在添加水杨酸后甚至显著下降(图4),这也说明了水杨酸对水稻磷转运子基因家族调控的多元化。
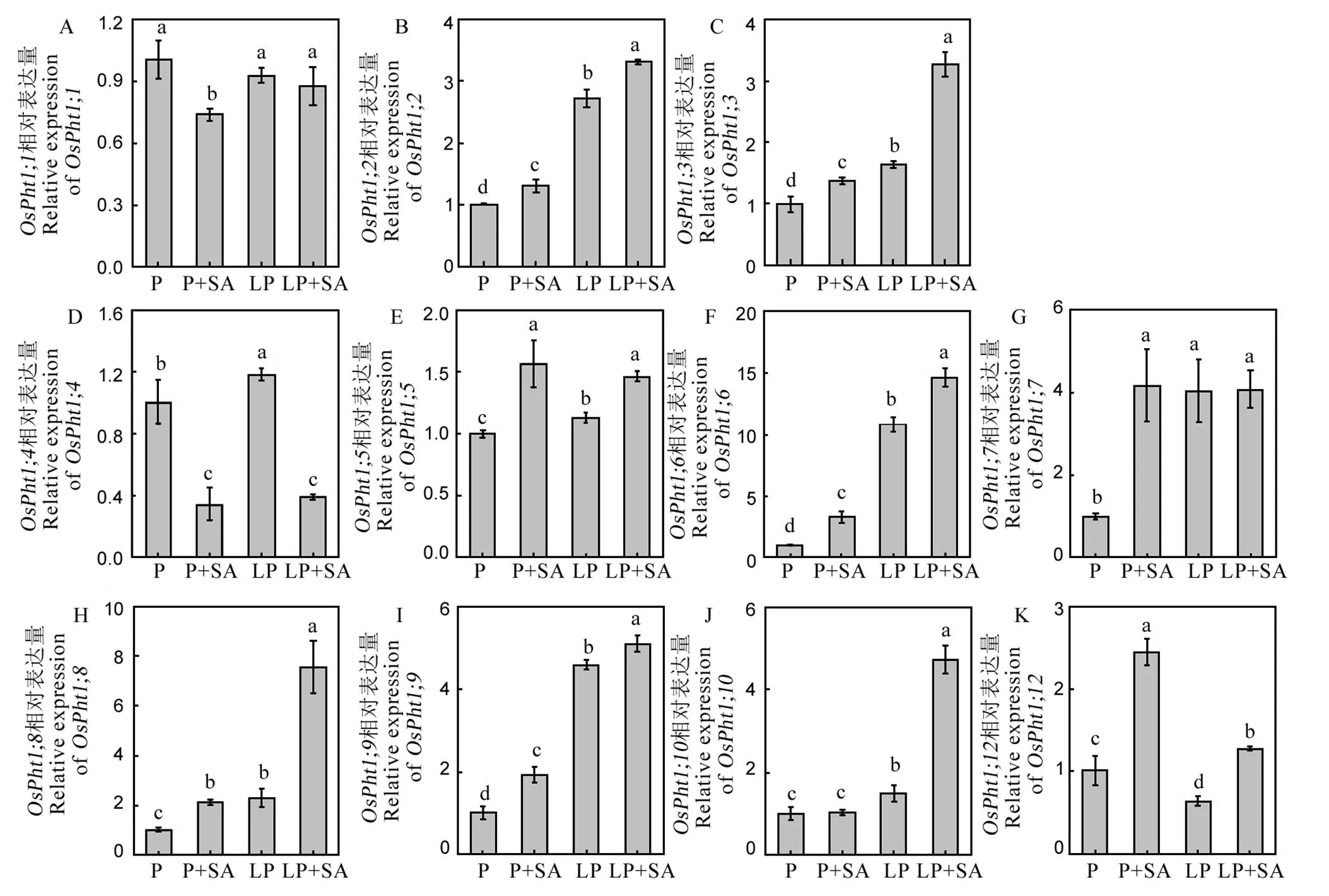
数据用均值±标准差(n = 4)表示。不同的大小写字母代表处理间差异分别在P < 0.01和P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L。
Fig. 4. Relative expression levels of P transporter genes.
2.4 水杨酸与一氧化氮互作调控水稻磷吸收
本研究采用荧光法检测水稻根尖一氧化氮含量,绿色荧光越强,一氧化氮含量越高。结果显示,低磷胁迫显著增加水稻根系的一氧化氮含量,外源添加水杨酸进一步增加了水稻根系一氧化氮含量(图5-A~B)。
植物体内主要通过硝酸还原酶(NR)和一氧化氮合酶(NOS)合成一氧化氮。结果显示,在低磷条件下,水稻根系的硝酸还原酶和一氧化氮合酶活性均显著增加,与一氧化氮含量的变化趋势一致。低磷条件下外源添加水杨酸后,水稻根系的硝酸还原酶(NR)活性进一步显著增加,而一氧化氮合酶的活性并没有显著变化(图5-C~D)。
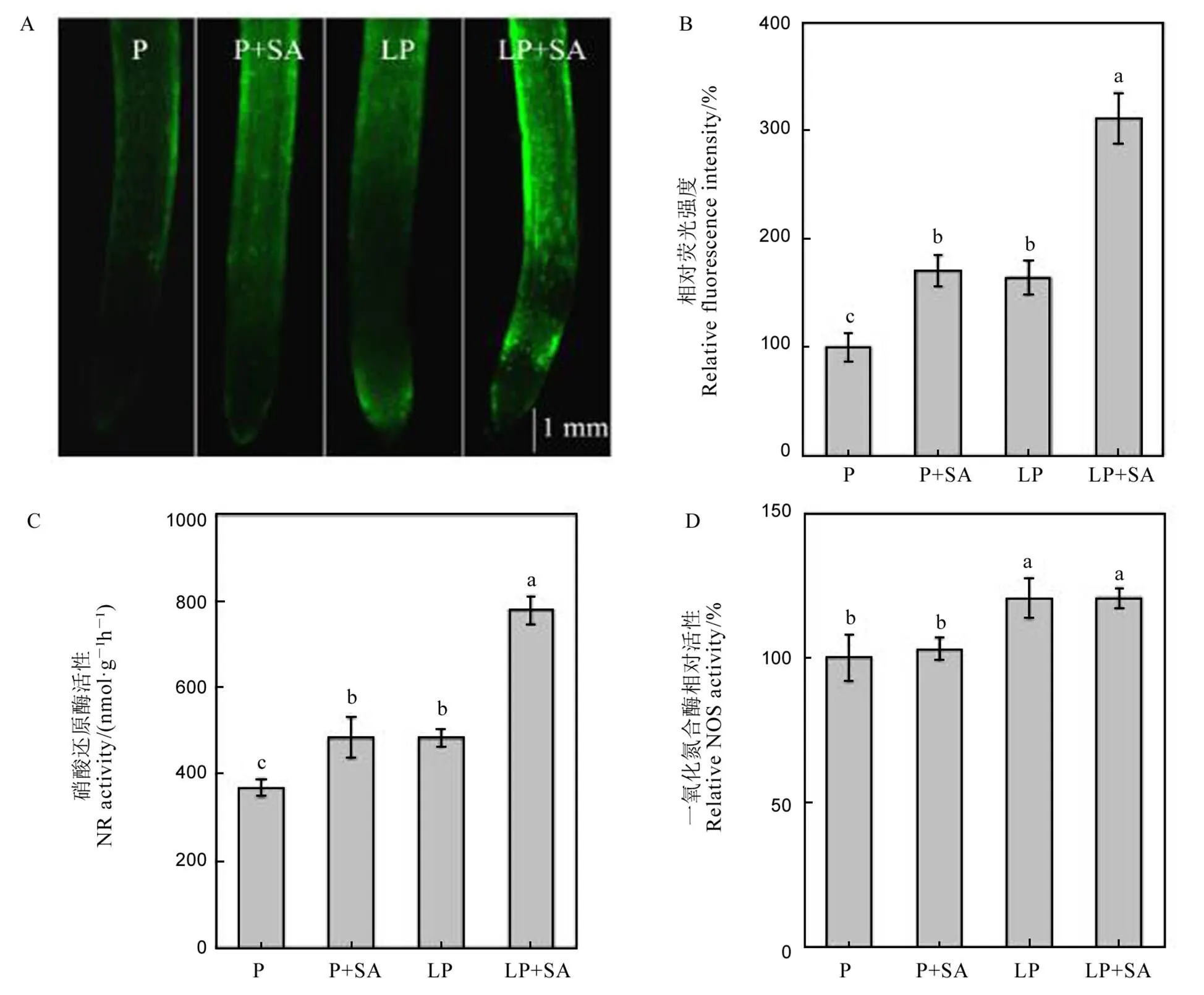
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L;SA-1 μmol/L水杨酸。
Fig. 5. Nitric oxide fluorescence (A), fluorescence intensity (B), NR activity (C), and relative NOS activity (D).
为了进一步确认水杨酸是否通过调控一氧化氮含量缓解低磷胁迫,我们在外源添加水杨酸的同时添加了一氧化氮的清除剂c-PTIO。结果显示,无论在加磷还是低磷条件下,同时添加水杨酸和c-PTIO后,水稻根系和地上部的总磷含量均显著下降(图6)。
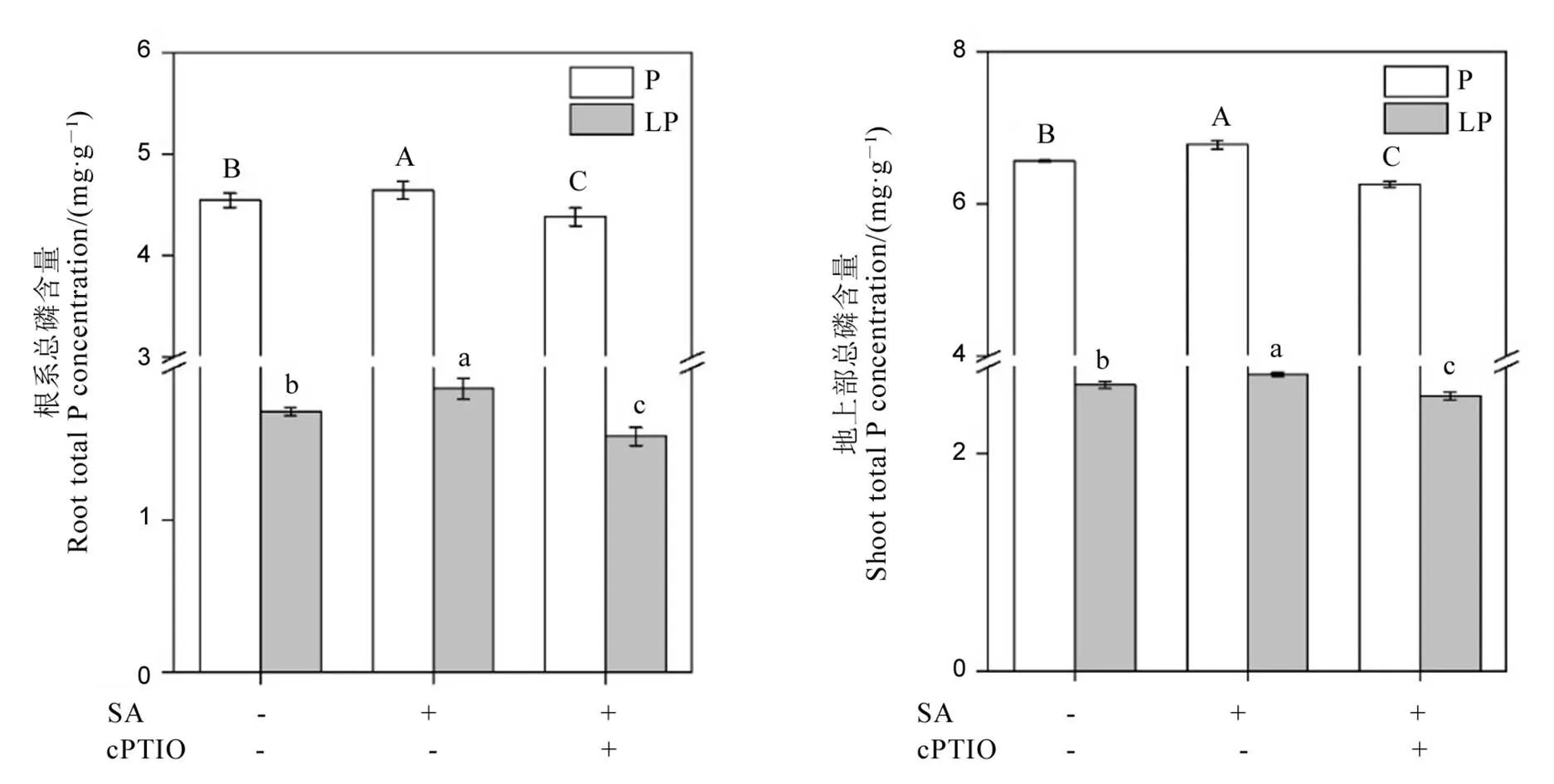
数据用均值±标准差(n = 4)表示。不同大小写字母代表处理间差异分别在P < 0.01和P < 0.05水平上显著。P-180 mmol/L;LP-18 mmol/L;SA-1 μmol/L;cPTIO-1 μmol/L。
Fig. 6. Total P content of rice roots (A) and shoots (B) after c-PTIO application.
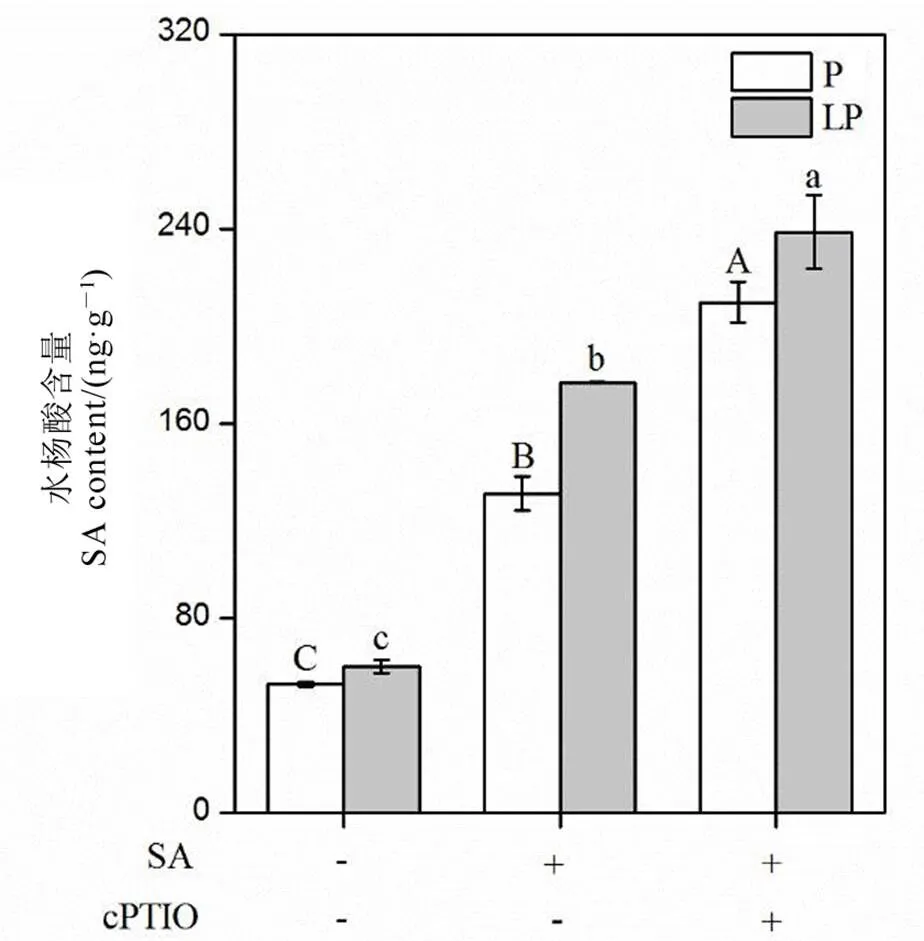
数据用均值±标准差(n = 4)表示。不同大小写字母代表处理间差异分别在P < 0.01和P < 0.05 水平上显著。P-180 mmol/L;LP-18 mmol/L;SA-1 μmol/L;cPTIO-1 μmol/L。
Fig. 7. Salicylic acid content of rice roots after 1 μmol/L c-PTIO application.
外源添加水杨酸显著增加水稻体内的水杨酸含量,然而在添加水杨酸的同时添加一氧化氮清除剂c-PTIO后,水稻根系中的水杨酸含量进一步增加。可能的原因在于,一氧化氮在水杨酸的下游发挥作用,当下游的一氧化氮被清除后造成上游水杨酸补偿性的合成,因此进一步增加了水稻根系的水杨酸含量。
对水稻根系硝酸还原酶活性进行测定后发现,外源水杨酸显著增加水稻根系的硝酸还原酶活性,同时添加一氧化氮的清除剂c-PTIO后,显著降低水稻根系的硝酸还原酶活性,说明c-PTIO同时可能通过抑制硝酸还原酶的活性抑制水稻体内一氧化氮的合成(图8)。
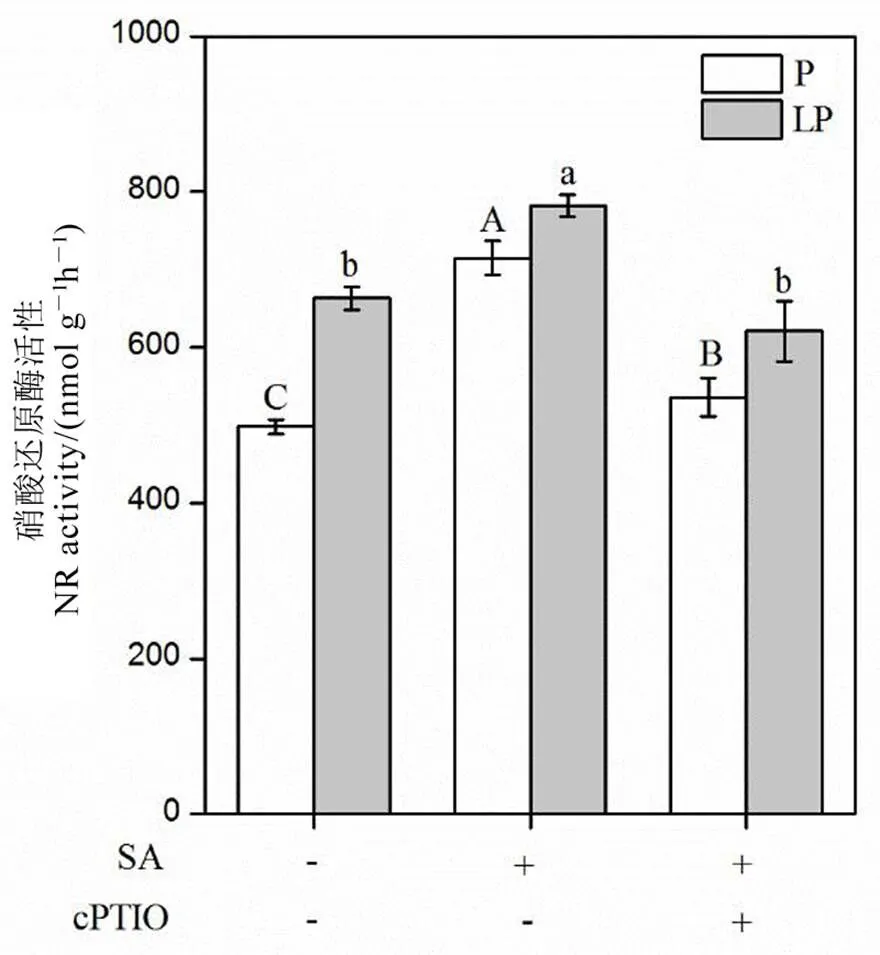
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05 水平上显著。P-180 mmol/L,LP-18 mmol/L;SA-1 μmol/L;cPTIO-1 μmol/L。
Fig. 8. NR activity of rice roots after 1 μmol/L c-PTIO application.
选择8个添加水杨酸后显著上调表达的磷转运子基因继续试验,发现在低磷条件下,同时添加水杨酸和c-PTIO后,除了基因的表达与单独添加水杨酸处理没有显著差异,其余的磷转运子在同时添加c-PTIO后,其基因的表达均显著低于单纯的水杨酸处理组,部分甚至低于单纯的低磷处理组(图9),说明清除一氧化氮显著降低水杨酸对水稻磷转运子基因表达的调控作用,进一步证明了水杨酸通过一氧化氮调控磷转运子基因表达提高水稻对外界磷的吸收。
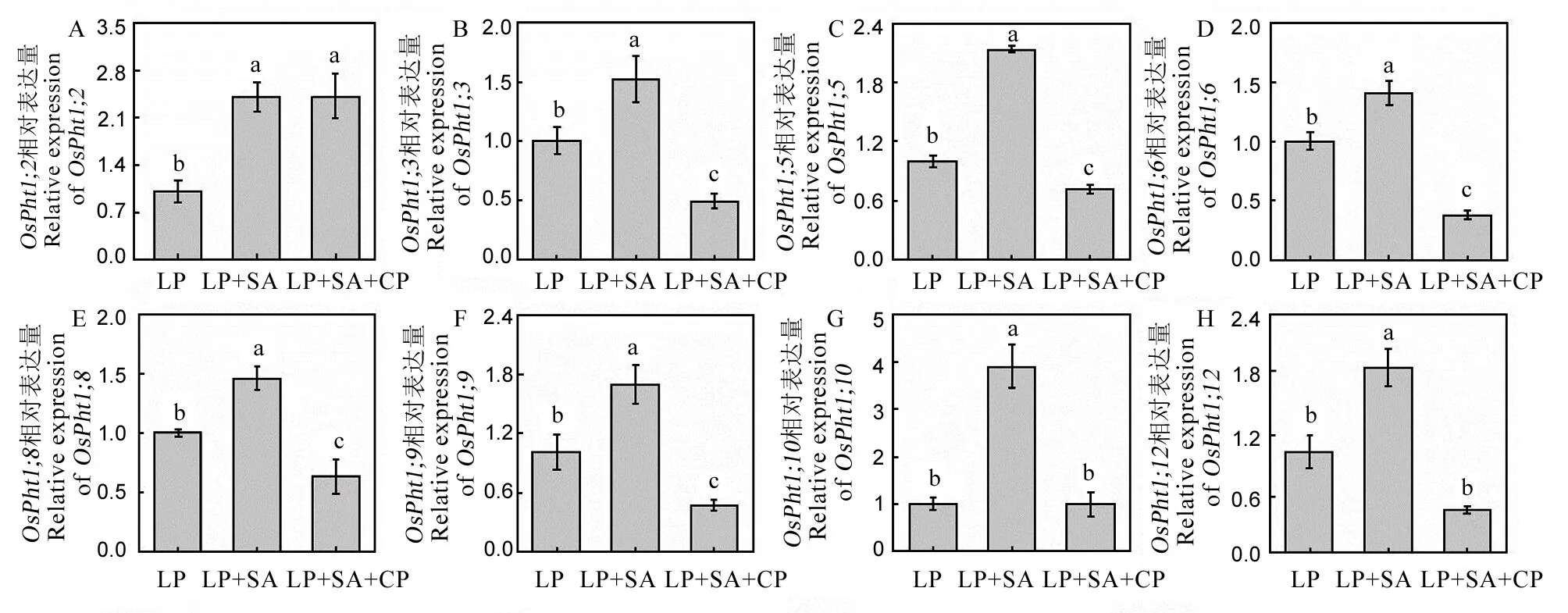
数据用均值±标准差(n = 4)表示。不同小写字母代表处理间差异在P < 0.05 水平上显著。P-180 mmol/L; LP-18 mmol/L; SA-1 μmol/L水杨酸;CP-cPTIO,1 μmol/L。
Fig. 9. Relative expression levels of P transporter genes.
3 讨论
水杨酸是植物体内普遍存在的一种含酚羟基有机酸,是植物抵抗外界逆境的重要信号分子[13, 29,30]。水杨酸和植物响应缺磷胁迫之间存在不同的研究结果。在甜菜中,低磷条件下甜菜根系通过向外分泌水杨酸溶解土壤中的磷,从而提高甜菜对磷的吸收[17]。在干旱、盐胁迫和硼毒条件下,无论是用水杨酸浸种还是在土壤中添加水杨酸,均提高了玉米体内的磷含量[18]。然而,在离体大麦根系试验中发现,外源添加0.5 mmol/L水杨酸显著降低离体大麦根系对磷的吸收[16]。在我们的试验中,较高浓度的(5 μmol/L)水杨酸处理降低了水稻体内的总磷含量,然而,合适的浓度(1 μmol/L)则会增加水稻体内的总磷含量(图1),说明水杨酸对水稻磷吸收的调控作用存在剂量效应。水杨酸莽草酸途径合成过程中,苯丙氨酸解氨酶发挥了重要作用[29]。在本研究中,外源添加水杨酸后,水稻体内的水杨酸含量和苯丙氨酸解氨酶的活性均显著上升(图2),说明外源添加水杨酸确实提高了水稻体内的水杨酸含量,促进了水稻体内水杨酸的合成,进一步证明了水稻体内总磷含量的变化与水杨酸的调控密切相关。
根系构型改变从而提高对外界磷的吸收是植物应对缺磷胁迫的常见策略。比如缺磷诱导菜豆基根上侧根生长,增加整个根系的总长和吸收面积,并且根系变浅,从而扩大对磷的吸收范围[31]。缺磷条件下,水稻种子根、不定根和侧根的长度随着磷供应水平的降低而显著增加[32]。低磷条件下,水稻品种Kasalath比日本晴拥有更庞大的根系,因此在缺磷土壤中可以吸收更多的磷,维持较好的生长[33]。在本研究中,缺磷条件下水稻根系总长、表面积、根的体积和总根数较正常磷条件下均显著增加(表1),说明水稻通过改变根系构型响应低磷胁迫。外源添加水杨酸后,水稻根系的总长、表面积、根的体积和总根数进一步增加(表1)。水稻的表型同样显示,外源添加水杨酸,显著提高水稻的根长(图3-A),说明水杨酸通过改变水稻根系构型提高水稻对外界磷的吸收,从而缓解低磷胁迫。
土壤中的磷通过根系的磷转运子进入植物体内。水稻体内磷转运子1()基因家族共有13个等位基因,除了和在菌根共生过程中诱导,其余大多数在水稻根部细胞膜上表达,编码的磷转运子蛋白直接参与水稻对磷的吸收和转运[34,35]。外源添加水杨酸提高水稻体内总磷含量与水稻磷转运子基因的表达变化密不可分。比如,,和均属于高亲和磷转运子,受磷饥饿诱导,过表达后显著增加水稻体内的磷含量[36,37]在本研究中,低磷条件下外源添加水杨酸后,,,,,基因的表达显著上调(图4),从而提高水稻对外界磷的吸收。然而,低磷条件下外源添加水杨酸后,和的基因并没有上调表达,基因甚至出现了下调表达(图4),可能原因在于不同磷酸盐转运子基因对同一种信号物质存在不同的调控反应以及在水稻生长过程中发挥不同的作用。比如,是组成型基因,不受缺磷胁迫的诱导表达,虽然受缺磷诱导表达,但是在水稻的胚胎发育过程中发挥重要作用[38],以上差异具体原因还需后续进一步研究。
除此之外,通过测定水稻木质部汁液中的磷含量发现,外源添加水杨酸后,木质部汁液中的磷含量显著上升,说明水杨酸还调控水稻体内的磷从根系往地上部的转运(图3-A)。水稻体内的磷转运子,,基因主要与水稻体内磷的转运密切相关,比如和属于高亲和磷转运子,具有磷吸收和体内再分配的双重功能,属于低亲和磷转运子,主要负责水稻体内磷从根系往地上部的长距离转运[39,40]。在本研究中,低磷胁迫显著增加了以上3个基因的表达(图4),外源添加水杨酸后,3个基因的表达进一步增加。结合木质部汁液中磷含量的变化,说明水杨酸同样可以调控低磷条件下水稻根系中的磷往地上部的转运。
缺磷条件下,植物体内酸性磷酸酶的合成和分泌急剧增加。酸性磷酸酶不仅能够催化植物体内的磷酸单脂分解成脂肪酸和无机磷,还可以通过分泌进入土壤后参与土壤无机磷的分解,从而提高植物的磷吸收效率[41]。本研究发现,低磷胁迫显著增加水稻根系的酸性磷酸酶活性,外源添加水杨酸后,水稻根系的酸性磷酸酶活性进一步提高(图3),说明水杨酸通过提高酸性磷酸酶的活性,促进水稻对外界磷的吸收和磷在体内的转运。
水杨酸调控植物响应逆境胁迫过程中常与一氧化氮产生互作[42]。比如水杨酸减轻烟草花叶病毒损伤过程中,外源添加一氧化氮合成的抑制剂会减弱水杨酸的作用[43];在拟南芥中,水杨酸通过调控一氧化氮合酶产生一氧化氮[44]。在本研究中,我们同样测定了硝酸还原酶和一氧化氮合酶的活性,发现缺磷胁迫显著增强了两种酶的活性(图5),说明水稻通过调控硝酸还原酶和一氧化氮合酶活性产生一氧化氮。然而在低磷条件下外源添加水杨酸后,只有硝酸还原酶的活性进一步增加,而NOS酶活并没有显著变化(图5),说明在水稻体内水杨酸通过增强硝酸还原酶的活性提高体内一氧化氮含量。前期研究发现,一氧化氮参与调控植物响应缺磷胁迫,比如在白羽扇豆中,一氧化氮通过提高根系柠檬酸的释放提高其对外界磷的吸收,在水稻中,一氧化氮通过调控水稻根系细胞壁组分的变化,促使细胞壁中结合态磷的释放,从而缓解缺磷胁迫[22,45]。为了进一步验证水杨酸是否通过一氧化氮途径调控水稻响应缺磷胁迫,我们同时添加了水杨酸和一氧化氮的清除剂c-PTIO,结果发现,当添加c-PTIO后,即使存在水杨酸,水稻在低磷条件下体内的总磷含量仍然显著下降(图6),证明了一氧化氮参与调控水稻缓解缺磷胁迫。同时添加水杨酸和c-PTIO,显著降低了水稻根系中的硝酸还原酶的活性(图8),并且降低了磷转运子基因的表达(图9),进一步验证了水杨酸通过调控一氧化氮的合成调节水稻磷转运子基因的表达,最终缓解低磷胁迫。然而,同时添加水杨酸和c-PTIO,显著提高了水稻根系中水杨酸的含量(图7),可能的原因在于,一氧化氮作为水杨酸的下游信号物质,当它被清除后,上游的水杨酸补偿性地大量合成,将水稻根系一氧化氮含量维持在正常的范围。
然而,本研究的结果是在水培条件下取得的,在土壤培养过程中可能存在不一样的结果。比如,在土壤环境中,因为水稻品种Kasalath拥有更大的根系,因此能在缺磷的土壤中比日本晴长得更好[33]。然而,在完全缺磷的水培条件下,因为培养液中完全缺磷,因此Kasalath的大根系不能发挥作用,只能靠体内磷的再利用缓解缺磷胁迫。对比日本晴与Kasalath两个水稻品种根细胞壁结合态磷再利用的研究发现,在完全缺磷的营养液中,日本晴的根系细胞壁拥有更多的果胶含量,可以将细胞壁中的结合态磷释放出来,供水稻利用,因此,日本晴体内拥有更高的有效磷含量[22]。同时,土壤中的磷以各种形式存在,包括可以直接利用的有效磷和不能直接利用的结合态磷等,植物能通过根系向外释放氢离子、有机酸和果胶等物质,将土壤中与矿物或者土壤颗粒结合的磷释放出来,供植物吸收利用[46,47]。然而,在水培条件下,因为营养液中添加的是可被植物直接吸收利用的磷,同时营养液的pH可被缓冲液控制,以上的方式均不能提高水稻对营养液中磷的吸收。因此,本研究结果运用于土培时,可能会存在一些差异,可能有必要运用土培试验验证水杨酸对水稻磷吸收和利用的调控作用。
4 结论
水杨酸调控水稻缓解低磷胁迫具有剂量效应,在合适的浓度下,水杨酸通过改变水稻根系构型,提高酸性磷酸酶活性,提高磷转运子基因的表达和促进磷从根系往地上部的转运缓解水稻低磷胁迫活性。在水杨酸缓解水稻低磷胁迫的调控过程中,与信号分子一氧化氮产生互作,是一氧化氮依赖的过程。
[1] 朱春权, 曹小闯, 朱练峰, 白志刚,黄洁,梁清铎,金千瑜,张均华. 硫化氢提高水稻磷吸收转运的生理和分子机制[J]. 中国水稻科学, 2019, 33(6): 532-540.
Zhu C Q, Cao X C, Zhu L F, Bai Z G, Huang J, Liang Q D, Jin Q Y, Zhang J H. Physiological and molecular mechanisms of hydrogen sulfide enhancing phosphorus absorption and transportation in rice[J]., 2019, 33(6): 532-540. (in Chinese with English abstract)
[2] 郎印海. 缺磷胁迫下植物应激反应初步研究及应激物质的诱导、提取分离[D]. 泰安: 山东农业大学, 2000.
Lang Y H. Preliminary study on plants response to phosphorus deficiency stress and the extraction and separation of stress induction substances[D]. Tai’an: Shandong Agricultural University, 2000.
[3] 张海伟, 黄宇, 叶祥盛, 徐芳森. 低磷胁迫下甘蓝型油菜酸性磷酸酶对磷效率的贡献分析[J]. 中国科学: C辑, 2010, 40(5): 418-427.
Zhang H W, Huang Y, Ye X S, Xu F S. Contribution analysis of phosphorus efficiency for acid phosphatase inL. under low phosphorus stress[J]., 2010, 40(5): 418-427. (in Chinese)
[4] 李立芹. 植物低磷胁迫适应机制的研究进展[J]. 生物学通报, 2011, 46(2): 13-16.
Li L Q. Advances in the mechanism of plant adapt to low phosphorus stress[J]., 2011, 46(2): 13-16. (in Chinese)
[5] 李锋, 潘晓华. 植物适应缺磷胁迫的根系形态及生理特征研究进展[J]. 中国农学通报, 2002, 18(5): 65-69, 76.
Li F, Pan X H. The research development of morphological and physiological characteristics of plant root system under phosphorus deficiency[J]. Chinese, 2002, 18(5): 65-69, 76. (in Chinese with English abstract)
[6] Plaxton W C, Carswell M C. Metabolic aspects of the phosphate starvation response in plants. Plant responses to environmental stresses: From phytohormones to genome reorganization Marcel Dekker, New York: 1999, 349-372.
[7] Zhu X F, Wang Z W, Wan J X, Sun Y, Wu Y R, Li G X, Shen R F, Zheng S J. Pectin enhances rice () root phosphorus remobilization[J]., 2015, 66(3): 1017-1024.
[8] Yu B, Xu C, Benning C.disrupted in SQD2 encoding sulfolipid synthase is impaired in phosphate-limited growth[J].2002, 99(8): 5732-5737.
[9] Bandurska H. An update on biosynthesis and action in plant response to water deficit and performance under drought[C]//Hayat S, Ahmad A, Alyemeni M N. Salicylic Acid, Springer, 2013: 1-14.
[10] Yusuf M, Hayat S, Alyemeni M N, Fariduddin Q, Ahmad A. Salicylic acid: Physiological roles in plants[C]// Hayat S, Ahmad A, Alyemeni M N. Salicylic Acid, Springer, 2013: 15-30.
[11] Pancheva T V, Popova L P, Uzunova A N. Effects of salicylic acid on growth and photosynthesis in barley plants[J]., 1996, 149(1-2): 57-63.
[12] Pancheva T V, Popova L P. Effect of salicylic acid on the synthesis of ribulose-1, 5-bisphosphate carboxylase/ oxygenase in barley leaves[J]., 1998, 152(4): 381-386.
[13] 张永福, 黄鹤平, 彭声静, 任禛,陈泽斌,刘佳妮,陈瑞. 铝胁迫下水杨酸对水晶葡萄植株生长及营养积累的影响[J]. 中外葡萄与葡萄酒, 2015(2): 10-15.
Zhang Y F, Huang H P, Peng S J, Ren C, Chen Z B, Liu J N, Chen R. Effects of salicylic acid on growth and nutrition accumulation of Shuijing seedling under aluminum stress[J]., 2015(2): 10-15. (in Chinese with English abstract)
[14] Janda T, Szalai G, Tari I, Páldi E. Hydroponic treatment with salicylic acid decreases the effects of chilling injury in maize (L.) plants[J]., 1999, 208(8): 175-180.
[15] Tasgin E, Attici O, Nalbantoglu B. Effect of salicylic acid and cold on freezing tolerance in winter wheat leaves[J]., 2003, 41(3): 231-236.
[16] Glass A D. Influence of phenolic acids on ion uptake: I. Inhibition of phosphate uptake[J]., 1973, 51(6): 1037-1041.
[17] Khorassani R, Hettwer U, Ratzinger A, Ursula H, Reza K, Norbert C. Citramalic acid and salicylic acid in sugar beet root exudates solubilize soil phosphorus[J]., 2011, 11(1): 121.
[18] Gunes A, Inal A, Alpaslan M, Cicek N, Guneri E, Eraslan F, Guzelordu T. Effects of exogenously applied salicylic acid on the induction of multiple stress tolerance and mineral nutrition in maize (L.) [J]., 2005, 51(6): 687-695.
[19] He J Y, Ren Y F, Chen X L, Chen H. Protective roles of nitric oxide on seed germination and seedling growth of rice (L.) under cadmium stress[J]., 2014, 108: 114-119.
[20] Singh V P, Srivastava P K, Prasad S M. Nitric oxide alleviates arsenic-induced toxic effects in ridged Luffa seedlings[J]., 2013, 71: 155-163.
[21] 李鹏飞. 一氧化氮通过调节磷酸盐吸收与转运促进水稻磷营养[D]. 厦门: 厦门大学, 2017.
Li P F. Nitric oxide enhances phosphate nutrition in rice seedlings by regulating phosphate uptake and translocation[D]. Xiamen: Xiamen University, 2017.
[22] Zhu C Q, Zhu X F, Hu A Y, Wang C, Wang B, Dong X Y, Shen R F. Differential effects of nitrogen forms on cell wall phosphorus remobilization are mediated by nitric oxide, pectin content, and phosphate transporter expression[J]., 2016, 171: 1407-1417.
[23] Shao R X, Xin L F, Guo J M, Zheng H F, Mao J, Han X P, Jia L, Jia S J, Du C G, Song R, Yang Q H, Elmore R W. Salicylic acid-induced photosynthetic adaptability ofL. to polyethylene glycol-simulated water deficit is associated with nitric oxide signaling[J].,2018, 56: 1370-1377.
[24] Zhang X B, Feng B H, Wang H M, Xu X, Shi Y F, He Y, Chen Z, Sathe A P, Shirle Y L, Wu J L. A substitution mutation inconfers bacterial blight resistance by activating the salicylic acid pathway[J]., 2018, 60(2): 160-172.
[25] You C, Zhu H, Xu B, Wang S, Ding Y, Liu Z, Li G, Chen L, Ding C. Effect of removing superior spikelets on grain filling of inferior spikelets in rice[J]., 2016: 7.
[26] 李忠光,龚明. 磺胺比色法测定植物组织硝酸还原酶活性的改进[J]. 植物生理学通讯, 2009, 45(1): 67-68.
Li Z G, Gong M. Improvement of nitrate reductase activity measurement in plant tissues by sulfa colorimetry method[J]., 2009, 45(1): 67-68. (in Chinese)
[27] 张志良. 植物生理学实验指导. 北京: 高等教育出版社, 2003: 41-43.
Zhang Z L. Experimental Guidance in Plant Physiology. Beijing: Higher Education Press, 2003: 41-43. (in Chinese)
[28] 徐畅, 安书成. 一氧化氮及一氧化氮合酶的测定[J]. 陕西师范大学继续教育学报, 2004, 21(1): 115-118.
Xu C, An S C. Determination of nitric oxide and nitric oxide synthase[J]., 2004, 21(1): 115-118. (in Chinese)
[29] 穆师洋, 胡文忠, 姜爱丽. 水杨酸的信号分子作用及其在鲜切果蔬中的应用[J]. 食品安全质量检测学报, 2015(7): 2434-2438.
Mu S Y, Hu W Z, Jiang A L. The role of salicylic acid as signal molecule and its application in fresh-cut fruits and vegetables[J]., 2015(7): 2434-2438. (in Chinese with English abstract)
[30] 侯爽, 陈锦芬, 刘溶荣, 王瑞, 陈俊鸿, 邹聪明, 谢小玉. 外源水杨酸对烟草幼苗低温胁迫的缓解效应[J]. 湖南农业大学学报: 自然科学版, 2020, 46(1): 14-20.
Hou S, Chen J F, Liu R R, Wang R, Chen J H, Zou C M, Xie X Y. Mitigative effect of exogenous salicylic acid on low temperature stress in tobacco seedlings[J].:, 2020, 46(1): 14-20. (in Chinese with English abstract)
[31] Liao H, Yan X L. Adaptive changes and genotypic variation for root architecture of common bean in response to phosphorus deficiency[J]., 2000, 42(2): 158-163. (in Chinese with English abstract)
[32] 黄荣, 孙虎威, 刘尚俊, 宋文静, 刘言勋, 余超, 毛颖, 张亚丽, 徐国华. 低磷胁迫下水稻根系的发生及生长素的响应[J]. 中国水稻科学, 2012, 26(5): 563-568.
Huang R, Sun H W, Liu S J, Song W J, Liu Y X, Yu C, Mao Y, Zhang Y L, Xu G H. Rice Root Growth and Auxin Concentration in Response to Phosphate Deficiency[J]., 2012, 26(5): 563-568. (in Chinese with English abstract)
[33] Wissuwa M, Ae N. Genotypic variation for tolerance to phosphorus deficiency in rice and the potential for its exploitation in rice improvement[J].,2001, 120: 43-48.
[34] Li H, Guo L, Tao C, Yang L M, Wang X Z. Nonredundant regulation of rice arbuscular mycorrhizal symbiosis by two members of thegene family[J]., 2012, 24: 4236-4251.
[35] Paszkowski U, Kroken S, Roux C, Briggs S P. Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis[J]., 2002, 99: 13324-13329.
[36] Wang X, Wang Y, Piñeros M A, Wang Z Y, Wang W X, Li C G, Wu Z C, Kochian L V, Wu P. Phosphate transportersandare involved in phosphate uptake in rice[J]., 2014, 37: 1159-1170.
[37] 王文霞. 水稻磷酸盐转运体和的功能研究. 杭州: 浙江大学, 2014: 21-30.
Wang W X. Functional analysis ofandin[D]. Hangzhou: Zhejiang University, 2014: 21-30. (in Chinese with English abstract)
[38] Zhang F, Sun Y F, Pei W X, Jain A, Sun R, Cao Y, Wu X, Jiang T, Zhang L, Fan X, Chen A, Shen Q, Xu G, Sun S. Involvement ofin phosphate acquisition and mobilization facilitates embryo development in rice[J]., 2015, 82(4): 556-569.
[39] Ai P H, Sun S B, Zhao J N, Fan X R, Xin W J, Guo Q, Yu L, Shen Q R, Wu P, Miller A J, Xu G H. Two rice phosphate transporters,and, have different functions and kinetic properties in uptake and translocation[J]., 2009, 57(5): 798-809.
[40] Jia H, Ren H, Gu M, Zhao J, Sun S, Zhang X, Chen J, Wu P, Xu G. The phosphate transporter geneis involved in phosphate homeostasis in rice[J]., 2011, 156(3): 1164-1175.
[41] 黄沆, 付崇允, 周德贵, 陈光辉, 周少川. 植物磷吸收的分子机理研究进展[J]. 分子植物育种, 2008, 6(1): 117-122.
Huang H, Fu Z Y, Zhou D G, Chen G H, Zhou S C. Progress in research of molecular mechanism of phosphorus absorption in plants[J]., 2008, 6(1): 117-122. (in Chinese with English abstract)
[42] Klessig D F, Durner J, Noad R, Navarre D A, Wendehenne D, Kumar D, Zhou J M, Shah J, Zhang S Q, Kachroo P, Trifa Y, Pontier D, Lam E, Silva H. Nitric oxide and salicylic acid signaling in plant defense[J]., 2000, 97(16): 8849-8855.
[43] Song F, Goodman R M. Activity of nitric oxide is dependent on, but is partially required for function of, salicylic acid in the signaling pathway in tobacco systemic acquired resistance[J]., 2001, 14(12): 1458-1462.
[44] Zottini M, Costa A, Michele R D, Ruzzene M, Carimi F. Salicylic acid activates nitric oxide synthesis in Arabidopsis[J]., 2007, 6 (58): 1397-1405.
[45] Meng Z B, Chen L Q, Suo D, Li G X, Tang C X, Zheng S J. Nitric oxide is the shared signaling molecule in phosphorus- and iron-deficiency-induced formation of cluster roots in white lupin ()[J]., 2012, 109: 1055-1064.
[46] Shen J B, Yuan L X, Zhang J L, Li H G, Bai Z H, Chen H P, Zhang W F, Zhang F S. Phosphorus dynamics: From soil to plant[J]., 2011, 156: 997-1005.
[47] Ae N, Shen R F. Root cell-wall properties are proposed to contribute to phosphorus (P) mobilization by groundnut and pigeonpea[J]., 2002, 245: 95-103.
Salicylic Acid Alleviates Low Phosphorus Stress in Rice via a Nitric Oxide-dependent Manner
ZHU Chunquan1,#, WEI Qianqian1,2,#, DANG Caixia3, HUANG Jing1, XU Qingshan1, PAN Lin1, ZHU Lianfeng1, CAO Xiaochuang1, KONG Yali1, XIANG Xingjia2, LIU Jia4, JIN Qianyu1, ZHANG Junhua1,*
(State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006, China; Anhui University, Hefei 230039, China; Yibin University, Yibin 644000, China; Jiangxi Academy of Agricultural Sciences, Nanchang 330200; These authors contributed equally to the work; Corresponding author, E-mail: zhangjunhua@caas.cn)
【Objective】It is of great importance to analyze the physiological and molecular mechanisms of salicylic acid(SA) regulating the response of rice to phosphorus(P) stress. 【Method】The conventional rice cultivar Nipponbare was used in our experiment, and the total P content, acid phosphatase activity, xylem P concentration, root parameters, expression levels of P transporter genes and nitric oxide (NO) content in rice were measured after exogenous SA application to explore the physiological and molecular mechanism that SA alleviates P deficiency stress in rice. 【Result】 1) Application of 1 μmol/L SA significantly increased the total P content in rice under low P conditions. However, 5 μmol/L SA decreased the total P content in rice, indicating SA had a dose effect on the regulation of P absorption in rice. 2) Application of 1 μmol/L SA significantly increased the activity of acid phosphatase by 11.35%, total root length by 20.90%, surface area by 11.86%, root volume by 15.38%, total root number by 23.55%, xylem P concentration by 22.6%. In addition, the application of 1μmol/L SA significantly increased the expression levels of P transporter genes, thereby increased the absorption of exogenous P and the transportation of internal P in rice under low P conditions. 3) SA increased the content of NO in rice roots by increasing the activity of nitrate reductase, so as to improve the absorption of P in rice under low phosphorus conditions via regulating the expression of P transporter genes. 【Conclusion】SA alleviates low phosphorus stress in rice by its interacting with the signal molecule of NO.
rice; phosphorus; salicylic acid; absorption and transport; gene; nitric oxide
10.16819/j.1001-7216.2022.210813
2021-08-27;
2022-01-22。
国家自然科学基金青年项目(31901452);国家自然科学基金面上项目(31872857,31771733)。

