姜黄素自微乳结肠炎症靶向微丸的处方研究
鞠佳芮,戴俊东,朱笑颜,郭鹏川,吴师月
(北京中医药大学中药学院,北京 102488)
溃疡性结肠炎(UC)是一种慢性非特异性炎症性肠病[1],病变部位主要集中于结肠黏膜或黏膜下层,呈弥漫性分布,常累及乙状结肠和直肠[2]。由于病因不明,目前临床上多以对症抗炎治疗为主。为改善其治疗效果,在结肠靶向的基础上,将药物特异性靶向于结肠炎症部位现已成为溃疡性结肠炎给药系统研究的重要方向。
UC炎症部位转铁蛋白[3]、杀菌/通透性增强蛋白[4]、嗜酸细胞阳离子蛋白等阳离子蛋白表达异常增高[5],使得结肠炎症部位带正电荷。课题组前期制备的姜黄素荷负电自微乳,能够显著改善姜黄素的水溶性和在肠道部位的稳定性,并通过静电吸附作用靶向于结肠炎症部位[6]。为解决姜黄素荷负电自微乳释药迅速,直接口服给药难以到达结肠部位的问题,本研究选择壳聚糖与海藻酸钠为丸芯材料,EudragitS 100包衣制备pH-酶依赖型结肠靶向微丸Cur-ITP,以实现姜黄素荷负电自微乳在结肠部位的靶向递送和平稳释放,对炎症部位进行靶向治疗。
1 仪器与试药
BSA223S-CW电子分析天平(德国赛多利斯科学仪器有限公司);pH计[奥豪斯仪器(上海)有限公司];756PC型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);湿法制粒挤出滚圆一体机 CML(英国Caleva公司);SZX7体式显微镜(日本奥林巴斯株式会社);RC806D智能溶出仪(天津天大天发公司)。
姜黄素(纯度95%,上海源叶生物科技有限公司,批号R26J7S18508);丁二酸二辛酯磺酸钠(纯度96%,上海麦克林生化科技有限公司,批号C10050237);丙二醇单辛酸酯(Capryol90,法国嘉法狮公司,批号144603);二乙二醇单乙基醚(Transcutol HP,法国嘉法狮公司,批号177728);聚氧乙烯氢化蓖麻油(CremophorRH40,上海源叶生物科技有限公司,批号Y17O11S127656);壳聚糖(脱乙酰度85%,分子量30~40万,上海源叶生物科技有限公司,批号A14A11X121309);海藻酸钠(化学纯,粘度10 g·L-1≥0.02 Pa·S-1,西陇化工股份有限公司,批号120503);Eudragit S100(上海昌为医药辅料技术有限公司,批号B170105202);胃蛋白酶(30 000 U·g-1,上海源叶生物科技有限公司;批号:D20GS171943);胰蛋白酶(250 U·mg-1,上海源叶生物科技有限公司;批号:D29GS172831);β-甘露聚糖酶(50 000 U·g-1,上海麦克林生化科技有限公司,批号:C12318569)。
2 方法
2.1 微丸含量测定方法的建立
为便于微丸处方与释放度研究大量样品的快速检测,在课题组前期HPLC含量测定方法[7]的基础上,建立姜黄素微丸紫外—可见分光光度法含量测定方法。
2.2 姜黄素炎症靶向自微乳的制备[6]
取 Cremophor RH40 6.0 g,Transcutol HP 3.0 g,Capryol 90 1.0 g,丁二酸二辛酯磺酸钠0.4 g,70℃水浴加热搅拌并使之完全溶解,然后加入姜黄素0.4 g,100 r·min-1搅拌15 min,得姜黄素炎症靶向自微乳,加水稀释后平均粒径(19.75±0.43)nm,Zeta电位为(-40.47±1.68)mV。
2.3 微丸丸芯处方研究
以处方中壳聚糖与海藻酸钠的比例(A)、姜黄素自微乳用量(B)、润湿剂用量(C)为影响因素;合格微丸收率(Y1)、载药量(Y2)、圆整度(Y3)和释放度(Y4)为指标,进行Box-Behnken设计(见表2)。按处方量(总质量均为12 g)称取壳聚糖与海藻酸钠,加入姜黄素自微乳混匀,再加入水为润湿剂制软材,挤出—滚圆法制备微丸,挤出速度100 rpm;滚圆速度2 000 rpm,60℃烘箱干燥即得。
2.4 微丸质量评价
2.4.1 合格微丸收率(Y1) 利用筛分法计算能通过一号筛不能通过二号筛的微丸收率。
2.4.2 载药量(Y2) 取适量微丸研细,精密称取0.015 g,加pH 1.0盐酸溶液10 mL,超声提取70 min,冷却,取1 mL置于5 mL容量瓶中,乙醇定容,摇匀,8 000 rpm离心,取上清液测定姜黄素含量[8],计算载药量。
2.4.3 圆整度(Y3) 随机选取9粒微丸,体式显微镜测定其长宽比,计算其平均值与1的差值,即Y3=│X-1│,Y3值越小,微丸的圆整度越高。
2.4.4 释放度(Y4) 采用37℃恒温水浴振荡法测定微丸的释放度[9]。称取姜黄素微丸(含姜黄素0.5 mg),加入pH7.4磷酸缓冲液15 mL,60 rpm恒温振荡[10],分别于15 min、30 min、1 h、2 h、4 h取1 mL上清液置于5 mL容量瓶中,依法测定,计算释放度。为减缓自微乳中表面活性剂和助表面活性剂对结肠黏膜炎症部位的刺激,实现微丸的平稳释放,将30 min、1 h、2 h的释放度分别与期望释放值25%、50%、80%做差值,用偏差之和评价其释放效果,即Y4(%)=│Q30min-25%│+│Q1h-50%│+(80%-Q2h)。
2.5 结肠靶向微丸的制备
按表1处方配制包衣液,对最佳工艺制得的丸芯进行包衣,至包衣增重达到12%~13%后80 ℃热风干燥30 min,使衣膜塑化,形成连续致密的包衣层。
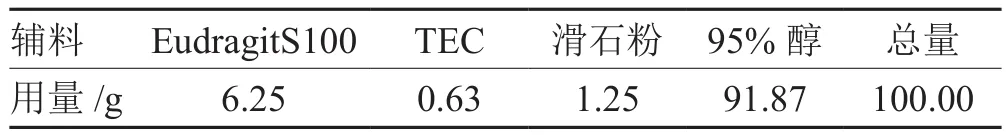
表1 包衣液处方
2.6 结肠靶向微丸释放度研究
称取姜黄素微丸(含姜黄素5 mg),采用小杯篮法,转速50 rpm,释放液体积150 mL,模拟体内胃肠道条件,依次考察包衣微丸在不含酶的pH 1.0、pH 4.5、pH 5.5、pH 6.8、pH 7.4释放液和含酶的pH 1.0人工胃液(含胃蛋白酶);pH 4.5、pH 5.5、pH 6.8人工肠液(含胰酶);pH 7.4人工结肠液(含β-甘露聚糖酶)中的累积释放度,分别于2 h、4 h、6 h、7 h、8 h、9 h、10 h、12 h取样测定,评价包衣微丸的结肠靶向效果。
3 结果
3.1 微丸含量测定方法的建立
微丸经pH1.0盐酸溶液超声提取,可以使壳聚糖充分溶解,释放与其通过静电吸附的姜黄素荷负电自微乳,再经乙醇溶解破乳后于423 nm测定姜黄素含量。经方法学研究,溶剂与微丸辅料对姜黄素的含量测定无干扰,姜黄素浓度在1.9 992~4.9 980 μg·mL-1范围内与吸光度线性关系良好,溶液稳定性、精密度、重现性和回收率考察结果均符合要求,可用于姜黄素微丸的含量测定。
3.2 Box-Behnben中心组合方法试验设计及结果
见表2。
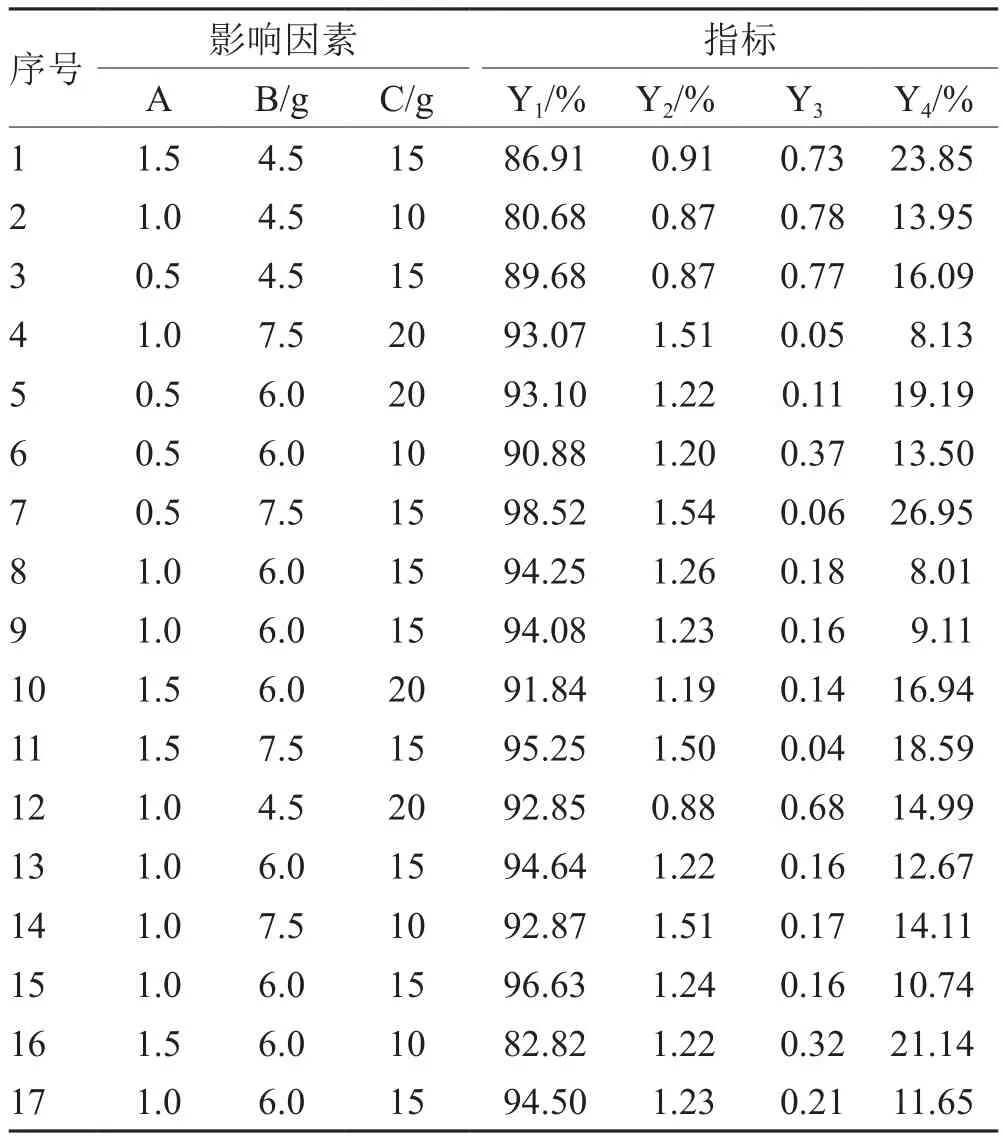
表2 Box-Behnben中心组合方法试验设计及结果
3.3 模型组合
表2数据经多元回归拟合,得到二项式拟合方程。F值均具有显著性且失拟项不显著,相关系数r2>0.9,说明拟合效果准确可靠。见表3。
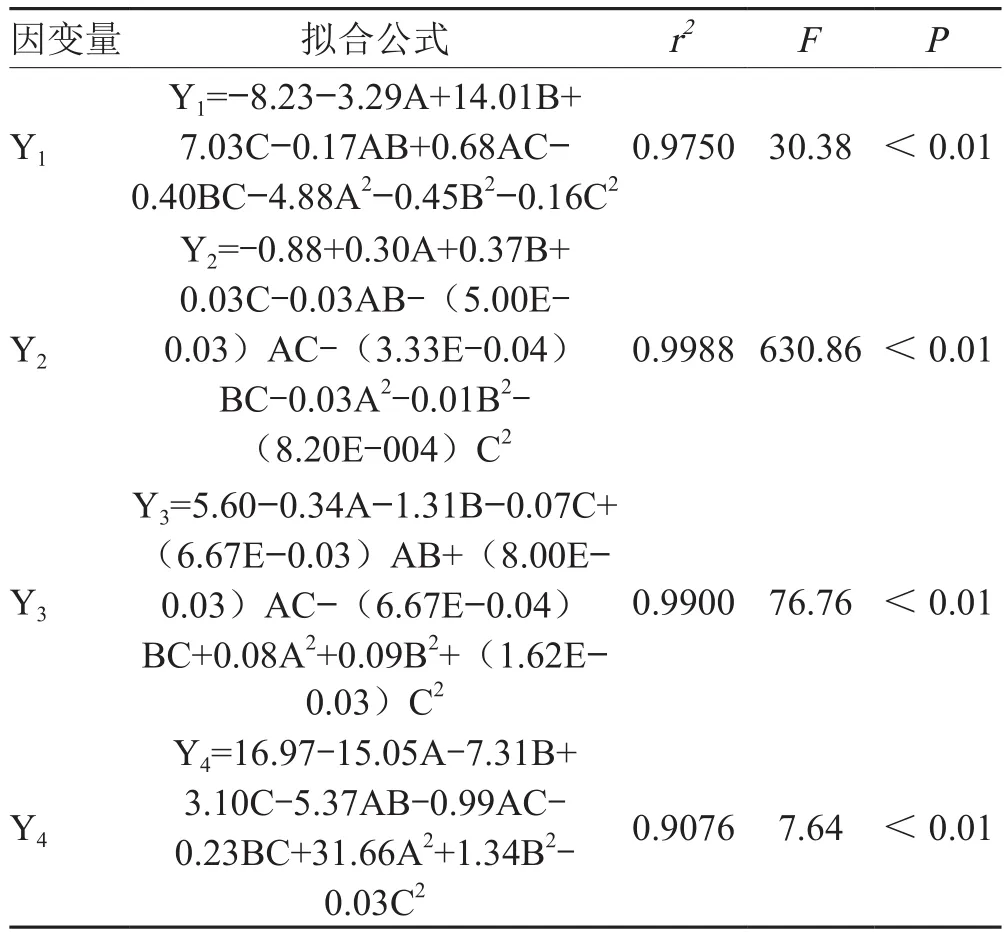
表3 模型拟合结果
3.4 模型分析[11]
根据拟合方程,绘制Cur-ITP处方优化指标随因素变化的效应面图。结果表明,A、B、C三个因素均对合格微丸收率Y1有显著性影响(P< 0.01)。在B值一定的情况下,A值越小,即海藻酸钠比例越高,润湿剂水加入后诱导出的黏性越大,合格微丸的收率越高;但当B、C值均较高时,制得的软材黏度过高,挤出后滚圆时易滚成大丸,导致符合粒径要求的微丸收率降低。
仅B因素对Y2有显著性影响(P<0.01),即处方中姜黄素自微乳用量越大,微丸的载药量越高。但姜黄素自微乳的用量会受到处方中润湿剂水的用量和固体粉末壳聚糖与海藻酸钠用量的制约。总液体量过大,固体粉末难以吸收;姜黄素自微乳用量大,水量少则软材粘性不足,可塑性差,难以成丸。姜黄素自微乳用量小,水量大则软材粘性过大,亦难以成丸。因此,需要在保证软材与成丸质量的前提下尽可能提高处方中姜黄素自微乳的用量。
B、C两因素对Y3有显著性影响(P<0.01),即姜黄素自微乳与润湿剂水的用量对微丸的圆整度影响显著。加入的总液体量越多,软材可塑性越好,Y3值越小,圆整度越高。如前所述,总液体量会受到处方中固体粉末壳聚糖与海藻酸钠用量的制约,姜黄素自微乳与润湿剂水的比例对软材的可塑性与微丸的成型和圆整度亦有重要影响。
A2对Y4有显著影响(P<0.01),表明因素A即处方中壳聚糖与海藻酸钠的比例对微丸的释放度影响显著。当A值较高时,微丸中海藻酸钠用量较少,导致微丸溶散速度较快,突释效应明显,30 min时姜黄素的释放度约30%,且由于微丸中大量壳聚糖的静电吸附作用使2 h时姜黄素的释放度低于70%,缓释作用明显;当A值较低时,海藻酸钠遇水形成的凝胶控制微丸30 min时姜黄素的释放度低于20%。30 min~1 h时海藻酸钠逐渐溶于释放介质,而微丸中壳聚糖的用量较少,静电吸附作用较弱,使1 h时姜黄素的释放度高于50%,均不符合姜黄素平稳释放的预期。故需要根据预期释放特征,合理确定微丸处方中壳聚糖与海藻酸钠的比例。因素与自变量A-C的曲面图,见图1。
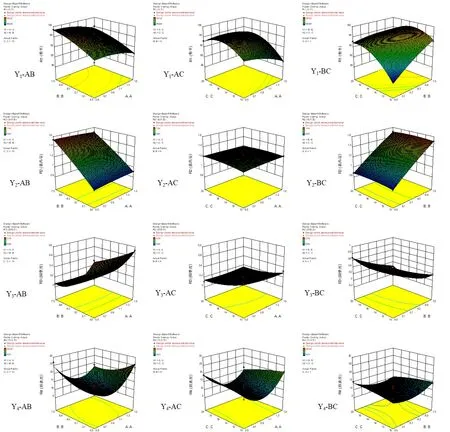
图1 因素与自变量A-C的曲面图
3.5 验证试验
选取Y1、Y2最大,Y3、Y4最小为最优条件,按处方中壳聚糖:海藻酸钠1.07、自微乳7.50 g、水16.86 g制备3批Cur-ITP,依法测定各项指标,所得实测值与预测值基本一致(见图2、表4、图3),说明模型预测性良好,处方工艺稳定。
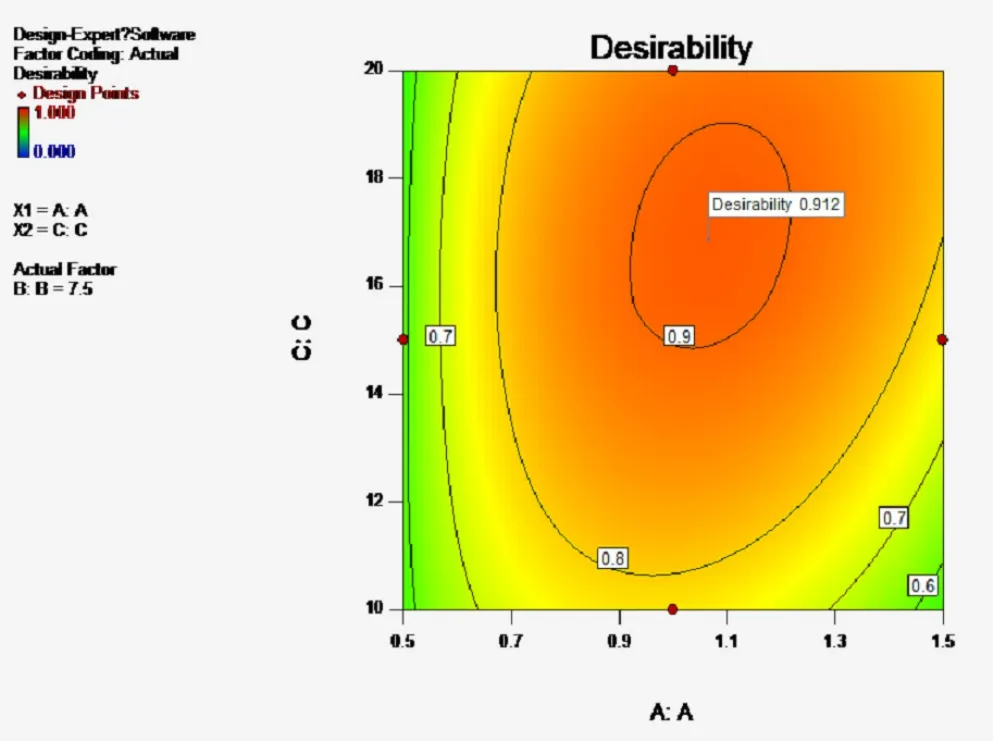
图2 Cur-ITP制备工艺预测值
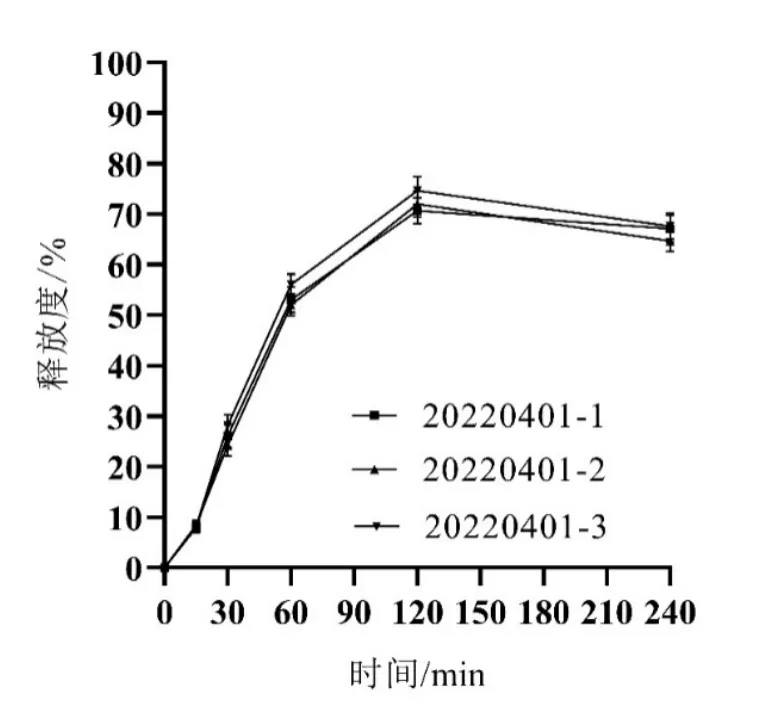
图3 最优处方微丸释放曲线
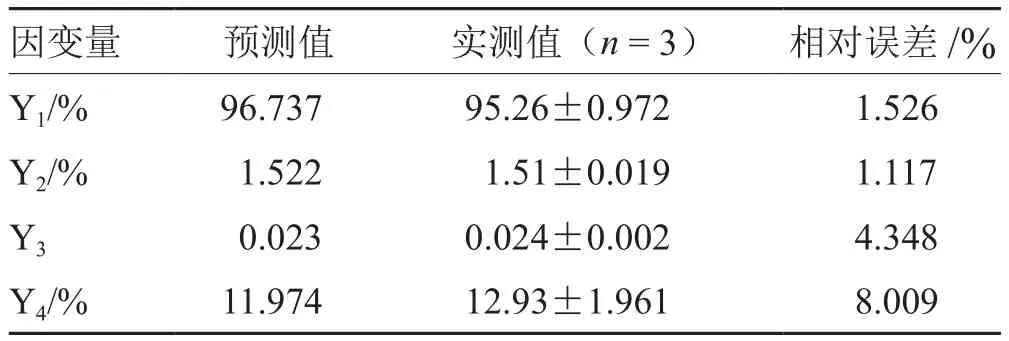
表4 最优处方验证实验
3.6 结肠靶向微丸释放度
由图4可见,包衣微丸在pH 4.5以下的模拟释放介质中基本不释放,pH 6.8以下,包衣膜基本保持完好,含酶与不含酶的释放介质对包衣微丸的释放度影响不大,姜黄素在pH 6.8的模拟释放介质2 h后释放度低于25%,说明包衣微丸可使药物到达小肠末端再释放,结肠靶向性良好。pH 7.4条件下,包衣膜溶解,姜黄素在含酶的人工结肠液中释放度增加,这主要与加入的β-甘露聚糖酶对壳聚糖的分解作用有关。

图4 结肠靶向微丸累积释放度曲线
4 讨论
壳聚糖与海藻酸钠均为天然多糖,在体内具有良好的生物相容性与生物可降解性[12-13],两者常采用乳化交联[14]和离子交联[15]等方法制备结肠靶向微球[16]。本实验前期尝试将姜黄素荷负电自微乳与海藻酸钠混合后喷雾干燥[17],制得的微粉再与壳聚糖溶液进行离子交联制备微球。但由于自微乳中含有较多表面活性剂和助表面活性剂,在交联时姜黄素向水中快速扩散,导致姜黄素微球包封率及载药量均较低。并且微球的突释效应明显,10 min即可释放55%~60%。为解决上述问题,本实验采用壳聚糖与海藻酸钠固体粉末吸附姜黄素荷负电自微乳,再以水为润湿剂制软材,挤出—滚圆法制备微丸,取得了较好的效果,具有工艺简便,载药量高,释放平稳的优点。
本研究结果表明,Cur-ITP的释放效果和处方中壳聚糖与海藻酸钠的比例密切相关。海藻酸钠比例越高,微丸在溶散前释放度越低,但溶散后释放速率较快,释放度最大值较高;壳聚糖比例越高则释放度最大值越低,释放过程中速率越平缓。究其原因,主要与海藻酸钠、壳聚糖的性质和两者与姜黄素荷负电自微乳间的静电相互作用有关。海藻酸钠为羧酸钠盐,在pH7.4的磷酸缓冲液中可溶胀形成凝胶,继而逐渐溶蚀,电离后的羧酸根在溶液中带有负电荷[18],与荷负电自微乳间存在电荷排斥作用。因此,海藻酸钠主要通过溶胀后形成凝胶的粘度和溶蚀速度控制微丸的溶散速度和药物的扩散,对微丸的突释效应影响显著。而壳聚糖为氨基多糖,分子量较海藻酸钠更大,在pH7.4的磷酸缓冲液中溶胀很小,产生的粘性较低,故对微丸的溶散速度影响较小。但其表面的氨基在pH7.4的磷酸缓冲液中带有正电荷[19],与荷负电自微乳间产生电荷吸附作用,可以通过大分子的空间网格结构,以及静电引力控制荷负电自微乳的扩散,从而对微丸溶散后姜黄素的释放起主要控制作用。通过在包衣微丸的累积释放度实验中模拟结肠菌群的作用[20],即在pH7.4的磷酸缓冲液中加入β-甘露聚糖酶[21],使壳聚糖酶解,可显著增加微丸溶散后姜黄素的释放度。
此实验结果验证了上述推论的合理性。

