碳碳双键的一些特殊加成反应
王笃年(正高级教师)
(北京十一学校)
问题1不对称烯烃与HBr等不对称分子的加成产物如何判断?
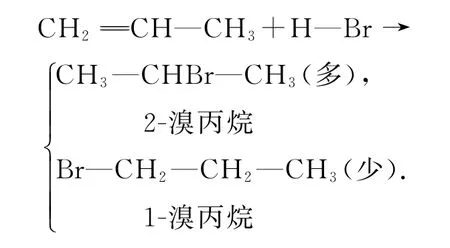
这一规律最早由俄国科学家马尔科夫尼科夫发现,故称马尔科夫尼科夫规则,简称“马氏规则”.
对马氏规则的解释,需用到碳正离子的稳定性规律.烯烃在酸性条件下的加成反应,一般认为是酸的H+先进攻双键,其中一个碳原子把π 电子对“拿过来”与H+共用,结果使另一个碳原子变为碳正离子,然后反应体系内的阴离子再与碳正离子结合,形成加成产物.
对于丙烯这样的不对称烯烃来说,H+有2种不同的进攻方式,相应地就可能形成2种不同的碳正离子.例如
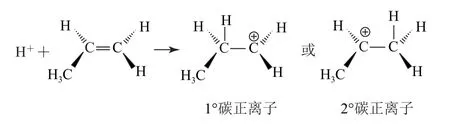
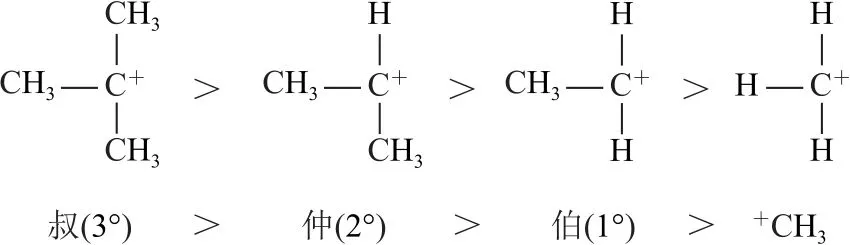
显然,哪一种碳正离子更容易形成,反应就主要向哪一个方向进行.碳正离子也是sp2杂化的,它具有平面结构,未杂化的2p轨道上没有电子,属于缺电子结构,一切能为其提供电子的因素都可以使其稳定性增强、在反应过程中更容易形成.各种碳正离子稳定性的顺序如下页图.不同版本教科书中,也有用诱导效应理论、过渡态理论对此反应历程进行解释的,感兴趣的同学可以课外查阅资料进行多角度理解.
后来研究发现,当有过氧化物存在时,烯烃与HBr(注意! 只是HBr,别的含氢化合物不可)的加成
反应产物是“反马氏规则”的,即
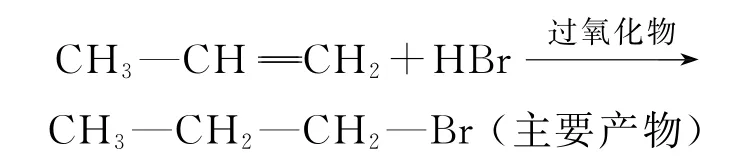
这是因为,在过氧化物存在时,HBr与烯烃发生的是自由基反应(而非前述的离子型反应).第一步是过氧化物形成的氧自由基夺取HBr的氢原子产生溴原子(溴自由基),然后溴原子进攻双键的π电子云,并与其中的一个碳连接,导致另一边的碳原子变为自由基,该自由基再与HBr分子碰撞夺取1个氢原子,形成稳定的加成产物,即
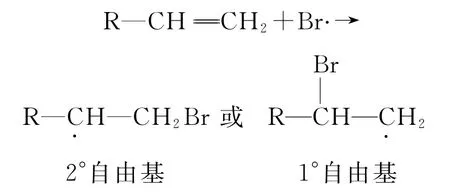
显然,由于2°自由基的稳定性比1°自由基的稳定性强(对自由基稳定性的理解与碳正离子相似),最终产物主要是1-溴丙烷(CH3CH2CH2Br).该加成产物从表面上看起来是“反马氏规则”的.
问题2如何理解1,3-丁二烯的1,4-加成反应?
要理解此问题,需要从1,3-丁二烯的微观结构入手.
从结构式看,1,3-丁二烯的第2、3个碳原子间的单键似乎可以旋转.实际不然,为使整个分子内电荷的分布更均匀,该分子实际上取平面结构,这样使得4个碳原子上未杂化的2p 轨道均处于相互平行的状态,不但第1、2个碳原子间、第3、4个碳原子间存在2p电子云的重叠,而且在第2、3个碳原子间也存在一定程度的2p电子云重叠.原来看似2个不相干的π键之间,建立了一种微妙的联系,形成一种更广泛的电子云重叠关系,π电子云的离域程度增大,似乎4个碳原子一起形成了一个大规模、一体化的π键,称为“大π键”,也叫“离域π键”或“共轭π键”.
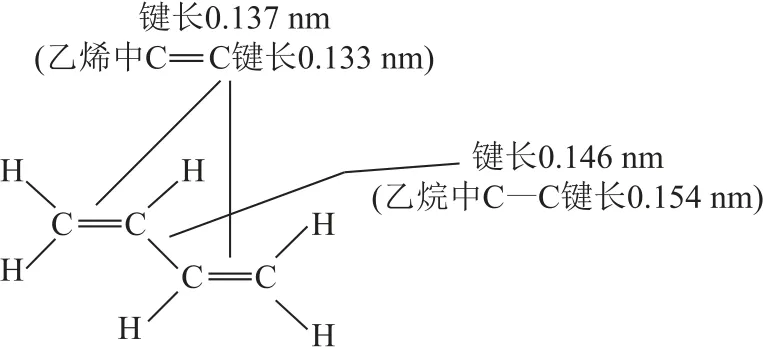
实验事实告诉我们,1,3-丁二烯与少量Br2发生1∶1加成时,有如下2种主要产物,即

1,2-加成产物似乎比较容易理解,它可看作Br2分子对其中1个双键的加成结果.事实上,根据上述关于1,3-丁二烯分子结构的分析,该分子是一个整体,第1个Br接到1位碳上后,分子变为1个有单电子的不稳定状态,因此第2个Br接到第2、3、4位的可能性都是存在的.如果Br接到第2位碳上则形成1,2-加成产物;如果接到第3位碳上,那么第2、4位2个碳原子的单电子呈不稳定态(它俩若相连形成三元小环不稳定,最终变成其他的稳定态);如果Br接到第4位碳上,中间的第2、3位碳的单电子则可以相互结合形成一个新的π键,这便是1,4-加成产物.
共轭二烯烃独有的1,4-加成反应,是其发生D-A反应(“狄尔斯—阿尔德反应”的简称,或称“双烯合成反应”,对此感兴趣的同学可深入学习大学有机化学)形成六元环结构以及用于合成橡胶类化合物的性质基础.
问题3橡胶的合成与硫化过程中,双键发生了怎样的变化?
绝大多数合成橡胶都用到了共轭二烯烃单体.由此我们可猜测橡胶的独特物理性质——弹性也许与共轭二烯烃加聚产物中依然存在大量双键有关.
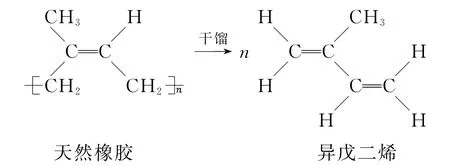
比如,天然橡胶可看作是异戊二烯(2-甲基-1,3-丁二烯)的1,4-加聚产物.人们之所以知道这一点,是因为最初干馏天然橡胶时,得到了异戊二烯这一物质,即
人们根据天然橡胶的结构特点,设计并合成了很多种橡胶材料.例如
顺丁橡胶(聚1,3-丁二烯):

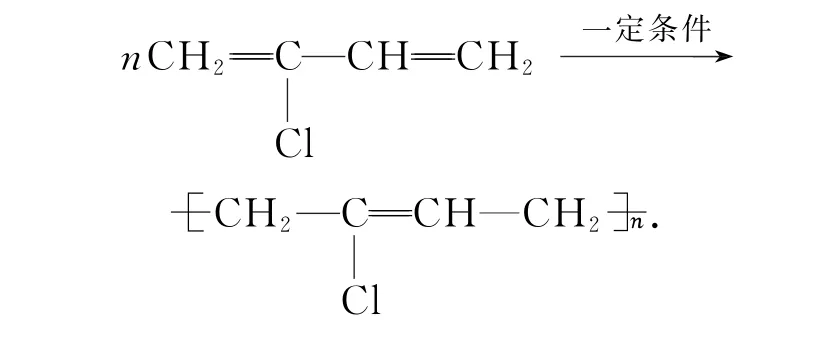
氯丁橡胶(聚2-氯-1,3-丁二烯):
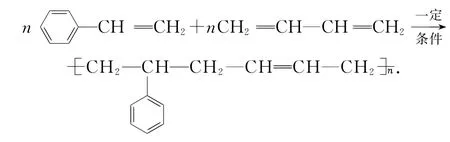
丁苯橡胶(苯乙烯与1,3-丁二烯共聚产物):
丁腈橡胶(丙烯腈与1,3-丁二烯共聚产物):
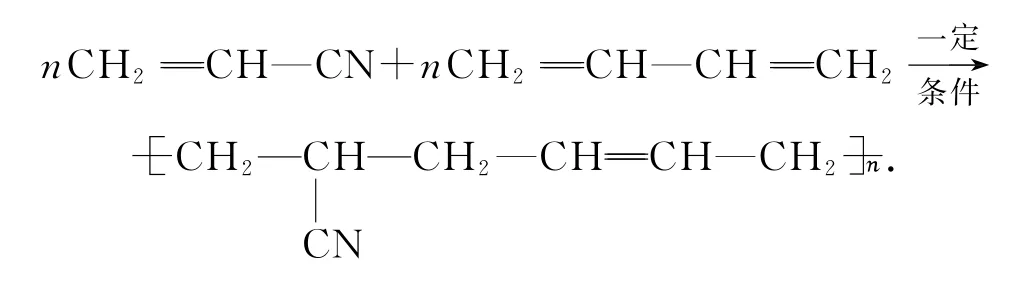
这些橡胶虽然都是高分子,但由于是线型结构,相对分子质量还不够大,故熔点较低,不耐热;又因分子中含有大量的双键,易被氧化而老化,不实用.直到1839 年,美国人古德伊尔(C.Goodyear)发明了橡胶的硫化技术,才使橡胶制品真正进入人们的生活.
如果到了一家轮胎厂,你会看到橡胶制品的生产过程是这样的:把生橡胶与炭黑及一定比例的硫粉混合在一起,做成各种轮胎的模样(这时的轮胎很容易变形,根本不可能安装到汽车上使用,甚至用手就可以把它捏扁),然后把它放到硫化炉内加热一段时间,出炉后的橡胶轮胎就是可以安放在汽车上的成品了.
上述的这个操作过程就叫橡胶的硫化.硫化过程发生的变化是:链状高分子中的一些双键被打开,碳原子与硫原子相接,通过单硫键(—S—)、双硫键(—S—S—)等,把原来的链状(线型)高分子化合物转化为网状(体型)高分子化合物,即
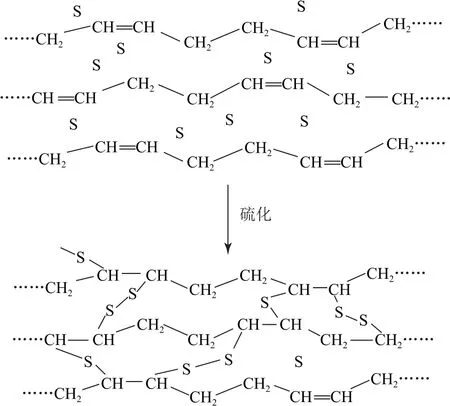
对比硫化前后的结构我们可以发现,橡胶主要发生了2点变化:一是双键的数量大大减少,提高了橡胶制品的抗老化能力(不易被氧化);二是线型结构变为体型结构,相对分子质量大为提高,不仅熔化温度升高,而且弹性和机械强度增大.可以说,正是硫化技术的发明推进了橡胶的实用化.
不同的橡胶制品,其硫化程度是不同的.硫化程度越大,则橡胶制品的硬度越大、弹性变差,如自行车外胎就比内胎的硫化程度要大一些,完全硫化的橡胶则已经不再具备橡胶的弹性特质,比如20 世纪中期流行的硬质唱片.凡是具有弹性的橡胶制品,都因含有碳碳双键(卤素单质会与碳碳双键加成)加速其老化.这也是为什么盛放氯水、溴水等的试剂瓶不可使用橡胶塞的原因.

(完)
——碳正离子的产生及稳定性比较

