C2H2锌指转录因子FpCzf7参与假禾谷镰孢的生长和致病性
赵静雅 彭梦雅 张时雨 单艺轩 邢小萍 施艳 李海洋 杨雪李洪连 陈琳琳
(河南农业大学植物保护学院 小麦玉米作物学国家重点实验室 河南省粮食作物协同创新中心,郑州 450002)
假禾谷镰孢(Fusarium pseudograminearum)引起的小麦茎基腐病是一种世界范围内广泛发生的土传病害,每年造成非常严重的产量和经济损失[1-2]。2012年Li等[2]首次在中国河南省发现假禾谷镰孢引起的小麦茎基腐病,近年来由于秸秆还田造成菌源积累和品种抗性差等原因,导致该病在中国黄淮和华东麦区广泛蔓延分布,尤其是在黄淮麦区已成为威胁小麦生产的主要病害[3-4]。与其他镰孢菌类似,假禾谷镰孢产生的脱氧雪腐镰刀菌烯醇(DON)等毒素严重影响人和家畜的身体健康[5],假禾谷镰孢侵染小麦穂部引起赤霉病,引发食品安全问题。但是目前关于假禾谷镰孢致病相关基因的研究报道还比较少。
转录因子(transcription factors)能够结合特定的DNA位点,通过DNA-蛋白互作、蛋白-蛋白互作或者染色质结构的改变来激活或抑制基因的转录。其中,C2H2锌指(Cys2/His2 Zinc-Finger,CZF)转录因子是真核生物中普遍存在的一类庞大的转录因子家族,在人类中有700多个C2H2锌指转录因子[6],拟南芥(Arabidopsis thaliana)中有176个C2H2锌指转录因子[7-8],稻瘟菌(Magnaporthe oryzae)和禾谷镰孢中分别鉴定到89和91个C2H2锌指转录因子[9-10]。C2H2锌指转录因子的生物学功能涉及广泛,Cao等[11]分析了稻瘟菌中的47个C2H2基因的功能,发现有44个基因参与病原菌的生长、分生孢子产生、附着胞的形成或者致病性[9];受Pmk1丝裂原活化蛋白激酶途径调控的C2H2锌指转录因子ZNF1通过参与脂滴和糖原的调动和降解影响稻瘟菌附着胞的发育,从而影响致病性[11]。
Son等[10]分析了禾谷镰孢中91个C2H2锌指转录因子的功能,鉴定到16个与赤霉病的发生相关;C2H2基因pcs1正调控禾谷镰孢的无性和有性孢子的产生,基因微阵列实验发现G蛋白相关途径、过氧化物酶激活、核糖体生物合成以及RNA结合等途径的基因依赖于pcs1大量富集[12]。此外,在其他镰孢菌中也有多种C2H2锌指转录因子的功能进行报道,例如,C2H2转录因子FolCzf1对尖孢镰孢番茄专化型的分生孢子产生、次级代谢以及早期侵染是必须的[13];C2H2锌指转录因子对轮枝镰孢孢子囊的产生非常关键,并通过调控下游的FvSTUA基因影响分生孢子的产生[14]。
前期,我们报道了C2H2锌指转录因子FpCzf14对假禾谷镰孢分生孢子的产生非常关键[15]。本研究在假禾谷镰孢中鉴定到一个编码C2H2锌指转录因子的基因FpCzf7,其参与了假禾谷镰孢的菌丝生长、分生孢子产生和致病性,相关研究结果将为进一步解析C2H2锌指转录因子调控假禾谷镰孢致病过程的分子机理提供基础。
1 材料与方法
1.1 材料
假禾谷镰孢菌株WZ2-8A由河南农业大学植物保护学院植物病害监测与防控课题组分离自田间病株,经鉴定后保存。小麦品种矮抗58由国家小麦工程技术研究中心提供,大麦品种啤酒大麦购自秋乐种业。大肠杆菌感受态菌株DH5α和质粒pKOV21(含有潮霉素磷酸转移酶基因HPH),质粒pKNTG,均由本实验室保存。
1.2 方法
1.2.1FpCzf7基因的鉴定与其在侵染阶段的表达(实时荧光定量PCR) 根据禾谷镰孢中已知的转录因子[10],利用Blastp的方法在假禾谷镰孢中鉴定编码C2H2型锌指转录因子的基因FPSE_08586,并在NCBI上下载其在F. pseudograminearumCS3096菌株中的基因与蛋白序列。利用SMART及Pfam数据库预测其蛋白的结构域。采用实时荧光定量PCR方法检测FpCzf7在侵染阶段的表达水平,FpTEF1基因作为内参,所用引物在表1中列出。在PDA培养基中将野生型菌株培养3 d,在菌落边缘取两个5 mm的菌饼放置在CMC液体培养基中,25℃、150 r/min摇培4 d获得分生孢子。用10 μL分生孢子悬浮液(1×107/mL)侵染小麦幼苗的胚芽鞘,分别取侵染18 h、30 h、2 d、3 d、5 d、7 d的发病区,立即放于液氮中冻存,研磨后用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根,北京)提取总RNA。利用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(宝生物,大连)进行反转录。
将反转录获得的cDNA进行荧光定量PCR,根据目的基因序列用软件primer5.0和DNAMEN设计引物RTF和RTR,引物列于表1中,以FpTEF1为内参。反应体系为:TB Green Premix Ex Taq Ⅱ 6 μL,引物各0.5 μL,cDNA 1 μL,ddH2O 4 μL。反应程序:95℃/2 min;在95℃ /15 s,60℃/ 15 s,68℃/20 s,40个循环;在95℃/15 s,60℃/15 s和95℃/15 s得到融解曲线。

表1 本研究用到的引物Table 1 Primers used in this study
1.2.2FpCzf7基因敲除、回补及检测 假禾谷镰孢野生型WZ2-8A菌株在PDA培养基上、25℃活化,用CTAB法提取基因组DNA。用Split-PCR方法,以假禾谷镰孢野生型基因组DNA为模板,经过3轮PCR扩增构建同源重组序列进行基因敲除。所用引物列于表1中。第一轮PCR,以假禾谷镰孢野生型基因组DNA为模板,分别用引物F1+R1和F2+R2扩增,得到964 bp的FpCzf7上游片段A1和997 bp的下游片段A2,以质粒pKOV21为模版,用引物HYG/F+HYG/R扩增1 350 bp的潮霉素片段H。PCR体系中含有25 μL Premix Taq,正反向引物各1 μL,100 ng假禾谷镰孢基因组DNA,ddH2O补足50 μL。PCR反应条件如下:在94℃预变性5 min;94℃变性30 s、58℃退火30 s、72℃延伸1 min(根据片段大小不同延伸时间不同,1 000 bp/min),循环35次;72℃再延伸10 min。第二轮PCR,以第一轮PCR产物为模板,按照片段浓度比例A1∶A2∶HPH=1∶1∶3混合。反应体系为5 μL 10×LA Taq buffer,2 μL dNTPs,0.2 μL LA Taq,2 μL上游片段A1,2 μL下游片段A2,6 μLHPH基因片段,32.8 μL ddH2O。PCR反应条件如下:94℃预变性5 min;94℃变性30 s、58℃退火30 s、72℃延伸3 min 30 s,15个循环。第三轮PCR,以第二轮PCR产物为模板,用引物F1+HY/R和YG/F+R2,分别获得1 762 bp的FpCzf7和HPH上游融合片段A1H1及1 928 bp的HPH和FpCzf7下游融合片段H2A2。PCR反应体系:25 μL Premix Taq,2 μL引物,2 μL第二轮产物,ddH2O补足50 μL。PCR反应程序如下:94℃预变性5 min;94℃变性30 s、58℃退火30 s、72℃延伸2 min,35个循环;72℃再延伸10 min。利用PCR产物纯化回收试剂盒(诺唯赞,南京)对PCR产物纯化回收,通过PEG介导的原生质体转化方法将A1H1和H2A2导入假禾谷镰孢野生型菌株中[17]。
利用潮霉素抗性筛选阳性转化子,提取基因组DNA进行PCR检测。引物H850F+H852R检测潮霉素基因;F3+H855R和H856F+R3分别用于FpCzf7上游、下游与潮霉素的融合;G1+G2用于FpCzf7基因的检测。扩增去掉终止密码子的FpCzf7基因及其上游约1 500 bp左右的启动子序列,构建到pKNTG载体上,通过PEG介导的原生质体转化方法转入Δfpczf7-T1中,通过PCR检测回补转化子。
1.2.3 生长测定 为了检测FpCzf7对假禾谷镰孢菌丝生长和菌落特征的影响,将突变体Δfpczf7、回补菌株Δfpczf7-cp和野生型菌株WT在PDA平板上活化。然后,用打孔器在菌落边缘打孔(直径5 mm),取菌饼接种在装有15 mL新鲜PDA平板的中央,放置在25℃培养箱培养,3 d后测量菌落大小,并拍照。在显微镜(Nikon Eclipse Ti-S)下观察菌丝体形态。
1.2.4 分生孢子的产生及萌发 在PDA培养基上将Δfpczf7、Δfpczf7-cp和WT菌株培养3 d,分别在菌落边缘取两个直径5 mm的菌饼接种在60 mL CMC中,25℃、150 r/min摇培4 d。通过一层miracloth滤布过滤获得分生孢子,用血球计数板计数并拍照。取适量无菌水将孢子稀释至相同浓度(~5×105个/mL),在25℃条件下萌发3 h,然后在显微镜下分别观察孢子的萌发情况,每个生物学重复数1 000个分生孢子,以100个孢子为一组,总共10组,计算分生孢子的萌发率并拍照。
1.2.5 致病性测定 为了研究假禾谷镰孢对大麦叶片和小麦胚芽鞘的致病性,分别在Δfpczf7、Δfpczf7-cp和WT菌株的菌落边缘取两个直径5 mm的菌饼放置在大麦叶片上,黑暗保湿培养24 h后去掉菌饼,然后在16 h光照、8 h黑暗中培养2 d后记录叶片病斑直径并拍照。分别在菌落边缘取一个5 mm的菌饼放置在小麦胚芽鞘上,黑暗保湿培养24 h后去掉菌饼,继续培养2 d记录病斑长度并拍照。盆栽接种试验方法,将活化好的Δfpczf7、Δfpczf7-cp和WT菌丝块接入到小米培养基上进行扩繁,按0.5%的比例将长满菌丝的小米培养基混合在无菌土中,每钵种10粒小麦种子。16 h光照、8 h黑暗中培养10 d后记录小麦的生长状况和发病程度。小麦茎基腐病采用Poole等[18]的分级标准,0级:植株未发病;1级:地中茎明显变褐或第一叶鞘出现轻微症状;3级:第一叶鞘明显变褐,但叶鞘未变黑;5级:第一叶鞘变黑或者第二叶鞘变褐;7级:第三叶鞘出现变褐症状,或植株因发病而发育迟缓或接近死亡;9级:植株因发病而死亡。病情指数=∑(病情等级×各病级发病株数)/(调查总株数×分级标准中最高级别数)×100,使用t检验分析数据。
为测定假禾谷镰孢对小麦穂部的致病性,用分生孢子悬浮液侵染扬花期的小麦穗。用CMC液体培养基摇培获得Δfpczf7、Δfpczf7-cp和WT菌株的分生孢子,将孢子浓度调至5×106个/mL备用。将小麦穗中上部的颖壳剪伤,每穗剪伤两处,取10 μL孢子悬浮液接种至剪伤处,每个假禾谷镰孢菌株接种30穗。接种后喷洒灭菌蒸馏水并套袋保湿3 d,并在接种20 d后调查发病情况。
1.2.6 DON毒素测定 在小米培养基上扩繁Δfpczf7和WT菌株,25℃黑暗培养10 d至小米表面完全长满菌。以接种无菌PDA块培养相同时间的小米培养基作为空白对照(CK)。取5 g小米样品研磨至粉末状,利用北京华安麦科生物技术有限公司的呕吐毒素ELISA检测试剂盒(HEM0896),参照说明书操作,检测DON即呕吐毒素的含量。
1.2.7 数据分析 数据采用Excel工作表和SPSS软件分析。表型及致病性测定实验至少进行3次,每次3-5个重复,利用方差分析和t检验分析数据,P<0.05具有统计意义。
2 结果
2.1 FpCzf7基因的鉴定与转录分析
根据禾谷镰孢中已知的转录因子[10],利用Blastp的方法在假禾谷镰孢中鉴定到一个编码C2H2型锌指转录因子的基因FPSE_08586,根据蛋白同源性将其命名为FpCzf7。该基因全长2 009 bp,包含2个内含子,编码含有635个氨基酸的蛋白质,包含6个保守的C2H2型锌指基序(图1-A)。通过实时荧光定量PCR方法,分析FpCzf7在假禾谷镰孢侵染阶段的表达,发现FpCzf7在菌丝中的表达量较高,在侵染初期表达量降低,但是在侵染后期的表达量与菌丝中类似。猜测其在假禾谷镰孢的菌丝生长和侵染扩展过程中起作用(图1-B)。
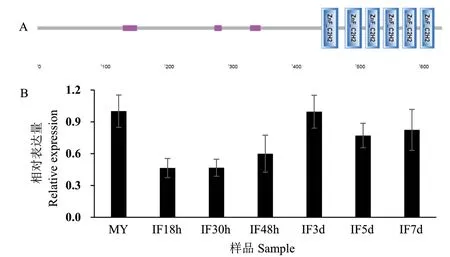
图1 FpCzf7的结构域及基因转录水平Fig. 1 Domains and expression levels of FpCzf7 in F. pseudograminearum
2.2 FpCzf7基因缺失菌株的获得
为了分析FpCzf7在假禾谷镰孢中的生物学功能,利用split PCR的方法扩增获得FpCzf7上游-潮霉素以及潮霉素-FpCzf7下游的融合片段(图2-A)。通过PEG介导的原生质体转化方法将重组片段转入假禾谷镰孢WZ2-8A中,利用潮霉素抗性筛选和PCR验证FpCzf7缺失突变体。如图2-B所示,在3个候选转化子中均检测到潮霉素(H)、FpCzf7上游-潮霉素(F)以及潮霉素-FpCzf7下游(R)的融合片段,但是无法扩增到FpCzf7基因,由此获得FpCzf7被潮霉素基因置换掉的菌株。克隆FpCzf7基因全长及其上游1 518 bp的启动子区域,构建真核表达载体pKNTG,利用PEG介导的原生质体转化的方法导入Δfpczf7-T1菌株,获得FpCzf7基因回补的转化子。
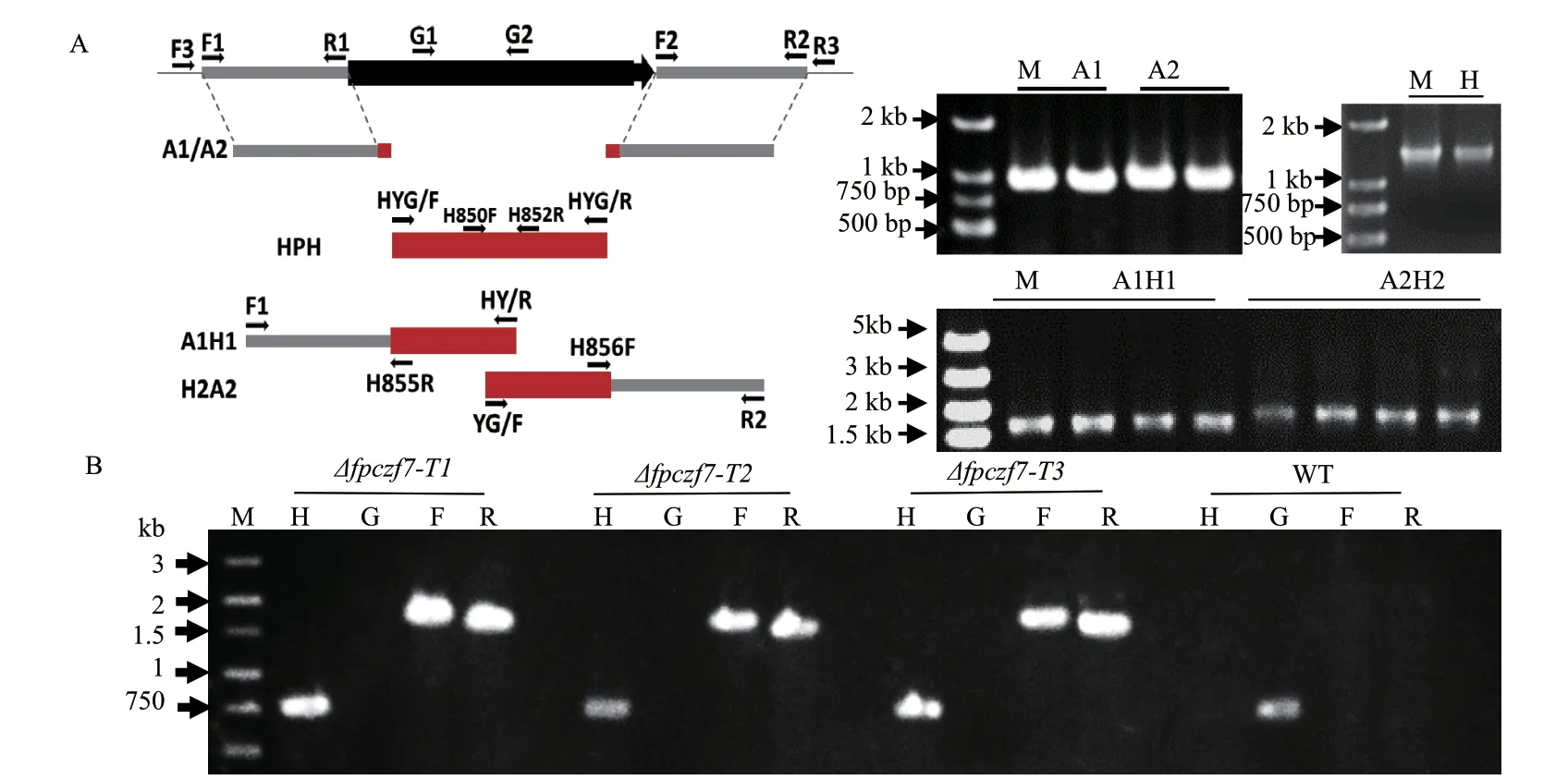
图2 假禾谷镰孢FpCzf7基因的敲除Fig. 2 FpCzf7 gene knockout in F. pseudograminearum
2.3 FpCzf7对假禾谷镰孢的生长非常关键
为了分析FpCzf7的缺失对假禾谷镰孢营养生长的影响。将活化的假禾谷镰孢野生型、Δfpczf7、Δfpczf7-cp菌株转接到PDA培养基上,25℃、黑暗培养3 d,观察菌丝生长速率及菌落形态。结果显示,与野生型和回补菌株相比,Δfpczf7突变体菌丝生长速度明显减慢,气生菌丝减少,无明显的粉红色色素积累(图3-A、B)。显微观察菌丝的形态,发现Δfpczf7突变体菌丝的粗细和分支与野生型和回补菌株类似。以上结果说明,FpCzf7对假禾谷镰孢的菌丝生长速率非常关键。
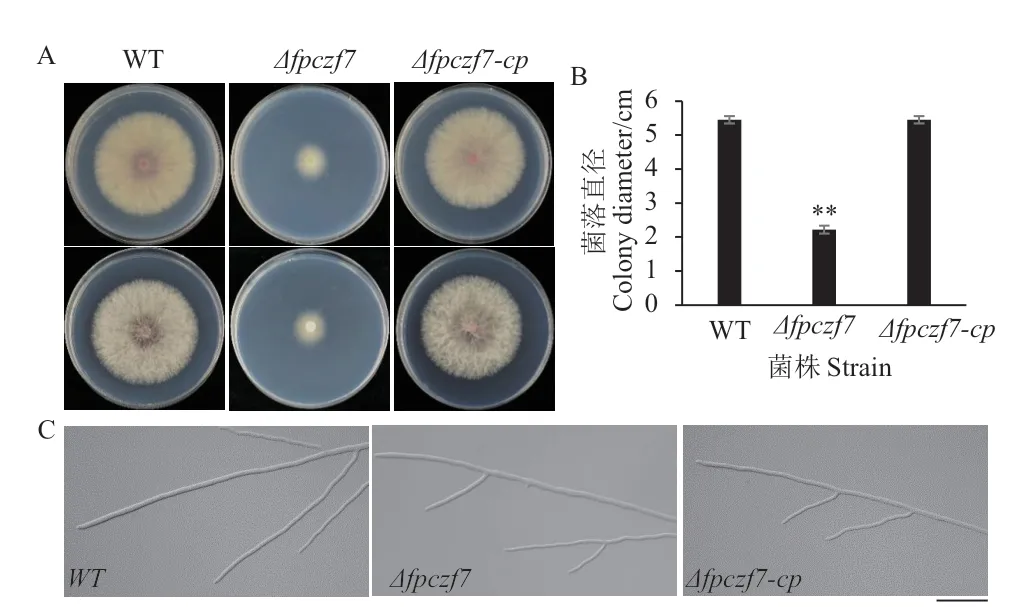
图3 野生型(WT)、Δfpczf7和Δfpczf7-cp在PDA平板上生长的菌落和菌丝测定Fig. 3 Mycelia growth and morphology assays of WT,Δfpczf7 and Δfpczf7-cp on PDA plates
2.4 FpCzf7缺失突变体分生孢子产生减少
分别取活化的假禾谷镰孢野生型、Δfpczf7和Δfpczf7-cp菌落边缘菌饼,转接到CMC培养液中诱导分生孢子的产生,25℃、黑暗、150 r/min摇培4 d后收集孢子。与野生型相比,Δfpczf7突变体分生孢子的数量下降了约35%,而回补菌株的产孢量可以恢复到野生型的水平(图4-A、B)。假禾谷镰孢野生型、Δfpczf7和Δfpczf7-cp产生的分生孢子形态及隔膜数无明显差异(图4-A)。
将假禾谷镰孢野生型、Δfpczf7和Δfpczf7-cp的分生孢子在无菌水中刺激萌发,25℃、黑暗培养3 h后观察结果,发现Δfpczf7与野生型和回补菌株分生孢子的萌发率无明显差异(图4-A、C)。以上结果说明FpCzf7可能参与了假禾谷镰孢分生孢子的产生。
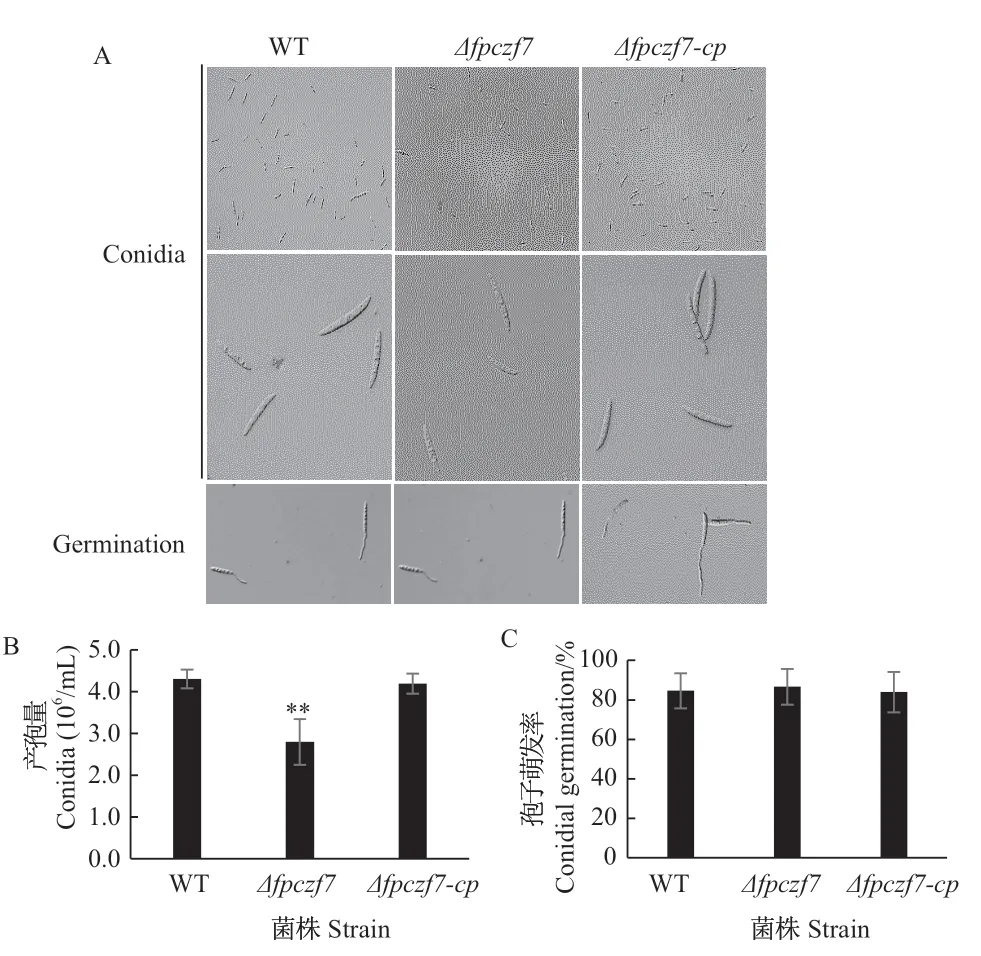
图4 分生孢子产生和萌发测定Fig. 4 Conidia production and germination assays
2.5 FpCzf7的缺失影响假禾谷镰孢的致病力
取活化的假禾谷镰孢野生型、Δfpczf7和Δfpczf7-cp菌落边缘菌饼,分别接种在大麦叶片和小麦胚芽鞘上,25℃、黑暗、保湿培养24 h后去掉菌丝块,继续保湿培养2 d,观察植物的发病。结果显示,野生型和回补菌株在大麦叶片和小麦胚芽鞘上均能侵染并形成明显扩展的病斑,而Δfpczf7突变体侵染的植物病斑明显减小(图5)。
为了进一步确定FpCzf7缺失突变体的致病力,利用盆栽实验模拟大田小麦茎基腐病的发生。萌发的小麦种植到0.5%的菌土中,10 d后观察小麦的出芽率、株高和茎基腐病的发生情况(图6-A)。与未接种的小麦相比,野生型和回补菌株接种的小麦出苗率较低,小麦生长明显减慢,茎基部有明显的褐色病斑。而Δfpczf7突变体接种的小麦生长与对照类似,茎基部发病明显减轻(图6-A、B)。利用假禾谷镰孢野生型、Δfpczf7和Δfpczf7-cp的孢子悬浮液接种扬花期小麦穗,接种20 d后,与假禾谷镰孢野生型和回补菌株相比,Δfpczf7突变体引起的赤霉病症状明显减轻(图6-C)。以上结果说明FpCzf7的缺失导致假禾谷镰孢的致病性明显降低。
2.6 FpCzf7的缺失影响假禾谷镰孢DON毒素的产生
与其他镰孢菌类似,假禾谷镰孢在侵染过程中也可产生大量DON毒素。利用DON毒素ELISA检测试剂盒,检测了WT和Δfpczf7菌株DON毒素的产生,无菌小米培养基为空白对照(CK)。结果显示,野生型菌株可以产生大量的DON毒素,长满菌丝的小米中DON含量可达到176.89 μg/kg。同等条件下,长满Δfpczf7菌丝的小米中DON毒素含量仅为17.1 μg/kg(图7)。以上结果说明,FpCzf7的缺失影响假禾谷镰孢DON毒素的产生,可能是其致病性降低的原因之一。
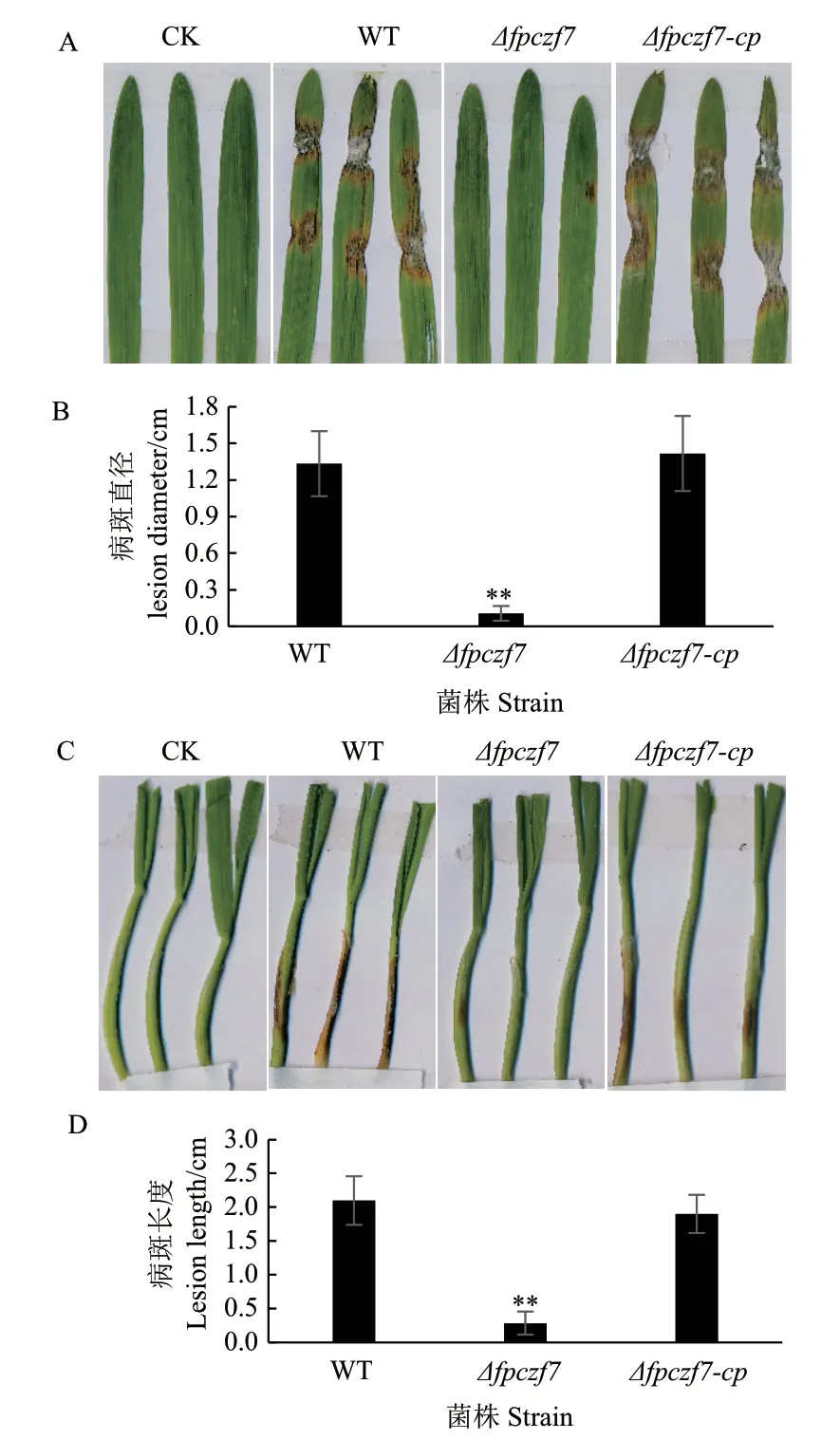
图 5 大麦叶片和小麦胚芽鞘接种Fig. 5 Inoculation on barley leaves and wheat coleoptiles
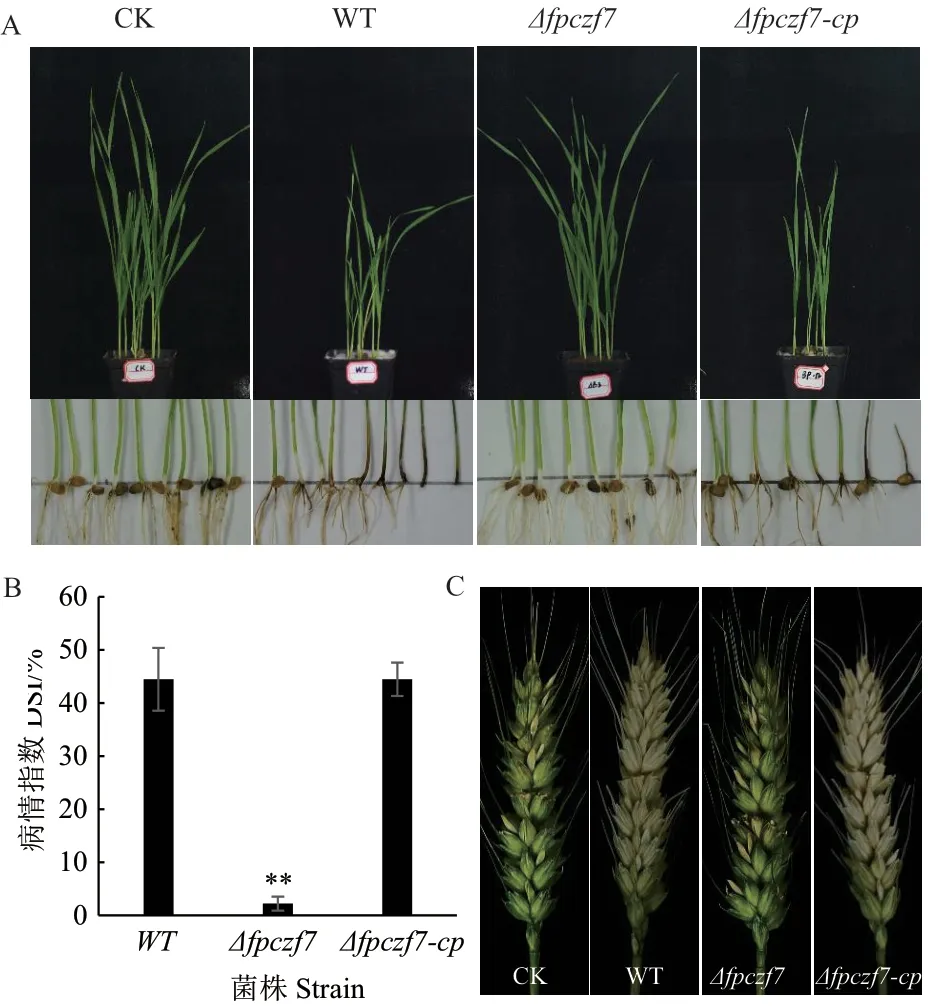
图 6 小麦盆栽和小麦穗接种实验Fig. 6 Experiments of pot-culture and wheat heads inoculation

图 7 DON毒素的产生Fig. 7 DON production
3 讨论
锌指转录因子是真核生物中最大的转录因子家族之一,根据组氨酸和半胱氨酸的位置及数量,可以分为C2H2、C2HC、C2HC5、C2C2、CCCH、C3HC4、C4、C4HC3、C6和C8[19]。其中C2H2锌指转录因子在真菌中调控多种信号转导途径及生物学过程。已有研究发现,C2H2同源蛋白在不同真菌中具有不同的调控作用。例如,Msn2和Msn4在酿酒酵母中通过应激响应元件激活基因的转录以应对逆境胁迫,而其同源蛋白在白色念珠菌的胁迫响应过程中无明显作用[20-21];番茄尖孢镰孢C2H2锌指转录因子FolCzf1及其在禾谷镰孢和稻瘟菌中的同源蛋白GzC2H003和Gcf3均参与病原菌的营养生长和分生孢子产生。此外,FolCzf1还调控番茄尖孢镰孢分生孢子的形态、次级代谢和致病性,而稻瘟菌Gcf3的缺失不影响色素的合成和附着胞的功能,禾谷镰孢GzC2H003缺失突变体DON毒素的合成与野生型相比无明显变化[9-10,13]。
研究者对假禾谷镰孢的关注相对较晚,其与禾谷镰孢的亲缘关系非常近,曾一度被作为禾谷镰孢的一个类群,后来通过分子手段将其单独列为一个种[22-23]。随着研究的深入,发现假禾谷镰孢与禾谷镰孢在多个方面有明显差异,比如假禾谷镰孢有性生殖属于异宗配合,且在实验室条件下很难获得其子囊壳;禾谷镰孢在温暖潮湿的环境下容易侵染,而假禾谷镰孢更偏向在干旱冷凉地区侵染小麦造成小麦茎基腐病[1]。猜测假禾谷镰孢可能与禾谷镰孢具有不同的致病调控机制,由此研究假禾谷镰孢致病的分子机制,不仅为病害防治提供理论基础,也为了解镰孢菌的致病性分化提供依据。
本研究中,在假禾谷镰孢中鉴定到一个C2H2锌指转录因子FpCzf7,可以稳定高表达,与野生型和回补菌株相比,FpCzf7缺失突变体菌丝生长明显减慢、分生孢子产生减少、对大麦和小麦的致病性显著降低、DON合成减少。在禾谷镰孢中,其同源基因GzC2H007的缺失突变体完全不能产生有性孢子和无性孢子、不能产生DON毒素、致病性完全丧失,但是对菌丝生长的影响较小[10]。对应同源基因缺失突变体的相关表型,FpCzf7在真菌致病性和DON合成中的表型一致,但是对其生长和产孢的影响具有明显分化。本研究可为进一步了解其在假禾谷镰孢生长、产孢和致病过程中的作用机制提供基础。
4 结论
C2H2锌指转录因子FpCzf7的缺失导致假禾谷镰孢的菌丝生长、分生孢子产生、致病性和DON毒素产生均明显降低,推测其参与假禾谷镰孢的生长、产孢和致病性。研究结果将为进一步解析FpCzf7的靶标及其调控病原菌致病过程的机制提供信息。