不同树龄桑根际土壤原生生物群落组成多样性
王子夜 王志刚 阎爱华
(1. 河北农业大学林学院,保定 071000;2. 河北省林木种质资源和森林保护重点实验室,保定 071000;3. 河北省城市森林健康技术创新中心,保定 071000)
原生动物种类繁多,广泛存在于海洋、森林、农田等各生态系统,通过土壤初级生产、菌物捕食、动植物饵料和病原物等多层次作用调节土壤生产力,控制微生物群落组装,影响植物生长,其种群落结构的变化往往会影响到土壤-植物系统微食物网及生态系统结构的变动,对于维持土壤能量养分循环的强度和稳定性尤其重要[1-3]。研究表明,温度、地理环境、海拔、土壤性质甚至土壤大型动物都会对原生生物多样性产生影响,而地上部植物功能类群主导了原生生物种群多样性建成[4-5]。但当前土壤微生物组研究的重点集中在细菌、真菌和单类群原生生物类别的互作关系,探讨完整的土壤原生生物组在土壤生态系统中的种群分布、关键功能的研究仍很缺乏[6-7]。
林木生长周期长,营林措施频繁,为应对不同环境挑战,发展出独特的生理适应性与缓解策略,土壤作为生态环境的重要组成部分,了解原生生物群落在土壤中产生和维持的机制对于理解其生物功能,维持林木-土壤良性循环,促进林木生产力提高至关重要[8]。树龄不仅影响树体形态建成、营养获取和免疫抗逆能力,还与土壤理化结构和和水肥营养状况相关,随着树龄增长,林木共生体(symbiont)内生和外生真菌、细菌的种群和功能多样性在时间空间都上都表现出差异[9-11],但目前作为林木根际土壤微生态三级营养层次的关键环节,树龄对土壤原生生物种群多样性和群落构建的影响仍缺乏系统研究[12-13]。
桑(Morus albaL.)是中国传统药食兼用的资源植物,也被广泛用于土壤生态修复,具有良好的生态效益和社会效益。河北省桑树种植历史悠久,东南部古桑树群为研究桑土壤原生生物群落多样性演化提供了宝贵的资源。本研究按照空间换时间法,以同时期同桑园同品种的根际土壤样品替换传统不同时间采集不同树龄根际土壤样品为试验材料,通过Illumina高通量测序和生物信息学分析,探讨古桑园不同树龄桑(10a、80a和200a)根际土壤原生生物种类多样性差异和功能类群演变,明确影响原生生物群落构建和稳定性的不同环境因子和生物因子,为进一步探讨原生生物种群分化机制和生态服务功能提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验地概况 样品采自河北农业大学营子定位站,地理位置坐标为116°2'5''E,37°54'13''N。属暖温带湿润大陆性季风气候区,又属冀南暖湿轻干旱区。年平均气温12.7℃,无霜期187 d,年均日照2.78 h,年均降水543 mm。土壤由古河流冲积形成,层理清晰,土层深厚,疏松涵润,园区统一常规管理。
1.1.2 样品的采集及处理 本研究以同桑园的幼龄树(10a)、中龄树(80a)和老龄树(200a)根际土壤为材料,每株4个方位分别取样10-30 cm土层根际土壤采集,先抖落不含根系的土壤,然后选取松散黏附在根系表面1-4 mm范围内的土壤为根际土的土壤装入无菌袋内,每株土样充分混合为一个样本[14],取样后样品于-80℃的冷冻室中冷冻保存。10a和80a随机取样5 株,由于200a树龄为珍稀古树故仅取1 株,用于土壤原生生物高通量测序及土壤理化性质测定。
1.2 方法
1.2.1 土壤理化性质测定 有机质:以硫酸亚铁为标准溶液,将容量法的滴定手段改为光度测定手段,进行土壤有机质585 nm处比色的测定[15]。
碱解氮:在扩散皿中,用碱性溶液水解土壤,使易水解态氮(潜在有效氮)碱解转化为NH3,NH3扩散后为硼酸吸收。硼酸吸收液中的NH3再用标准酸滴定,然后计算土壤中速效氮的含量[14]。
速效磷、速效钾、氯离子和钠离子分别用钼锑抗比色法测定、火焰光度法测定、硝酸银滴定法和ICP-AES[16]。
全盐含量采用电导法(LY/T 1251-1999)[17]。
pH值:称土10 g,放入50 mL烧杯中,加入蒸馏水25 mL用搅拌器搅拌1 min,使土体充分散开,放置半小时然后用酸度计测定[15]。
1.2.2 土壤原生生物基因组DNA提取 基因组DNA提取方法参考Edwards等[18]。利用1%琼脂糖凝胶检测DNA的长度和完整性,利用NanoDrop检测DNA的浓度和纯度。
1.2.3 DNA扩增及测序 PCR扩增和高通量测序:通过Illumina MiSeq平台,利用原生动物18S通用引物V9:上游引物序列1389F(5'-TTGTACACACCGCCC-3')和下游引物序列1510R(5'-CCTTCYGCAGGTTCACCTAC-3')进行序列测定,目的片段长度为120 bp[19]。PCR扩 增体系(20 μL):5×FastPfu Buffer 2 μL,2.5 mmol/LdNTPs 2 μL,正 反 引 物(5 μmol/L)各0.8 μL,FastPfu Polymerase(2.5 U/μL)0.4 μL,BSA 0.2 μL,模板10 ng,加ddH2O补充至20 μL。反应程序为95℃预变性3 min后,第一轮扩增27个循环(95℃变性30 s,55℃复性30 s,72℃延伸45 s),最后72℃延伸10 min,第二轮扩展13个循环,其余条件均不变,10℃保温。扩增后PCR产物使用浓度1.8%的琼脂糖进行电泳检测(北京博美富鑫科技有限公司)对完整性进行检测。质检合格样本构建目标区域PCR体系,之后进行产物纯化和PCR扩增,再进行切胶回收。对于构建好的文库使用采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库(上海派森诺生物科技有限公司)。
1.2.4 数据分析 (1)基于有效数据进行OTUs(operational taxonomic units)聚类和物种分类分析,使用 Trimmomatic v0.33软件,对测序得到的 Raw Reads进行过滤;利用cutadapt 1.9.1软件进行引物序列的识别与去除,得到不包含引物序列的Clean Reads;使用Usearch v10软件双端序列拼接,通过overlap对每个样品的Clean Reads 进行拼接,根据不同区域的长度范围对拼接后数据进行长度过滤;利用 UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(effective reads)。并将OTU和物种注释结合,人工剔除测序结果中植物、真菌和动物等序列,得到每个样品中原生生物OTUs和物种注释等基本分析结果。
(2)应用Mothur软件对根际土壤中原生生物群落在各个分类水平上的丰度划分alpha多样性指数(Chao1、Shannon、Simpson 指数以及覆盖度),beta多样性通过主成分分析(principal component analysis,PCA)等统计分析,获得群落样本的分布特征[20]。
(3)采用Excel 2003进行数据处理,采用SPSS 17.0进行Duncan氏差异显著性检验和Pearson相关性分析。计算原生生物与真菌、细菌(为本实验室前期获得数据,尚未公开发表)之间的Spearman等级相关系数,对其中rho>0.6且P<0.01的相关优势属构建关联网络,并导入Cytoscape(http://www.cytoscape.org/)软件进行可视化[21]。
2 结果
2.1 多样性分析
2.1.1 α多样性分析 200 a原生动物获得最多的有效序列数,但产生的OTUs最少。基于OTU数及相对丰度,结果表明果桑不同树龄多样性随树龄增大而降低,不同树龄Shannon、和Chao1指数表明原生生物随树龄增大其多样性和丰富度降低(表1)。
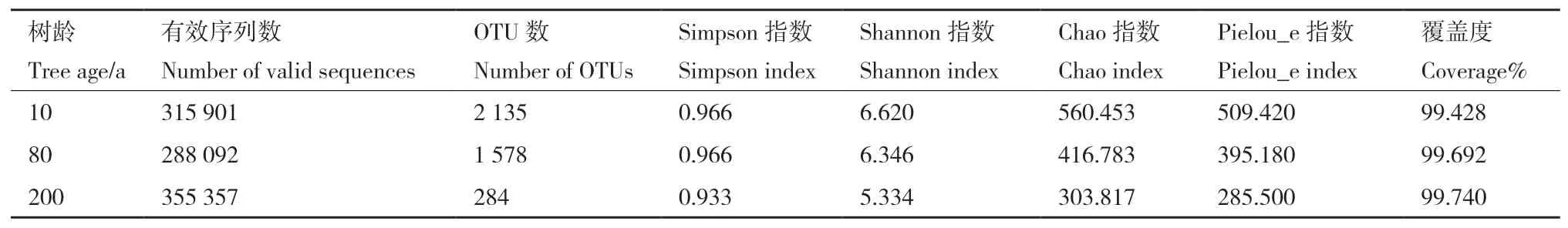
表1 土壤原生生物数据统计及alpha多样性Table 1 Soil protist data statistics and alpha diversity
2.1.2 β多样性分析 基于物种丰度进行主成分分析(principal component analysis,PCA),在OTU水平上对β多样性进行评估,分析不同样本组成结构的相似性和差异关系。基于Bray-Curtis距离算法,构建不同树龄原生生物的层级聚类树(图1),各样点聚集表明树龄对原生生物群落β多样性影响较小。

图1 根际土壤原生生物主成分分析Fig. 1 Principal component analysis(PCA)of rhizosphere soil protist
2.2 门和属水平土壤原生生物群落丰富度分析
不同树龄根部土壤原生生物在门水平上Chlorophyta、Kinetoplastida、Bacillariophyta、Rotaliida、Oomycetes、Petalomonadida、Blastocystidae被 定 义为优势门(平均相对丰度>1)。Bacillariophyta相对丰度随树龄的增大降低,绿藻门Chlorophyta、Petalomonadida和Blastocystidae相对丰度升高。由图2可知原生生物群落优势门种类基本一致,但它们相对丰度存在差异。
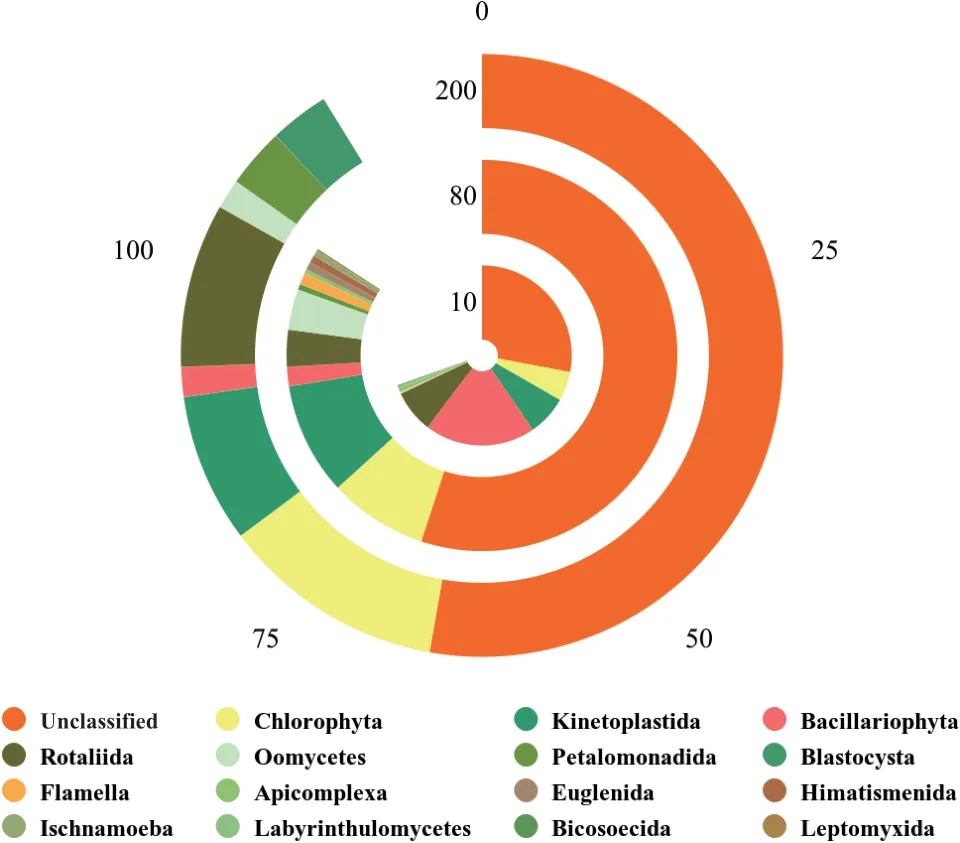
图2 门水平物种统计图Fig. 2 Statistics at phylum level
在属水平上,各树龄中Poteriospumella、Vermamoeba、Paracercomonas、吻滴虫属Rhynchomonas、Synura、Neobodo、Spumella、吻波豆虫Rhynchobodo、卵囊藻Oocystis、Petalomonas、棘阿米巴属Acanthamoeba和Blastocystis为优势属(平均相对丰度>1)(图3)。10a中独有属18 个,80a独有12 个,200a独有2 个。利用单因素ANOVA检验发现在10a-80a、10a-200a和80a-200a中 相 对 丰 度 差 异显著的属分别为Paracercomonas、Petalomonas和Acanthamoeba、Rhynchomonas,结果表明土壤原生生物群落组成和相对丰度具有明显树龄变异(图4)。
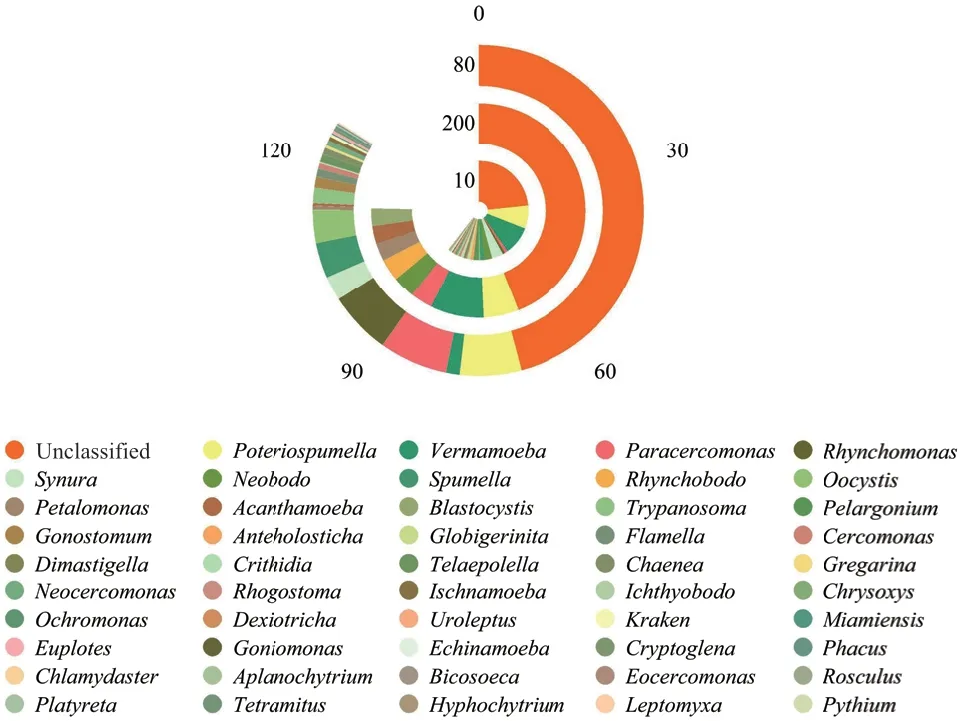
图3 属水平物种统计图Fig. 3 Statistics at genus level
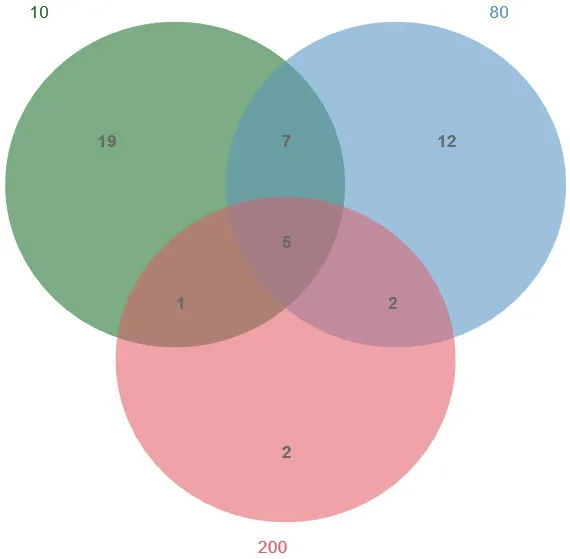
图4 独有和共有原生生物种类数Fig. 4 Number of unique and common protist species
2.3 基于影响群落组成土壤环境因素的分析
根据差异显著分析结果表明:各树龄速效钾含量差异显著,80a vs 200a间速效磷、氯离子含量差异显著,pH值10a vs 80a差异极显著,碱解氮含量、有机质含量、全盐量和钠离子随树龄变化不显著(图5)
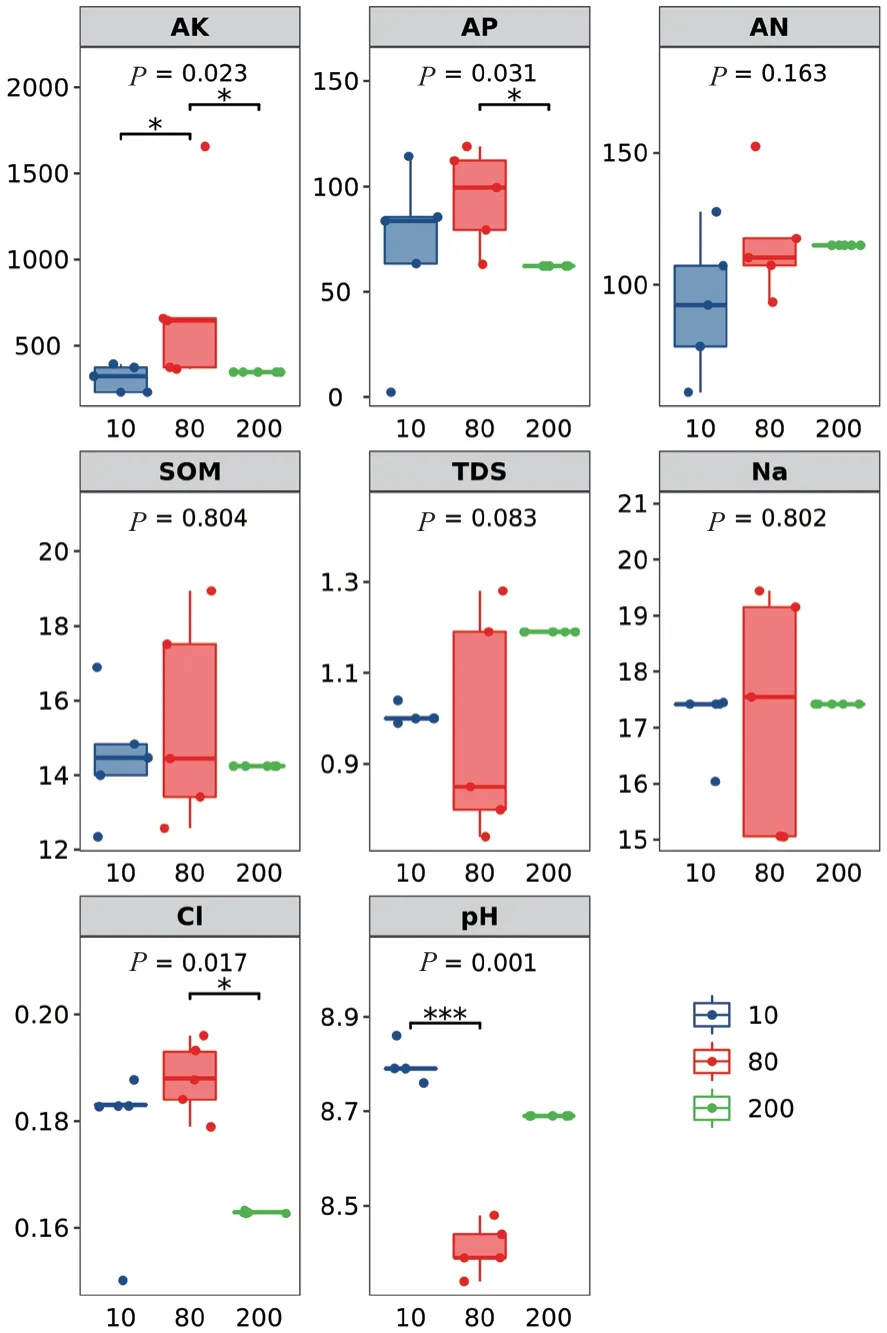
图5 土壤理化指标差异显著性分析Fig. 5 Significance analysis of differences in soil physical and chemical indicators
根际土壤原生生物群落多样性、丰富度(Chao指数、Simpson指数、Shannon指数)、均匀度与树龄和氯离子含量极显著负相关,Simpson指数与全盐量显著负相关,覆盖度与树龄、速效钾和碱解氮含量显著正相关;同时各多样性指数与速效磷、有机质、钠离子含量和pH值相关但不显著(表2)。
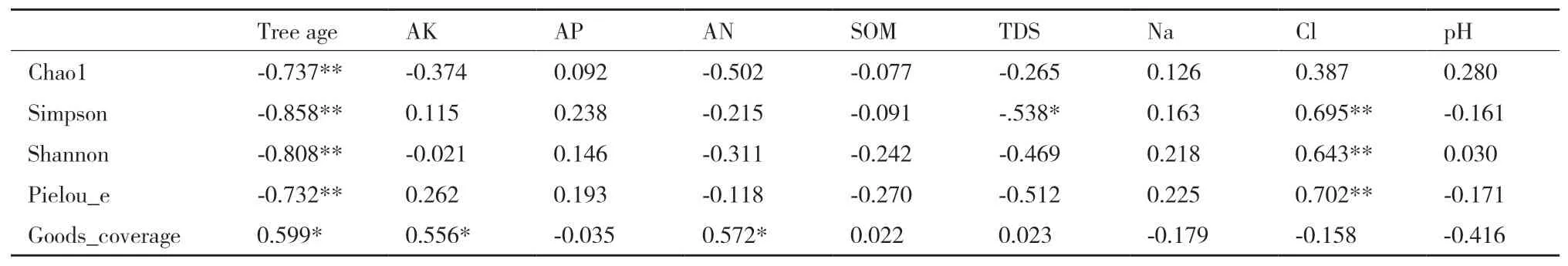
表2 土壤理化性状与土壤原生生物多样性指数的相关性分析Table 2 Correlation analysis between soil physical and chemical properties and biodiversity indexes of soil protist
2.4 基于细菌、真菌的关联分析
使用Mothur软件对各样本中原生生物与细菌、真菌在rho > 0.6且P值< 0.01相关的属构建关联网络,结果表明关联最多且互为共生关系的原生生物为破囊壶菌Aplanochytrium和微藻Chrysoxys(分别有22 个关联属),其次是Chlamydaster(19 个关联属)、鞭毛虫Dimastigella(18 个关联属)和Goniomonas(17 个关联属);与原生生物关联最多的是Aplanochytrium(7 个关联属);Chlamydaster、Chrysoxys、Dimastigella、Goniomonas、Rhogostoma、Rosculus和Uroleptus互为共生关系。丝壶菌属Hyphochytrium与细菌关联最多(4 个关联属),分别是动球菌属Kineococcus、水生角质菌属Pilimelia、Pseudorhodoferax和疣孢菌属Verrucosispora。与真菌关联最多(15 个关联属),分别是Flammulina、腹孢 菌 属Gastrosporium、Genolevuria、Kalaharituber、Kondoa、Mycena、Perenniporia、 红 酵 母 属Rhodotorula、荚 孢 腔 菌 属Sporormia、匍 柄 霉属Stemphylium、Termitomyces、Trichophaeopsis、Tuber、Xerochrysium。在 各 原 生 生 物 集 团 中 与大量子囊菌门、担子菌门、球囊菌门等真菌共生。Aplanochytrium、Chlamydaster、Dimastigella、Goniomonas、Eocercomonas和丝壶菌属仅存在于10龄根部土壤中,Chrysoxys仅存在于80 龄根部土壤中。Pervetustus与细菌Ramicandelaber为竞争关系,Pervetustus在10 龄到80 龄相对丰度上升到200 龄消失,而Ramicandelaber在10 龄到80 龄相对丰度降低,200 龄丰度上升(图6)。
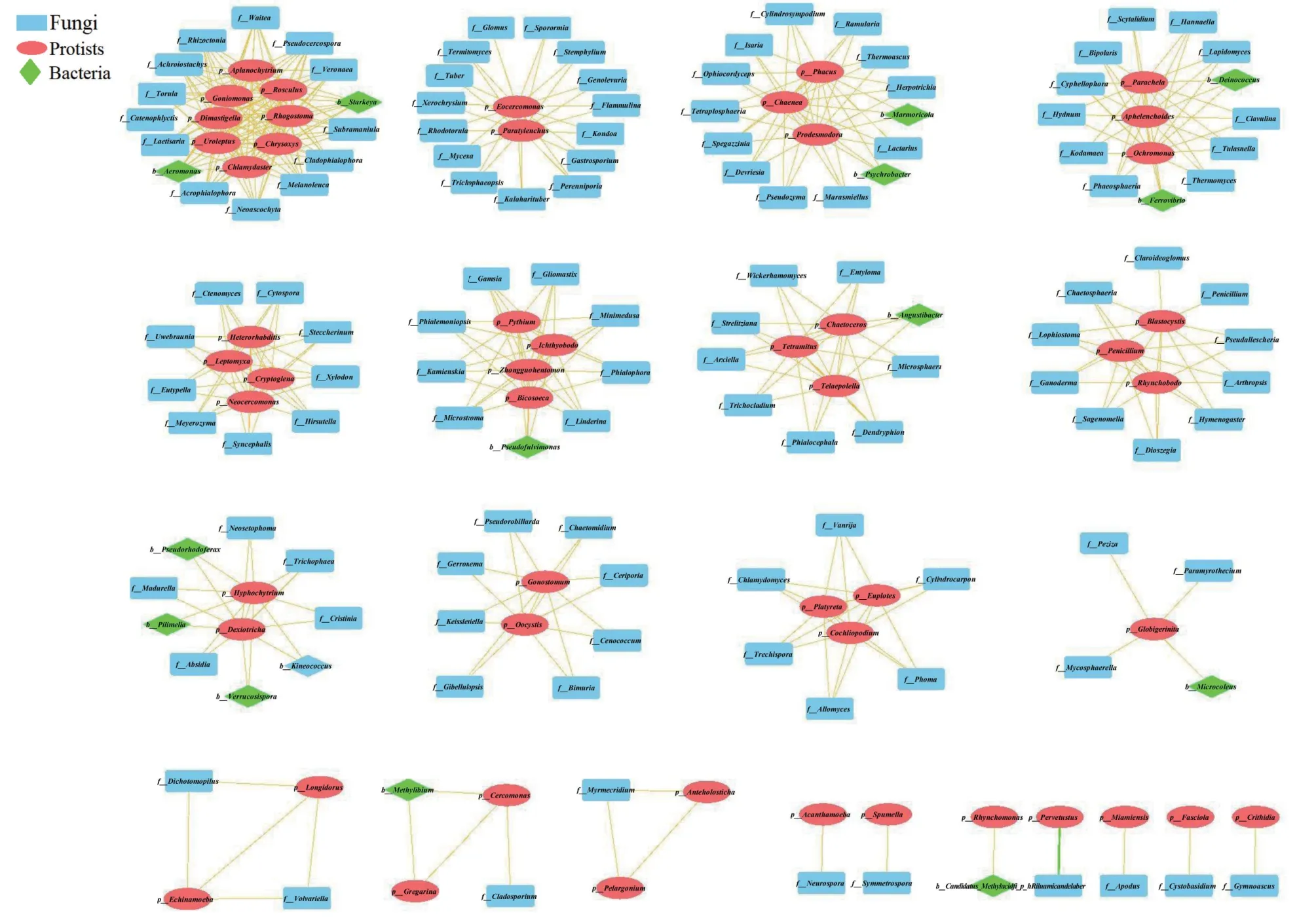
图6 原生生物与真菌、细菌网络关联图Fig. 6 Correlation diagram of protis,fungi and bacteria network
3 讨论
原生生物对各种土壤-植物系统表现出积极的动态响应和生物地理属性[22],对森林、草原、稻田的研究都表明,植被类型与土壤理化性质对土壤生物区系的影响大于植被的丰富度,且与微生物群落组成具有很强的相关性[4,23]。Ceja等[24]对开关草(Panicum virgatum)的研究表明,随着时间的推移,植物的生理学指标水平发生变化,而根际土壤原生动物多样性减少。树木生命周期长,个体空间更大,随着时间积累,单个树种对土壤中的许多生化和生态过程的驱动显著强于多树种,并且表现出树种特异性[25]。前人研究表明全球不同生态区土壤内Cercozoa和Ciliophor等捕食者(consumers)原生生物类群占支配地位[26],但时间因素是否驱动土壤原生生物种类多样性和群落结构分化仍然未知。本研究利用空间换时间法从较长时间尺度上探讨原生生物群落的结构和组成动态变化,发现土壤原生生物群落组成和相对丰度具有明显树龄变异,不同树龄根际原生生物的α多样性和群落结构存在明显的差异,原生生物丰富度和多样性随树龄增大降低。可能是桑生长盛期树体营养充足,促进了原生生物的群落多样性和丰富度的增长;幼树期或老龄期竞争养分和自身代谢能力较低,限制原生生物的生长及繁殖从而使多样性和丰富度较低。在门水平上,在对各树龄种类基本一致,但相对丰度存在一定差异,随树龄增长,提高了绿藻门等光能营养型原生生物的相对丰度,降低了硅藻门Bacillariophyta的相对丰度。在属水平上,随树龄的增加,差异种群减少,10a中独有属18 个,80a独有12 个,200a独有2 个,Petalomonas和Acanthamoeba等捕食者原生动物的种类多样性和丰度变异增强。
研究发现土壤pH值是原生生物多样性、群落结构和功能组成变化的驱动力,自养类原生生物在较低酸碱度条件下多样性下降[27-28]。同时,原生生物是对施氮肥最敏感的微生物类群[29],在碱性潮土中施肥可以显著降低捕食性原生生物的相对丰 度[30]。本 研究10a根际土 壤pH值高于80a和200a,这与黄晶淼和王静等对苹果树龄对土壤pH值的研究趋势一致[31-32],同时,速效钾含量差异显著,80a vs 200a间速效磷、氯离子含量差异显著;氯离子含量显著影响了原生生物群落多样性,速效钾和碱解氮含量的增长也显著促进了群落覆盖度的增大。速效钾和氯离子可调节土壤酸度,也证实了非生物参数是原生生物群落重要性的决定因素[33-34]。同 时,10a vs 80a、10a vs 200a和80a vs 200a中相对丰度差异显著的属也分别为动物性或腐生性营养型(Consumer)的Paracercomonas、沟滴虫属Petalomonas和棘阿米巴属Acanthamoeba、吻滴虫属Rhynchomonas,群落多样性也随树龄增大降低。这可能是树龄影响了土壤主要营养和理化指标,不同类群的原生生物对根际土壤酸碱度和营养状况适应性不同,捕食者群体或许可以作为土壤状况的指示性生物[5]。
在土壤微生物三级营养结构中,层次群落由自上而下(捕食者)和自下而上(营养)综合效应决定[35]。原生动物作为土壤微生物组的中心枢纽,连接着不同的细菌和真菌种群,处于土壤微生态网络对树龄动态反应的关键位置,在土壤管理和调控细菌和真菌数量过程中发挥了杠杆作用[36-38]。例如异养型原生生物破囊壶菌Aplanochytrium和光能自养型卵囊菌属Oocystis是各树龄根际土壤中的优势菌属,他们与根际真菌、细菌和原生生物之间呈现出复杂的互作关系:破囊壶菌在和微藻Chrysoxys之间不仅存在共生关系,还共同与棘尾虫属Uroleptus等捕食性原生生物存在协同共生关系,与病原细菌气单胞菌属Aeromonas和大量植物病原真菌如假尾孢属Pseudocercospora、新壳二孢Neoascochyta和丝核菌属Rhizoctonia存在正向调控;而卵囊菌Oocystis则与老伞属Gerronema、空团菌属Cenococcum等植物菌根共生。原生生物通过直接取食病原体和通过捕食诱导细菌和真菌的分类和功能组成的变化来保护植物,控制微生物群落的多样性和结构,从而促进植物生长[2,39-40]。例如近爪属Parachela集团中与异常球菌属Deinococcus、铁锈菌Ferrovibrio和菌根菌胶膜菌属Tulasnella、病原菌暗球腔菌属Phaeosphaeria等11个真菌共生。异常球菌属可提高盐敏植物的抗旱能力和对盐的耐受性,在一定程度上可提高树体耐盐碱能力,至于是否抑制或促进相关真菌的生长还未可知[41]。铁锈菌可水解纤维素促进土壤中的能量流动以及氮、磷和硫的循环[42-44]。Pseudofulvimonas、四鞭毛虫属Tetramitus和Telaepolella集团与细菌Angustibacter和病原菌链蠕孢属Dendryphion、菌属Entyloma和叉丝壳属Microsphaera等8属真菌共生;丝壶菌属和水生角质菌属等4个细菌属和犁头霉属Absidia等6个属真菌共生,水生角质菌属具有抗真菌活性[45];其余各集团Globigerinita、尾滴虫属Cercomonas、吻滴虫属Rhynchomonas分别与鞘藻属Microcoleus、甲基杆菌属Methylibium和Methylacidiphilum共生,甲基杆菌属细菌具有较高耐盐、促生和抗菌性能,可促进桑的生长,抑制病虫害发生[46]。原生生物与大量子囊菌门、担子菌门、球囊菌门真菌,有益或潜在致病细菌共生,表明它们之间存在共同的环境偏好或潜在的生物相互作用,以互利共生的原则维持根际土壤微生态稳定。
4 结论
不同树龄间优势菌门一致但相对丰度存在差异,属水平上种类组成及相对丰度均受到树龄的影响。随着树龄的变化,树体长势和树体吸收养分能力不同其生命活动也受到土壤理化指标的影响,其中氯离子含量和全盐量可显著影响原生生物群落多样性、丰富度和均匀性,速效钾和氯离子可显著影响群落覆盖度。在土壤微生物三级营养结构中,原生生物与真菌细菌构成不同的集团共生,表现出相同的环境偏好共同维持土壤微生物环境的平衡,为进一步探讨原生生物种群分化机制和生态服务功能提供理论依据。