烟草根际高效解磷菌的筛选鉴定及促生作用研究
刘广超 叶青 车永梅 李雅华 安东 刘新
(青岛农业大学生命科学学院 山东省高校植物生物技术重点实验室,青岛 266109)
磷元素是植物生长发育必需的大量元素之一,是构成核酸、蛋白质和磷脂等重要物质的组成成分,广泛参与植物的各种代谢过程。植物对磷的需求量大,土壤中磷含量较高,但大部分磷并不能被植物直接吸收利用,土壤中有效磷含量远远不能满足植物的需求,农业生产中通常通过施用化学磷肥补充植物所需的磷[1]。解磷菌是存在于土壤中的一类根际促生菌,可以将土壤中植物难以吸收利用的磷转化为可被植物利用的形态。开发微生物肥料,利用解磷微生物将土壤中的无效磷转化为有效磷,提高土壤磷的利用效率,改善土壤结构,减少化肥用量,对于发展绿色可持续农业具有重要意义。
解磷菌的种类与土壤质地、植物种类、根际环境等相关,主要包括细菌、真菌和放线菌等,其中细菌占绝大多数。目前已分离鉴定了多种解磷菌,并研究了其解磷功能、作用机理及对植物生长的影响,根据作用底物不同又可以将解磷菌分为解无机磷微生物和解有机磷微生物[2]。解磷菌主要通过分泌葡萄糖酸、乙酸、草酸及柠檬酸等有机酸溶解无机磷,通过分泌碱性和酸性磷酸酶分解有机磷[3-4]。不同解磷菌对不同形式的磷转化能力存在差异。Wu等[5]以及Yang等[2]从杭州西湖和武汉巢湖等地分离到多种解有机磷菌和解无机磷菌;从缺磷土壤中分离的马昆德拟青霉(Paecilomyces marquandii)AA1对不同产地的磷矿有不同分解能力[6];从绿豆根际分离到的解磷菌泡盛曲霉(Aspergillus awamori)S29对二磷酸钙分解能力强,其次是磷酸三钙[7];从香蕉根际分离到40株解磷菌,具有溶解Ca3(PO4)2的作用,其中3株可以分解大豆卵磷脂,但均无分解FePO4的作用[8];从大豆根际分离的解磷菌成团泛菌(Pantoea agglomerans)R-42具有一定分解FePO4和AlPO4的能力[9]。多数解磷菌对植物生长有促进作用,可以促进绿豆、水稻、小麦、薄荷以及大豆和白菜等作物生长(Mentha arvensisL)[7,10-13],但泛菌属(Pantoeasp.)解磷菌A34和科萨克氏菌属(Kosakoniasp.)解磷菌B7对番茄根和幼苗生长起抑制作用[14]。因此分离鉴定不同性质和功能、对植物有良好促生作用的解磷微生物,可以为微生物肥料的生产提供充足的微生物资源,以满足更广条件下农业生产的需求。
植物根际土壤(rhizosphere soil)是植物能量和物质代谢最活跃的部位之一。在植物根际土壤中生存着大量的微生物,其数量远高于非根际土壤。本研究从烟草根际土壤中分离筛选到一株同时解有机磷和无机磷的不动杆菌属的细菌3P29,对其进行生理生化和分子生物学鉴定,并通过烟草促生试验验证该菌株对烟草的促生作用,为该菌株在农业生产中的开发利用及生物肥料的研发提供微生物资源和理论依据。
1 材料与方法
1.1 材料
1.1.1 土壤样品 土壤样品取自山东省潍坊市高密市方市乡烟草根际土壤,采样深度10-20 cm,置于4℃冰箱中保存,备用。
1.1.2 培养基 以下培养基配方均为液态培养基,固态培养基需在此基础上添加15 g琼脂。
有机磷细菌培养基:葡萄糖10 g,硫酸铵0.5 g,酵母浸粉0.5 g,氯化钠0.3 g,氯化钾0.3 g,硫酸镁0.3 g,硫酸亚铁0.03 g,硫酸锰0.03 g,卵磷脂0.2 g,碳酸钙1.0 g,pH 7.0-7.5,蒸馏水1 000 mL,121℃灭菌15 min。
无机磷细菌培养基:葡萄糖10 g,硫酸铵0.5 g,酵母浸粉0.5 g,氯化钠0.3 g,氯化钾0.3 g,硫酸镁0.3 g,硫酸亚铁0.03 g,硫酸锰0.03 g,磷酸钙5.0 g,pH 7.0-7.5,蒸馏水1 000 mL,121℃灭菌30 min。
LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,pH 7.0-7.2,蒸馏水1 000 mL,121℃灭菌30 min。
1.2 方法
1.2.1 解磷菌的初筛 将供试根际土壤称取10 g,置于含玻璃珠和90 mL 无菌水的三角瓶中,28℃,120 r/min振荡20 min,静置30 min,取上清即得到稀释度为10-1的根际土壤稀释液,用10倍稀释法分别配制10-3、10-4、10-5、10-6g/mL的土壤悬液,分别涂布到有机磷及无机磷细菌培养基上,28℃培养4 d,观察出现溶磷圈的菌落,根据能否产生溶磷圈及测定溶磷指数(溶磷指数=透明圈直径/菌落直径)来初步确定菌株的溶磷能力。将筛选出的菌株利用平板划线法分离纯化后,4℃下保存于LB斜面培养基,-80℃保存菌种于甘油管中。
1.2.2 解磷菌株的复筛 250 mL三角瓶中分别装入有机磷及无机磷细菌培养基100 mL,高压灭菌121℃、25 min备用。将在LB斜面培养基上生长24 h的细菌制成菌悬液(菌数约为1×107CFU/mL),将解磷菌菌悬液1 mL接种于上述灭菌的液体细菌培养基中,以不接菌为对照,每个处理3次重复,摇床培养(28℃,120 r/min)3 d,利用钼锑抗比色法[5]测定可溶性磷含量。
1.2.3 解磷菌的生理生化及分子生物学分析
1.2.3.1 筛选解磷菌株形态学特征 菌落形态:将筛选得到的菌株划线接种到LB固体培养基,28℃培养24 h,观察其菌落大小、形状、透明度、光滑度、颜色等特点。
个体形态:革兰氏染色,用接种环挑取18-24 h菌株培养液于载玻片无菌水中,室温自然干燥后火焰固定,滴加适量草酸铵结晶紫染色l min,倾去染色液,用水冲洗至无色,然后用革兰氏碘液染色2 min,水洗,乙醇脱色30 s,水洗后用石炭酸复红染10 s,水洗,晾干后镜检。
1.2.3.2 筛选解磷菌株生理生化特征 糖类发酵试验、动力学试验、氧化酶试验、硝酸盐还原试验、解钾性试验、固氮性试验、产生长素试验、产铁载体试验的方法均参照《伯杰细菌鉴定手册》(第8版)进行。
1.2.3.3 溶磷菌株分泌IAA特性测定 将分离纯化的菌株接种于 LB 液体培养基中(添加L-色氨酸,使终浓度为0.5 g/L),37℃、180 r/min振荡培养2 d,离心后取50 μL上清液加入等体积Sackowcki’s显色剂在比色皿中避光显色30 min后观察,若出现粉红色则为阳性,说明该菌株能够分泌IAA。
1.2.3.4 解磷菌分子生物学鉴定 菌株划板后挑取单菌落,接种于20 mL三角瓶振荡培养16-18 h,取1 mL菌液10 000 r/min离心1 min,弃上清,沉淀加200-300 μL无菌水,沸水浴10 min,立即置于-20℃处理3 min后12 000 r/min 4℃离心5 min,取上清即为模板,采用采用细菌16S rDNA通用引物:27f(5'-AGAGTTTGATCCTGGCTCAG-3')、1492r(5'-GGTTACCTTGTTACGACTT-3')及gyrB通 用 引物:gyrBf(5'-CAYGCNGGNGGNAARTTYGA-3')、gyrBr(5'-CCRTCNACRTCNGCRTCNGTCAT-3')进行16S rDNA的PCR扩增,扩增片断长度为1.5 kb。PCR程序为94℃预变性4 min,94℃变性0.5 min,51℃退火0.5 min,72℃延伸1.5 min,共35个循环,72℃延伸10 min,4℃保存。扩增产物经纯化回收,交由上海生物工程有限公司进行测序,将16S rDNA基因序列与RDP数据库中核酸数据进行比对分析,在BLAST数据库搜索gyrB基因同源序列,使用MEGA 6.0软件,以Neighbor-joining法构建系统发育树。
1.2.4 土壤营养元素含量和酶活性检测 将187.5 mL解磷菌(菌数约为3.5×108CFU/mL)菌液经离心弃上清后,将菌体沉淀用等体积灭菌水悬浮,再接种到装有750 g泥炭土的塑料花盆里,同时设置灭活解磷菌的对照组,置于28℃温室中培养,每周浇水一次,每隔10 d进行土壤氮、磷和钾元素含量以及酶活性测定。
土壤中总氮采用凯氏定氮法测定,速效氮采用滴定法测定,总磷和速效磷采用钼锑抗比色法测定,总钾和速效钾采用火焰分光光度计法测定[15]。脲酶采用苯酚-次氯酸钠比色法测定[16];酸性磷酸酶采用磷酸苯二钠比色法测定[17];蔗糖酶采用3,5-二硝基水杨酸比色法测定[18]。
1.2.5 解磷菌促生作用分析 消毒的烟草种子于28℃黑暗条件下催芽,发芽后移栽至含750 g泥炭土的塑料花盆中。实验设灭活解磷菌(对照)和接种解磷菌两组处理。接种解磷菌的烟草幼苗每盆浇含187.5 mL菌液(菌 数约3.5×108CFU/mL),经离心弃上清后,等体积无菌水悬浮后接种,对照每盆施等量灭活菌液。两组处理每盆浇花无缺营养液100 mL(花无缺水溶肥购自上海永通化工有限公司),于25℃,12 h/12 h光周期,光强200 μmol/(m2·s)条件下培养,每周浇水两次,培养45 d后进行生长指标和叶片氮、磷和钾含量的测定。
2 结果
2.1 根际土壤高效解磷菌的分离筛选
经稀释平板涂布法从供试烟草根际土壤中分离纯化出50株菌株,依据溶磷指数分别在固体有机磷筛选培养基和无机磷筛选培养基上进行初筛,共有10株菌株具有解磷功能,分别命名为2P1、2P10、2P14、2P23、2P24、3P25、3P28、3P29、3P33、3P37。
将筛选出的10株解磷菌接种到液体有机磷筛选培养基和无机磷筛选培养基中进行复筛,振荡培养7 d后,检测发酵液中可溶性磷含量,结果如表1所示,菌株3P29在有机磷筛选培养基中磷含量为13.38 mg/L,无机磷筛选培养基中磷含量为19.83 mg/L,说明菌株3P29同时具有高效分解有机磷及无机磷的功能。
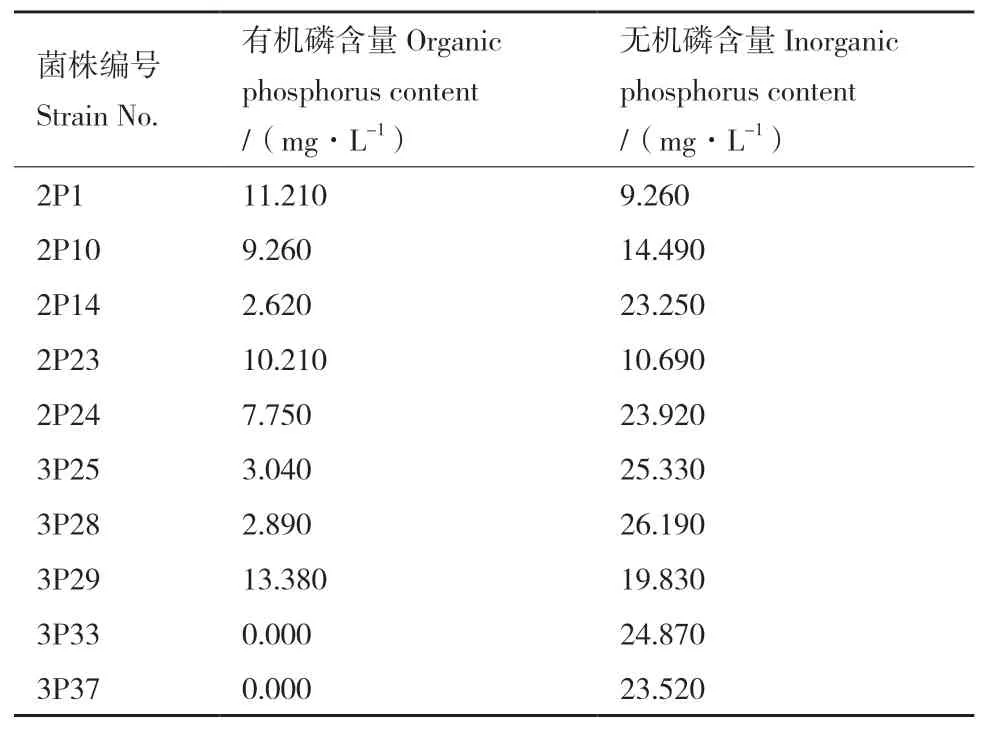
表1 解磷菌3P29的解磷能力Table 1 Phosphorus solubilizing ability of strain 3P29
2.2 解磷菌3P29的生理生化及分子生物学鉴定
经平板划线、革兰氏染色,观察解磷菌3P29形态特征,可见解磷菌3P29在菌落较小时为圆形,初期为无色透明,后期为淡黄色,表面光滑、湿润、黏稠、边缘整齐、直径2-3 mm,为革兰氏阴性菌,生理生化指标检测结果表明,3P29同时具有解钾、固氮及产硫化氢、生长素的能力(图1)。

图1 解磷菌3P29的菌落形态、革兰氏染色及分泌生长素的能力Fig.1 Colony morphology,Gram staining and auxin secretion ability of strain 3P29
以菌株3P29的基因组DNA为模板,分别用通用测序引物进行PCR扩增获得3P29的16S rDNA和gyrB序列。通过在RDP数据库比对16S rDNA,得到20株相似菌株,进而在NCBI数据库下载相似菌株对应gyrB基因,应用MEGA 6.0软件构建系统发育树(图2-图3)。经16S rDNA及gyrB进化树图谱综合分析,结果发现,解磷菌3P29与皮特不动杆菌LMG 1035同源性最高,结合形态及生理生化特征鉴定结果,将菌株3P29鉴定为皮特不动杆菌属(Acinetobacter pittii)。
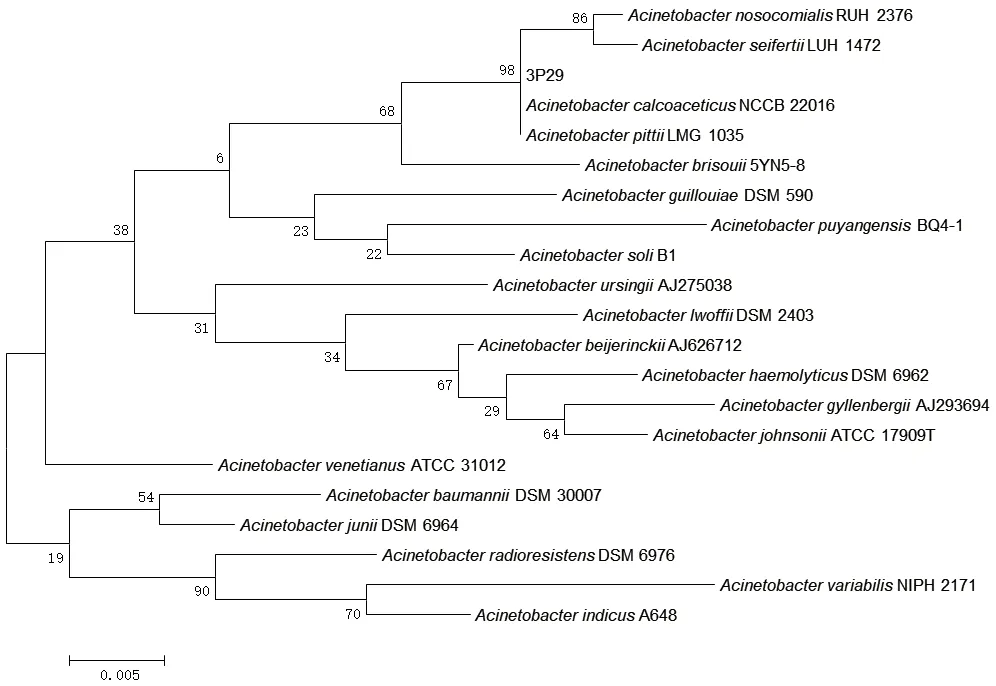
图2 基于解磷菌3P29和相关菌株的16S rDNA 序列采用邻接法建立的系统发育树Fig. 2 Phylogenetic tree established using the neighborjoining method,based on 16S rDNA sequences of strain 3P29 and related strains

图3 基于解磷菌3P29和相关菌株的gyrB序列采用邻接法建立的系统发育树Fig. 3 Phylogenetic tree established using the neighborjoining method,based on gyrB sequences of strain 3P29 and related strains
2.3 解磷菌3P29对土壤矿质营养元素含量及土壤酶活的影响
菌株3P29具有解磷、解钾和固氮作用,因此检测了3P29对土壤氮、磷和钾含量的影响,结果(图4)显示,3P29对土壤总氮、总磷和总钾含量无显著性影响,但增加土壤碱解氮、速效磷和速效钾含量。随接种时间延长,碱解氮、速效磷和速效钾含量呈升高趋势,于接种30 d时达最高水平。与初始未接种时相比碱解氮含量提高229%,速效磷含量提高了156%,速效钾含量提高了16%。

图4 解磷菌3P29对土壤矿质元素含量的影响Fig. 4 Effects of strain 3P29 on mineral element contents in soil
土壤中脲酶、酸性磷酸酶和蔗糖酶参与土壤有机含碳、氮和磷化合物降解,在土壤碳、氮和磷的循环过程中发挥重要作用。3P29对土壤脲酶和酸性磷酸酶活性具有较大影响,脲酶和酸性磷酸酶活性随时间延长呈先升高后降低趋势,于接种后30 d左右达最高水平。而土壤蔗糖酶活性无显著影响(图5)。
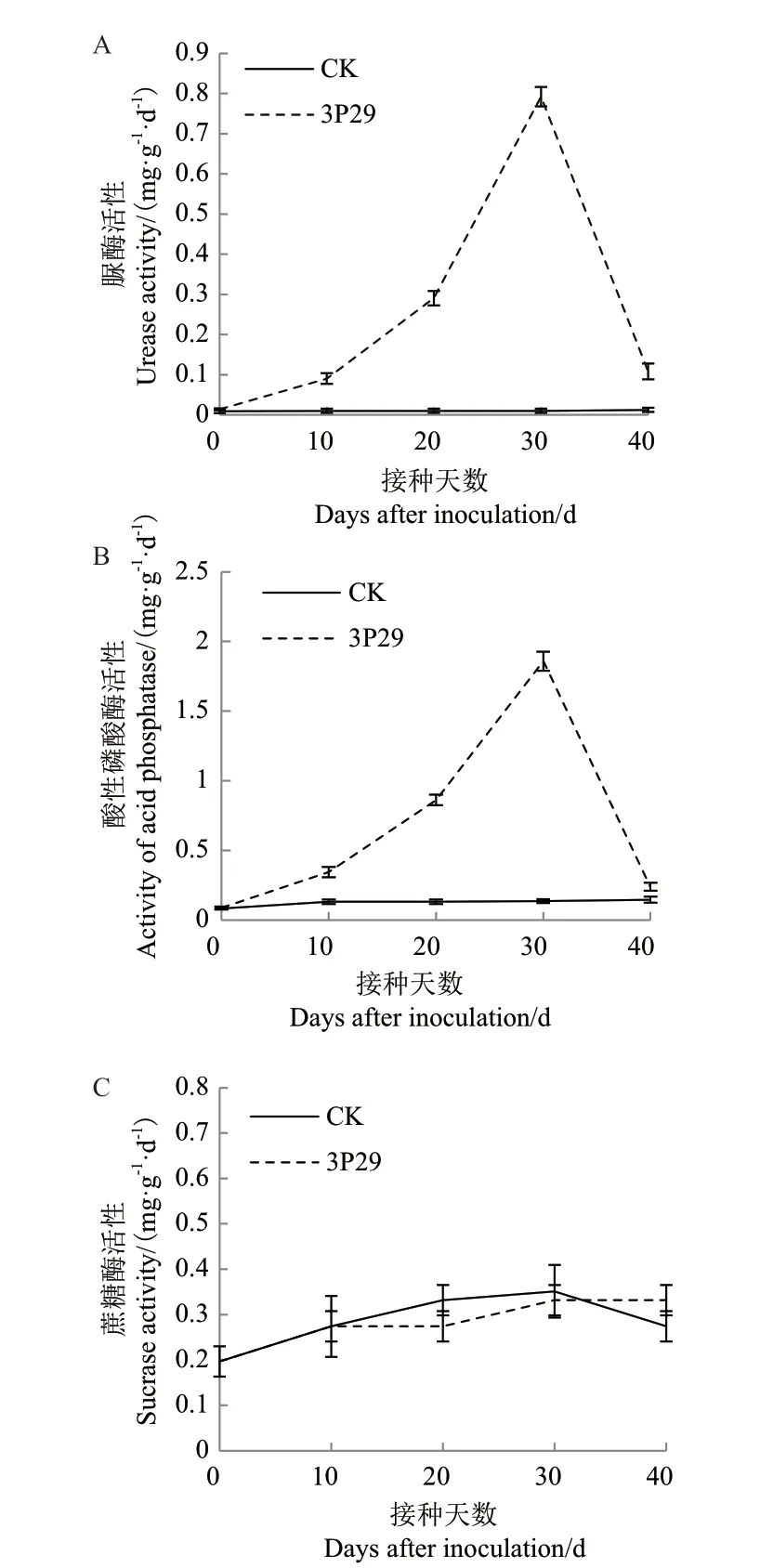
图5 解磷菌3P29对土壤酶活的影响Fig.5 Effects of strain 3P29 on soil enzyme activity
2.4 解磷菌3P29对烟草的促生试验
对菌株3P29进行烟草促生试验,结果(图6、表2)表明,接种3P29显著促进烟草的生长,在无磷霍格兰营养液培养下烟草株高、叶面积和茎粗分别提高了12.4%、21.7%和36.1%;在花无缺全营养液培养下分别提高了40.1%、42.7%和29.1%。

表2 解磷菌3P29对烟草生长指标的影响Table 2 Effects of strain 3P29 on the growth index of tobacco

图6 解磷菌3P29对烟草生长的影响Fig. 6 Effects of strain 3P29 on tobacco growth
由表3可知,与对照组相比,接种3P29后烟草地上部分和地下部分的生物量亦显著提高,烟草生长明显优于对照组。

表3 解磷菌3P29对烟草地上部分和地下部分生物量的影响Table 3 Effects of strain 3P29 on the biomass of aerial and underground parts of tobacco
进一步检测接种3P29对烟草叶片氮、磷和钾元素含量的影响,结果如图7所示,接种3P29后促进烟草叶片氮、磷和钾的积累,在无磷霍格兰营养液和在花无缺营养液条件下,钾元素含量分别提高了45%和10%,磷元素含量分别提高了134%和28%,氮元素含量分别提高了71%和49%。

图7 解磷菌3P29对烟草叶片氮、磷和钾元素含量的影响Fig. 7 Effects of strain 3P29 on contents of nitrogen,phosphorus and potassium in tobacco leaves
3 讨论
土壤中的磷包括有机磷和无机磷,有机磷主要来源于动植物残体、堆肥和微生物组织等,无机磷大 部 分 以Ca3(PO4)2、CaHPO4、FePO4和AlPO4等难溶性磷酸盐的形式存在,不能被植物直接吸收利用,土壤中无效磷含量占95%以上[9]。解磷菌能够将土壤中不溶性磷转化为可溶性磷,对于土壤磷的循环和改善土壤结构具重要作用。目前已有多种对Ca3(PO4)2、CaHPO4、FePO4和AlPO4等不同形式无机磷具有溶解作用的微生物被分离鉴定[6-8,19-20],也分离鉴定到一些解有机磷微生物[14],但目前分离鉴定的解有机磷微生物种类相对较少。本实验从烟草根际分离筛选到一株同时具有解有机磷和无机磷能力的菌株3P29。形态学、生理生化及分子生物学鉴定表明3P29属于皮特不动杆菌属(Acinetobacter pittii)细菌。
目前研究发现不同解磷菌生理生化特性(如激素产生、解钾和固氮等)存在差异,如Wu等[5]在杭州西子湖分离的固氮螺菌属(Azospirillum)解有机磷菌OPB1同时具有固氮作用;从小麦根际分离的解磷菌Pseudomonassp. MS16和Enterobactersp.MS32具有解锌作用及固氮酶活性[10]。本文结果表明,3P29在平板实验中兼具解钾和固氮作用,是一株潜在的多功能菌,具有重要开发利用价值。土壤中的酶主要来源于土壤微生物,是反映土壤微生物活性的重要指标,土壤中脲酶、酸性磷酸酶和蔗糖酶参与土壤有机含碳、氮和磷化合物降解,在土壤碳、氮和磷的循环过程中发挥重要作用[21-22]。生物菌剂可以影响土壤酶活性,如根际促生菌和AM真菌接种可以提高脲酶和蔗糖酶等土壤酶活性[23]。含枯草芽孢杆菌(Bacillus subtilis)的生物肥料可以提高土壤脲酶和过氧化氢酶等酶活性[24]。因此本文进一步分析了3P29对土壤营养元素含量,土壤酶活性以及对烟草生长的作用,结果表明3P29可以显著提高土壤中碱解氮、速效磷和速效钾的含量及土壤脲酶、酸性磷酸酶活性。
根际微生物生活在靠近植物根部的土壤区域,在调节植物养分供应方面起着特别重要的作用[25-26]。如从玉米根中分离出的Burkholderia cenocepacia CR318通过提高玉米叶片叶绿素含量,根部鲜重等促进玉米根系发育,增加玉米净生物量[27];玫瑰花天竺葵接种假单胞菌与未接种的对照相比,蒙特氏假单胞菌可增溶无机磷并使茎,根和精油的干生物量分别增加44%,48%和43%[28]。本文通过盆栽实验表明,接种3P29可以优化烟草根系结构,增加侧根数量及主根长度,同时具有分泌生长素的能力,从而提高烟草对土壤营养物质及水分的吸收与利用,叶片氮、磷和钾的含量较对照组显著升高,进而增强烟草光合活性,促进植株生长。因此,在缺磷的土壤环境中,3P29可被作为研制烟草促生生物肥料的候选菌株。但3P29能否直接参与烟草在缺磷时的根形态建成以及其可能的调节机制仍需进一步研究;同时,3P29促进烟草体内氮代谢过程与其固氮功能的关系也有待进一步阐明。
4 结论
本试验从烟草根际土壤中筛选得到一株同时解有机磷和无机磷的皮特不动杆菌属(Acinetobacter pittii)细菌3P29,其对卵磷脂的转化量为13.38 mg/L,磷酸钙的转化量为19.83 mg/L。高效解磷菌3P29促进烟草根系生长,形成更多侧根,增强对土壤中营养元素的吸收和利用,生物量等生长指标明显优于对照组,具有开发利用价值。