白芷根际促生菌的筛选及其促生效果研究
江美彦 周杨 刘仁浪 姚菲 杨云舒 侯凯 冯冬菊 吴卫
(四川农业大学农学院,成都 611130)
中药白芷为伞形科植物白芷Angelica dahurica(Fisch. ex Hoffm.)Benth. et Hook. f.或杭白芷Angelica dahurica(Fisch. ex Hoffm.)Benth. et Hook. f. var.formosana(Boiss.)Shan et Yuan的干燥根。白芷为药食两用药材,主要含挥发油类、香豆素类、氨基酸类等多种活性成分,在临床上常用于治疗各种类型的疼痛症状,在食品、化工、香料等多个方面也有应用。市场上主要以川白芷、杭白芷、禹白芷和祁白芷4种作为主流商品药材[1-3]。而在白芷的道地产区四川遂宁,存在白芷早期抽薹、化肥农药不合理施用等问题,导致白芷药材产量和品质下降[4-5]。目前,为解决此类问题,在白芷播种、化肥配施、采收加工等方面已有大量研究[6-8],但有关白芷根际促生细菌的研究尚未见报道。
植物根际是土壤微生物最活跃的区域,包含古细菌、细菌、病毒、真菌、线虫等多种类群,其中细菌是最丰富的类群之一。植物根际促生菌(PGPR)即指非致病的有益的根际细菌[9],PGPR能够在植物根际产生和分泌各种调节化学物质,或者抑制植物病原体和其他有害微生物,直接或间接地影响植物生长发育,从而起到促进植物生长、提高作物产量、防治植物病害等作用[9-12]。PGPR具有环保、安全、有效等特点,同时具有改善土壤结构、提升作物产量和品质等方面的潜力[13-14]。
土壤N、P、K配比情况对白芷早抽薹、产量和质量均有影响,植物PGPR分泌的铁载体和IAA对植物也有一定的促生作用[15-17]。本试验以种植于四川遂宁的白芷品种BZA001和品系BZB003根际土壤为材料,分离筛选出川白芷根际促生细菌,通过盆栽试验进一步验证所筛促生细菌对白芷的促生效果,挖掘白芷根际细菌潜力,为白芷高产和优质种植提供新途径。
1 材料与方法
1.1 材料
5份种植于四川遂宁涪江流域不同地点的两种白芷的根际土壤,分别为四川省遂宁市船山区顺江村(XA)、顺河村(XB)、遂宁市射洪市桑树林村(XC)和遂宁市蓬溪县永益村(XD)的白芷品种BZA001根际土壤,及遂宁市蓬溪县永益村种植的白芷品系BZB003的根际土壤(XI)。BZA001和BZB003均为课题组多年来选育的遗传稳定的川白芷品种(系),BZA001已于2012年审定为“川芷2号”白芷品种。
1.2 方法
1.2.1 白芷根际细菌的分离纯化 采用五点法及抖根法挖取白芷根系,抖掉根系多余的土,用刷子轻轻刷下根系表面的土收集作为试验材料。将各根际土样过孔径2 mm的筛后,参照杨茉等[18]的方法分离纯化根际细菌,以“来源+数字”的格式命名,置4℃冰箱存放。
1.2.2 促生细菌的筛选 固氮、溶磷、解钾细菌的筛选参照王明欢等[19]方法,接种细菌于固氮、无机磷、解钾培养基上,通过菌株在选择培养基上的生长情况和有无透明圈来判断菌株有无固氮、溶磷、解钾活性。
产铁载体细菌的筛选采用铬天青比色法,参照程诚[20]的方法进行菌株培养和比色反应,用酶标仪在630 nm处测定吸光度值,根据下列公式计算铁载体含量:Su(%)=(Ar-A)/Ar×100%(Su为铁载体含量;Ar为对照反应后的吸光度值;A为菌液反应后的吸光度值)。
产IAA细菌的筛选采用Salkowski比色法,参照刘晔等[21]的方法进行菌株培养和比色反应,用酶标仪在530 nm处测定吸光值,将20 mg/L IAA标准液分别稀释为5、10、15和20 mg/L,绘制出标准曲线,根据标准曲线计算各个菌株IAA产量(μg/mL)。
1.2.3 形态学鉴定 观察纯化后的菌株菌落,记录其形状、颜色、边缘、高度、干湿等性状,并参照《常见细菌系统鉴定手册》方法进行革兰氏染色观察[22]。
1.2.4 促生细菌的分子生物学鉴定 按照TIANGEN细菌基因组提取试剂盒(DP302)说明书提取DNA,采用通用引物27F/1492R进行细菌16S rDNA基因序列的扩增。将扩增后PCR产物送擎科生物科技有限公司测序,得到的16S rDNA序列用BLAST于GenBank数 据 库(www.ncbi.nlm.nih.gov/BLAST)中与己知序列进行同源性比对分析。
1.2.5 白芷PGPR的促生效应验证 通过盆栽试验验证所选促生能力最强的PGPR菌株对白芷的促生效应。将菌株接种于牛肉膏蛋白胨液体培养基,180 r/min,37℃恒温摇床培养3 d,6 000 r/min离心10 min后收集菌体,加入无菌水振荡重悬,将菌液浓度调至OD595=1(备用)。盆栽试验土壤来自于四川省遂宁市川白芷种植基地(船山区余建村)。盆栽试验所用白芷品种BZA001、品系BZB003幼苗于2020年10月播种于四川农业大学成都校区青蒲园内,第二年3月选择长势一致的川白芷植株(每株白芷幼苗保持在相似重量下),用流水冲洗白芷幼苗根部至无褐色土壤痕迹后,将白芷根部浸泡于75%乙醇5 min后,迅速用无菌水冲洗掉残余酒精(重复两次),移栽于圆形花盆(d=35 cm),每盆种5株。
试 验 共4个 处 理 组:(1)BZA001+蒸 馏 水;(2)BZB003+蒸 馏 水;(3)BZA001+XI-1;(4)BZB003+XI-1。每组6个重复,每个重复5株,共30株。从4-6月在白芷根部3.0 cm处浇灌菌液,每株100 mL,每月浇菌一次,共3次,对照组浇等量无菌水。在白芷采收期7月下旬进行采收,统计各组白芷株高、根长、根粗、地上鲜重和根鲜重,并以根鲜重衡量各组产量,计算增产率,参考《中国药典》测定欧前胡素和异欧前胡素含量[23]。
1.2.6 数据分析 利用Microsoft Excel 2010和 SPSS 20.0对数据进行统计分析。
2 结果
2.1 根际细菌菌株分离纯化
从5份种植于四川遂宁不同地点的白芷根际土壤中共分离纯化出77株细菌,分别编号为XA-1-9;XB-1-16;XC-1-2;XD-1-36;XI-1-14。
2.2 促生细菌筛选
2.2.1 固氮活性菌株筛选 将77株细菌在固氮培养基上划线培养,2 d后转接,经3次转接后,有23株仍能生长,具有固氮能力,如表1所示。其中菌株XB-8、XB-9、XB-11、XB-13、XB-14、XB-15、XD-9、XD-10、XD-13、XD-23、XD-27、XI-1、XI-3长势较好,具有较强的固氮能力,如图1所示。

图1 部分白芷根际细菌固氮效果图Fig. 1 Nitrogen-fixing effect of rhizosphere bacteria of A.dahurica var. formosana
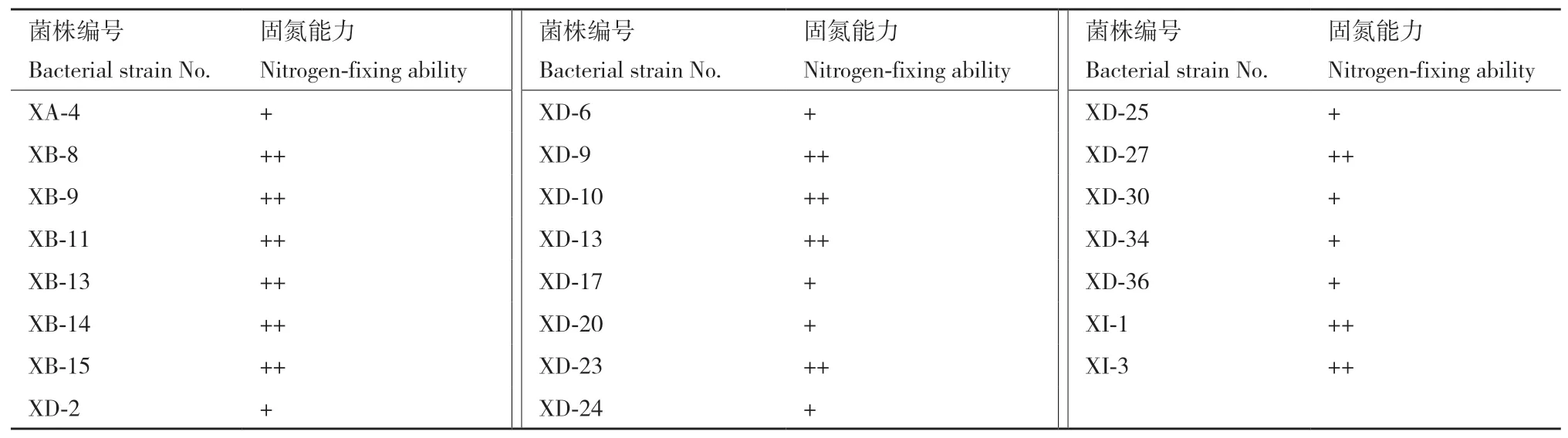
表1 白芷根际菌株固氮活性筛选Table 1 Screening of nitrogen-fixing activity of strains around the rhizosphere of A. dahurica var. formosana
2.2.2 溶磷活性菌株筛选 将77株细菌分别点接在无机磷培养基上培养5 d,以透明圈直径/菌落直径(D/d)的值判断株菌溶磷能力。20株细菌在无机磷培养基上产生透明圈,具有溶磷活性(D/d=1.03-2.42),其中,菌株XI-1和XI-3溶解无机磷的能力最强(图2-3)。
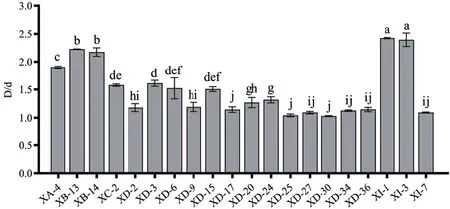
图2 白芷根际细菌溶解无机磷活性测定Fig. 2 Determination of dissolving inorganic phosphorus activities of bacteria around the rhizosphere of A.dahurica var. formosana
2.2.3 解钾活性菌株筛选 将77株细菌点接在解钾培养基上培养5 d,以透明圈直径/菌落直径(D/d)的值判断株菌解钾能力。有5株细菌在在解钾培养基上生长,但均未出现透明圈,说明全部菌株均无解钾活性(图4)。
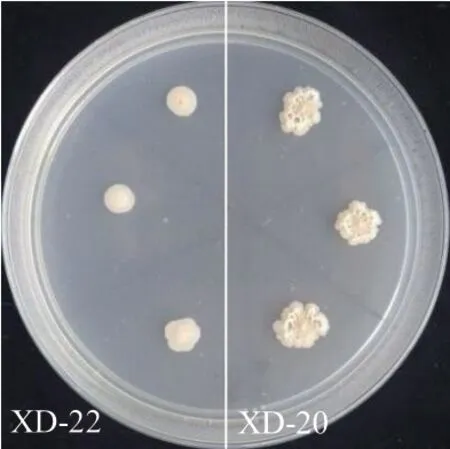
图4 部分白芷根际细菌解钾效果图Fig. 4 Potassium-solubilizing effect of bacteria around the rhizosphere of A. dahurica var. formosana
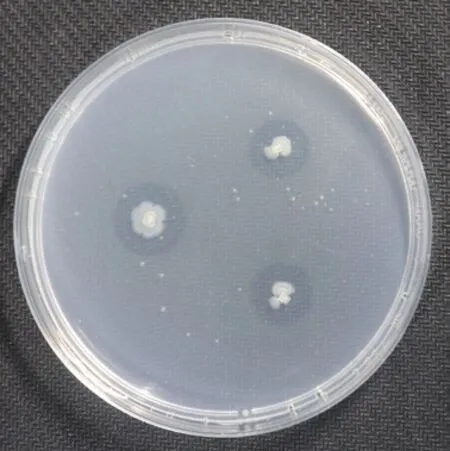
图3 白芷根际细菌XI-1溶磷效果图Fig. 3 Phosphorus-solubilizing effect of bacteria XI-1 around the rhizosphere of A. dahurica var. formosana
2.2.4 产铁载体菌株筛选 利用铬天青比色法初步筛选出能够产生铁载体的细菌,根据溶液变黄程度判断产铁载体能力,颜色越黄表示菌株产铁载体能力越强。77株细菌中有50株细菌菌液加入CAS检测液后溶液颜色由蓝色变为黄绿色,4株细菌(XB-13、XB-14、XC-1、XD-29)菌液变为黄色,说明这些细菌具有一定产铁载体能力,以XB-13、XB-14、XC-1、XD-29产铁载体能力相对较强(图5)。

图5 白芷部分根际细菌产铁载体显色反应Fig. 5 Color reaction of siderophores produced by the bacteria around rhizosphere of A. dahurica var.formosana
用酶标仪在630 nm处测定变黄菌液吸光度值,按公式计算菌液铁载体含量。如图6所示,4株产铁载体能力较强的细菌(XB-13、XB-14、XC-1、XD-29)所产生铁载体含量均大于30%,其中菌株XB-13产铁载体能力最强,其菌液铁载体含量为34.08%。
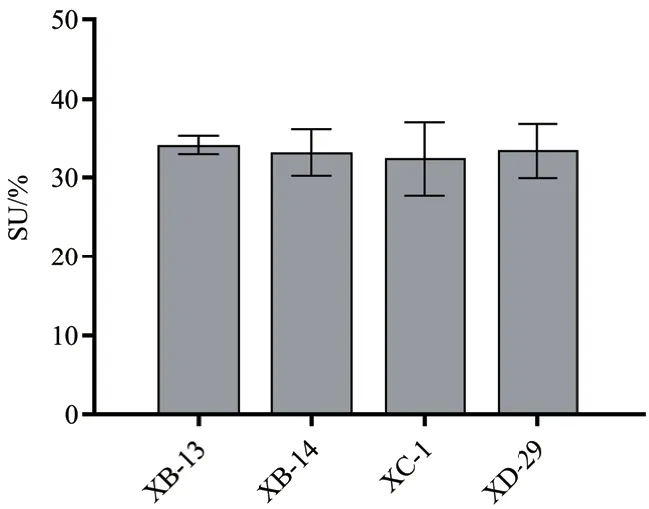
图6 白芷根际细菌产铁载体测定Fig. 6 Determination of producing siderophores capacity of bacteria around the rhizosphere of A. dahurica var. formosana
2.2.5 产IAA菌株筛选 利用Salkowski’s比色液显色反应判断77株白芷根际细菌是否产生IAA。以未接种培养液为阴性对照,以5 μg/mL IAA溶液为阳性对照,根据反应后菌液颜色变粉红色程度进行判断,颜色越红代表菌株产IAA能力越强(图7)。与Salkowski’s比色液 反 应后77株 细菌中有15株细菌的菌液变为淡粉色,表明其产IAA能力较弱;7株 细 菌(XA-6、XB-14、XB-14、XD-11、XD-29、XI-1、XI-3)的菌液显著变红色,产IAA能力较强。

图7 测定部分白芷根际细菌产IAA活性的显色反应Fig. 7 Color reaction of IAA production activity of some bacteria around the rhizosphere of A. dahurica var.formosana
使用酶标仪在530 nm处测定显著变红的7株细菌菌液的吸光度值,计算细菌的IAA产量结果如图8所示。7株细菌IAA分泌量范围为5.39-21.96 μg/mL,其中菌株XI-1和XI-3产IAA的能力最强,分泌量为21.96和20.82 μg/mL,其次为XD-29,为17.17μg/mL。

图8 白芷根际细菌产IAA定量测定Fig. 8 Quantitative determination of IAA production by bacteria around the rhizosphere of A. dahurica var.formosana
2.3 促生细菌的鉴定
根据固氮、溶磷、解钾、产铁载体和产IAA五种促生特性筛选的结果,去除46株无促生潜力或促生潜力较弱的的菌株,对剩下的31株PGPR菌株进行形态学和分子生物学鉴定。其中,综合能力最强的XI-1菌株将作为后续盆栽试验研究材料。
2.3.1 形态鉴定 观察并记录31株菌的菌落形状、颜色、边缘、高度、光泽等性状,挑取单菌落并进行革兰氏染色。其中,菌株XI-1菌落为灰白色,圆形,拱起,边缘波状,有光泽,属革兰氏阴性细菌(图9,表2)。
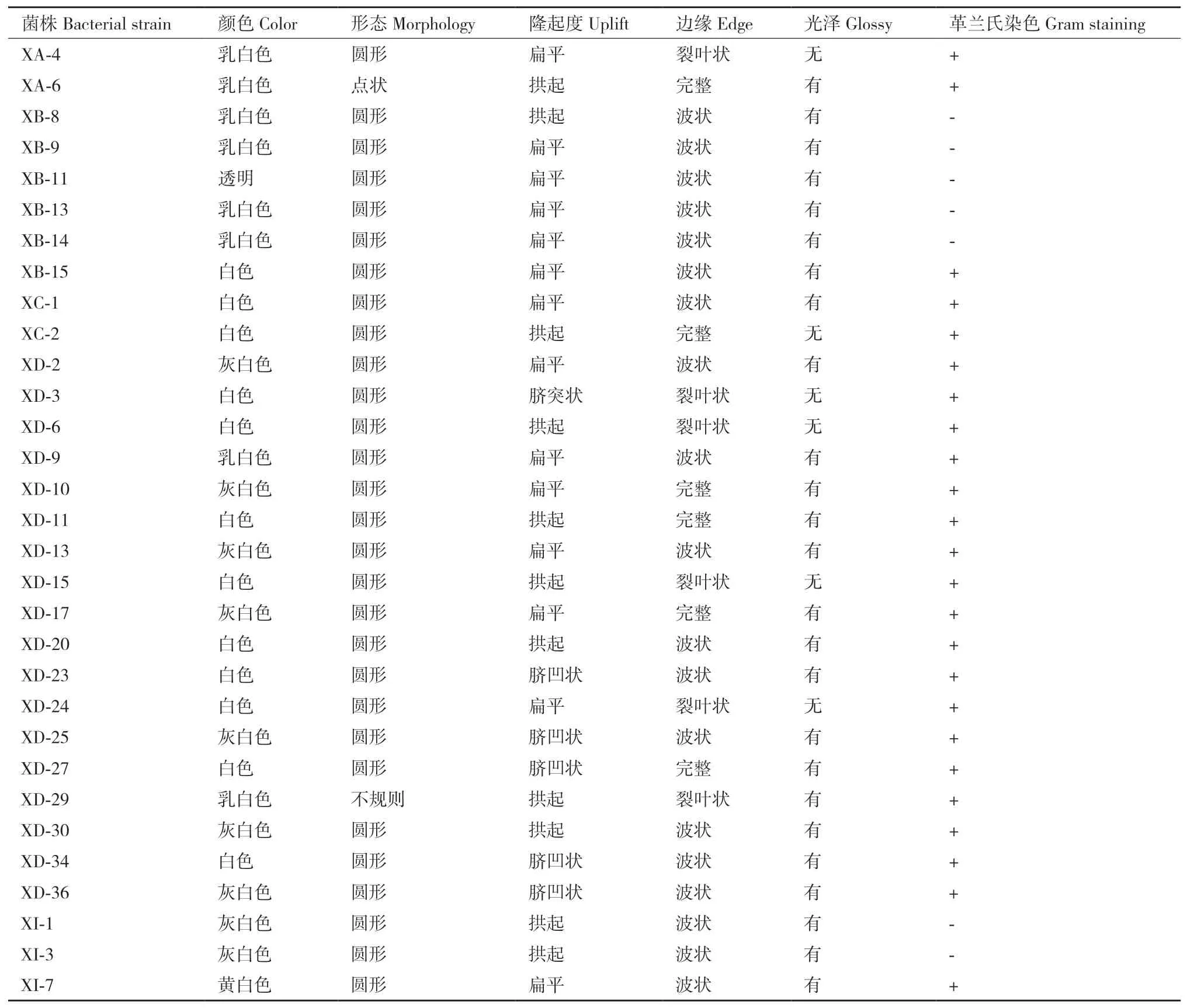
表2 白芷根际细菌的形态和革兰氏染色特征Table 2 Morphology and Gram staining characteristics of bacteria around the rhizosphere of A. dahurica var. formosana
图9 白芷根际细菌XI-1菌落图Fig. 9 Colony of bacteria XI-1 around the rhizosphere of A. dahurica var. formosana
2.3.2 16S rDNA序列比对分析 将31株菌分别依次进行DNA提取、PCR扩增和测序,测序后在GenBank数据库中进行比对分析。如表3所示,所筛31株白芷PGPR比对结果同源性均大于99%,可确定为同一种[24]。结合形态学分析发现,31株PGPR中有20株菌株来源于芽孢杆菌属(Bacillus),占64.52%,4株菌株来源于肠杆菌属(Enterobacter),2株菌株来源于类芽孢杆菌(Paenibacillus),2株菌株来源于假单胞菌属(Pseudomonas),2株菌株来源于克雷伯菌属(Klebsiella),1株来源于假芽孢杆菌属(Fictibacillus)。菌 株XI-1与Klebsiella grimontii菌株同源相似性最高,达99.79%,结合菌落形态特征,初步鉴定XI-1菌株为Klebsiella grimontii。
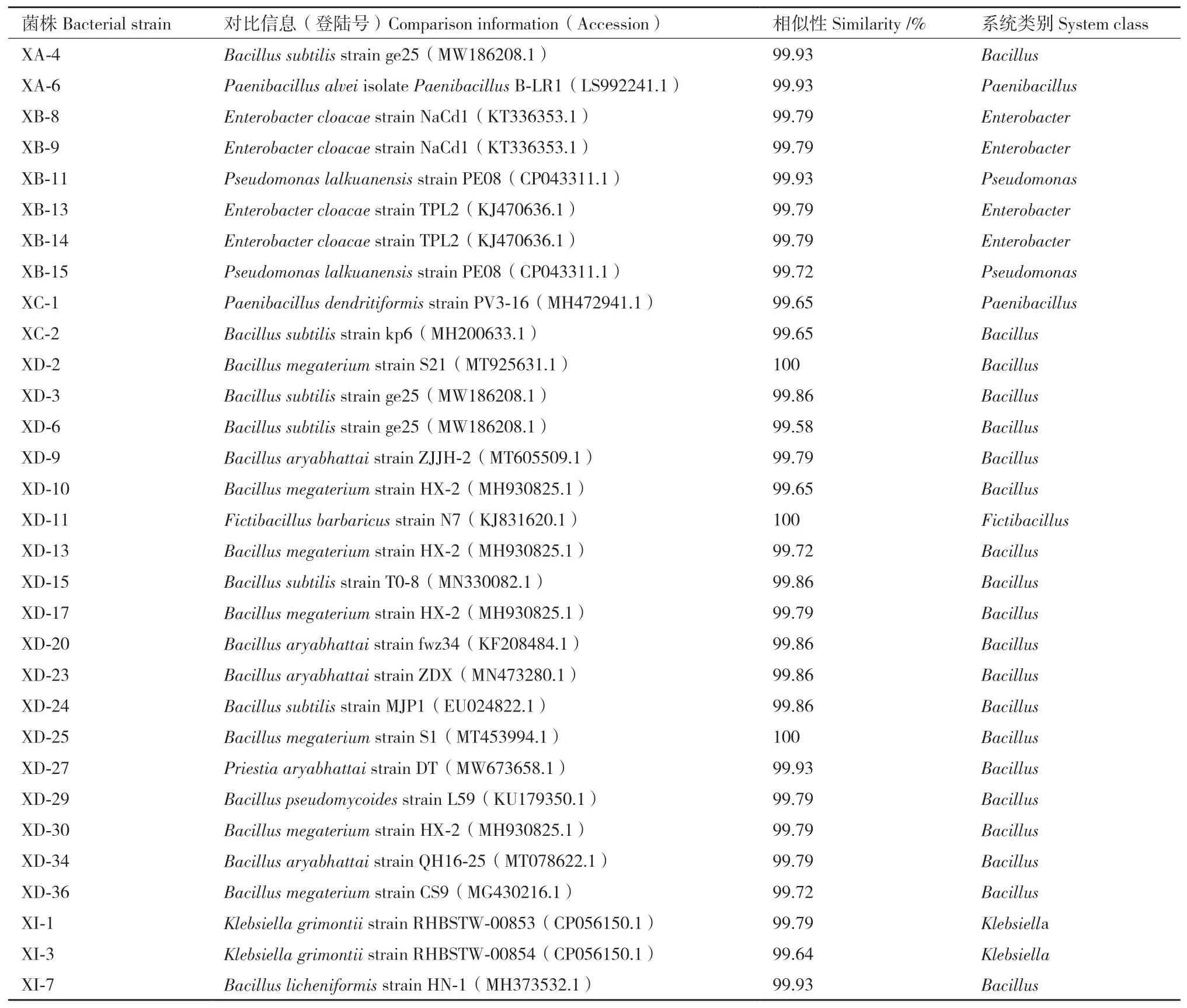
表3 菌株的16S rDNA序列同源性分析Table 3 Homology analysis of 16S rDNA sequences of all strains
2.4 PGPR对川白芷促生效果的验证
选择综合能力最强的白芷根际细菌克雷伯氏菌株XI-1进行盆栽试验,该XI-1具有较强的固氮、溶磷、产IAA活性,其溶磷能力达2.42(D/d),产IAA能力达21.96 μg/mL。
盆栽试验结果如图10所示,克雷伯氏菌株XI-1对各处理组白芷生长均有明显的促进作用。该试验发现接种菌株XI-1后,BZA001的株高、根粗和根鲜重均显著增长,增产率达31.85%(图10-A,10-C,10-E);欧前胡素含量显著下降为6.04 mg/g,但单株欧前胡素总含量略有上升(图10-G,图10-I);异欧前胡素含量差异不显著(图10-H,图10-I)。试验还发现接种后BZB003的株高、根长、根粗、地上鲜重和根鲜重均显著增长,且该菌对BZB003的增产效果优于对BZA001的效果,增产率达64.59%(图10-F);欧前胡素含量显著下降,为5.91 mg/g,但其单株欧前胡素总含量处于显著上升水平,达48.73 mg/株(图10-G,图10-I);施菌后异欧前胡素含量显著下降为1.0 mg/g,而其单株总含量仍处于略高于对照的水平(图10-H,图10-J)。这些结果表明该PGPR菌株确实对两种川白芷品种(系)均有促进白芷生长和产量起作用。

图10 接种XI-1对两个不同白芷品种(系)的促生效果Fig. 10 Growth-promoting effect of inoculated XI-1 on two different varieties(line)of A. dahurica var. formosana
3 讨论
目前,生物肥料以固氮生物肥料为主,其次是增磷生物肥料,生物肥料种类和数量远少于合成农用化学肥料[9]。而应用于中药材种植的微生物菌肥不足百种,市场需求较大[25]。已有的研究表明,由PGPR制成的微生物肥料经济、环保,可替代部分化肥用量,同时可增加产量,提高品质[26],是农业可持续发展下化肥的有效补充,这在黄瓜[27]、番茄[28]、玉米[29]、小麦[30]等研究中已有大量报道。由此,本试验开展白芷根际促生细菌对白芷产量和品质影响研究具有重要意义,可为生产实际中提高白芷产量和改进品质,以及开展白芷专用菌肥研究提供理论依据。
本试验结合细菌固氮、溶磷、溶钾、产铁载体、产IAA能力,共筛选出31株促生潜力较强的白芷根际促生菌。土壤PGPR具有多样性及广泛性,Maria等[31]从番茄根际分离出200株细菌,筛选出两株PGPR菌剂潜在菌种资源,分别属于泛菌属和假单胞菌属;雷海英等[32]以苦参根际土壤为材料,共分离鉴定了20株促生菌,发现它们分属于5个菌属,其中假单胞菌属占所有菌株的50%。本试验细菌鉴定结果发现31株白芷根际促生菌多为芽孢杆菌属(Bacillus),占64.52%。芽孢杆菌属是常见的PGPR种类之一[33],路晓培[34]在内蒙古武川马铃薯和凉城植物柠条根际土中共分离鉴定了134株细菌,其中以芽孢杆菌属数量最多,占所有菌株的22.31%。芽孢杆菌因其耐受性强、促生防病效果明显,被广泛应用于工业、农业生产及绿化造林中[35],白芷根际芽孢杆菌应同样存在巨大应用潜力。
本试验中促生潜力最强的菌株XI-1为Klebsiella grimontii,属克雷伯氏菌属菌株。已有的研究表明,该属的产酸克雷伯氏菌可提高土壤酶活、促进玉米幼苗的生长并提高玉米的耐盐碱能力[36]。除此之外,克雷伯氏菌还可降解部分有害物质,林杨等[37]发现吉林克雷伯氏菌2N3对噻吩磺隆污染土壤具有较好修复作用。谢澳文等[38]以香豆素为唯一碳源筛选出的克雷伯氏菌株对黄曲霉毒素具有显著降解作用。有关K. grimontii作为微生物菌肥运用于植物的研究还相对较少,菌株XI-1在白芷促生和其他功能开发上具有较大潜力,但进一步开发利用还需进行安全性评价[39]。
本试验发现,接种来源于BZB003的根际PGPR菌株XI-1后,2份不同的白芷品种(系)欧前胡素和异欧前胡素含量均下降,其中BZB003欧前胡素和异欧前胡素含量下降均达显著水平。谢澳文等[38]发现香豆素可作为部分克雷伯氏菌株的碳源供其生长,据此推测白芷的香豆素成分(如欧前胡素和异欧前胡素)可能是使PGPR菌株XI-1在白芷根际定殖的因素之一,这为菌株XI-1和白芷相互作用研究提供了新的思路。
XI-1同时具有较强的固氮、溶磷和产IAA能力,且在不施肥条件下对白芷生长及产量表现出积极的促进作用,增产率分别高达31.85%和64.59%,具有成为微生物菌肥的应用前景。白芷主要有效成分欧前胡素和异欧前胡素含量虽显著下降,但其单株总成分含量并未下降,且远高于《中国药典》(2020版)规定的欧前胡素和异欧前胡素含量[23],这一方面可能与白芷品种(系)BZA001和BZB003自身性状优良有关,另一方面也可能与白芷在盆栽的低营养逆境下生长受抑,次生代谢产物反而累积有关[40]。同时,本试验结果还表明,XI-1对BZB003白芷品系的促生长作用优于BZA001品种,表明该菌株更能与BZB003建立良好的互利共生关系,至于其中的相互作用机制仍待进一步研究。
总体而言,本试验所筛白芷根际PGPR菌株具有很大的开发前景,可为未来白芷种植中增产保质、化肥减施提供科学依据。
4 结论
从白芷根际分离筛选得到31株PGPR菌株,其 中64.52%均 属 于 芽 孢 杆 菌 属(Bacillus)。K.grimontii菌株具有较强的固氮、溶磷、产IAA活性,综合促生潜力最强,其溶磷活性达2.42(D/d),产IAA活性达21.96 μg/mL。盆栽结果表明,在不施肥的条件下XI-1对2种不同白芷品种(系)的生长及产量均有显著提高,增产率分别为31.85%和64.59%。K. grimontii菌株XI-1在一定程度上缓解了缺肥对白芷生长的限制,具有发展为白芷微生物菌剂的潜质。