大豆孢囊线虫侵染对乙烯合成及信号传导基因表达调控的研究
郭宾会 宋丽
(1. 扬州大学农业科技发展研究院 教育部农业与农产品安全国际合作联合实验室,扬州 225009;2. 扬州大学生命科学基础实验教学中心,扬州 225009)
大 豆 孢 囊 线 虫(Heterodera glycines,soybean cyst nematode,SCN)是一种土传的定居型内寄生线虫,在我国东北和黄淮海大豆产区普遍发生,受害大豆一般减产30%-50%,严重时可导致绝产[1]。乙烯(ethylene)是植物的一种重要内源激素,广泛参与调控植物的生长发育及防御反应[2-3]。研究表明线虫危害能够强烈诱导植物释放乙烯[4]。根结线虫(root-knot nematode,RKN)感染番茄期间乙烯合成增加,并且向根环境中添加乙烯会增加根上成熟的线虫数量[5];SCN侵染的根中乙烯合成水平略低,但是根尖中ACC的含量则较高[6];使用乙烯合成抑制剂处理后的拟南芥或大豆的根均可显著吸引更多的线虫[7-8];产生过量乙烯的拟南芥遗传突变体对甜菜胞囊线虫高度敏感[9-10]。此外,乙烯的响应途径也参与调控线虫定殖,如ERF-E2基因(ethylene response factor gene)下调的番茄转基因根的分泌物对南方根结线虫的吸引力显著增强[3];在乙烯不敏感的拟南芥突变体根中甜菜胞囊线虫定殖比野生型显著减少[9-10];对乙烯敏感性降低的大豆品系也显著减少了SCN在根中的定殖。因此,乙烯的合成及信号传导途径在线虫吸引过程中均发挥关键作用[11-12]。
近年来,诸多研究人员对SCN侵染后大豆根的基因表达变化进行了深入研究。在大豆Williams82中接种SCN 3号生理小种8-16 d后,根中乙烯响应普遍降低[13]。Tucker等[6]研究表明ACC合成酶(1-aminoacyclopropane 1-carboxylate synthase,ACS)基因的表达随着侵染时间的延长表达量增加。Wan等[14]通过对比2个大豆抗性品种(PI 437654 and PI 567516C)接种大豆孢囊线虫3 d和8 d后与未接种对比发现乙烯代谢相关的基因被显著调控。此外,拟南芥接种甜菜胞囊线虫J2幼虫后24-48 h,EIN2基因先诱导后抑制[12]。乙烯响应成分结合蛋白基因(ethylene-responsive element-binding protein)在SCN侵染大豆抗性品种过程中亦受到显著诱导[15-16]。
ACS基因催化S-腺苷甲硫氨酸(SAM)生成氨基环丙烷羧酸(ACC)进而合成乙烯,是乙烯合成途径的重要限速酶[17]。ACS的活性调节主要包括转录调控、蛋白降解及磷酸化激活,其中转录调控是ACS普遍存在的调节方式之一。研究表明,生物胁迫及非生物胁迫均能够广泛诱导ACS基因表达[17]。乙烯受体EIN2(ethylene-in-sensitive,EIN)和转录因子EIN3是位于乙烯信号传导途径的下游重要组分,正调控乙烯应答基因的表达[18]。
尽管乙烯合成及信号传导途径参与线虫侵染及定殖在近年来取得了较多进展,但至今为止,对于乙烯合成基因ACS及信号途径EIN基因如何参与诱导大豆孢囊线虫抗性的分子机理仍所知甚少,尤其是在大豆不同抗性品种中上述基因响应孢囊线虫侵染时表达水平有何不同尚无报道。本研究对8个大豆抗病材料和2个感病材料在SCN 3号生理小种侵染10 d后的乙烯相关基因(ACS和EIN基因家族)的表达水平与未接种材料进行了比对,为进一步了解大豆抗性品种的抗性分子机理提供理论依据。
1 材料与方法
1.1 材料
本研究用到的大豆抗病品种为Forrest、Peking、PI 437654、PI 89772、PI 90763、PI88788、PI548316、PI567516C和PI 438489B,感病品种为Magellan和Essex。以上品种由美国密苏里大学大豆研究室保存。材料种植在美国密苏里大学(哥伦比亚校区)植物系温室中。
1.2 方法
1.2.1 虫卵采集及大豆胞囊线虫卵悬液制备 将种植在温室盘中(17 cm ×28 cm×17 cm)含有3号生理小种的病土中生长1个月左右的感病品种Lee68从土中取出,通过高压水枪冲洗根收集孢囊,依次在不同孔隙度(孔径250、105、75和25 μm)的筛子上研磨,最终将胞囊破碎后释放出来的卵冲洗入烧杯内。终浓度为13%的蔗糖溶液密度梯度离心后收集虫卵,取10 μL进行梯度稀释,然后在显微镜下计数虫卵密度,备用接种。
1.2.2 大豆幼苗培养及接种 上述11个大豆品种材料首先在萌发纸袋中室温萌发3-5 d,然后选取生长一致的幼苗移至温室盆中的无菌沙壤土中培养3 d。盆容量为8 L,将盆悬挂在控温的水中,以保持土壤温度约27℃。每盆插入25个管子(直径约3 cm,长25 cm),每管移栽一株大豆幼苗。在每个大豆主根附近打1个深度约15 cm的孔,将虫卵悬浮液依次注入,每株接种虫卵的个数约为2 000个。未接种材料注入等体积水作为对照。每个材料接种10棵,接种10 d后,连根挖出,用无菌水将5棵大豆的根快速清洗并擦干水分后置液氮中速冻,然后超低温冰箱保存。未接种材料同时取材作为对照。实验重复3次。
1.2.3 染色观察 大豆根用5.25%次氯酸钠浸泡4 min后,用流动的自来水冲洗干净,然后置于0.37%酸性品红溶液中染色,微波炉中煮沸约30 s,取出置于流动的自来水下冲洗。将根置于甘油中保存和观察。使用解剖显微镜观察染色后的SCN幼虫,以确保接种效率[19]。
1.2.4 RNA提取 冷冻样品在液氮中用研钵和杵研磨成粉末。按照Qiagen 植物RNA提取试剂盒(Cat#74904)说明书提取约200 mg的组织样本中总RNA。所提取的总RNA进一步用Qiagen无核糖核酸酶DNA酶试剂盒(Cat#79254)消化DNA。使用Nanodrop®1000分 光 光 度 计 定 量RNA(Thermo Scientific)。
1.2.5 荧光定量PCR 以提取的每个样本的2 μg总RNA为 模 板,按 照Clontech反 转 录 试 剂盒(Cat#639549)说明书合成cDNA。PCR反应使用Thermo公 司 的Maxima SYBR Green/ROX qPCR(Cat#K0223)。扩增程序如下:50℃ 2 min,95℃ 10 min,然后95℃ 15 s,60℃ 10 min,40个循环。以Actin(Glyma.18G290800)基因为内参基因。每个样本有3个生物学重复和2个技术重复。用2-(ΔΔct)法计算出各个基因在不同材料中的相对表达量。所有引物均采用Primer3在线程序设计(http://frodo.wi.mit.edu/primer3/)[20]。引物序列见表1。大豆EIN和ACS基因命名采用Arraes等[21]文章中的命名规则。
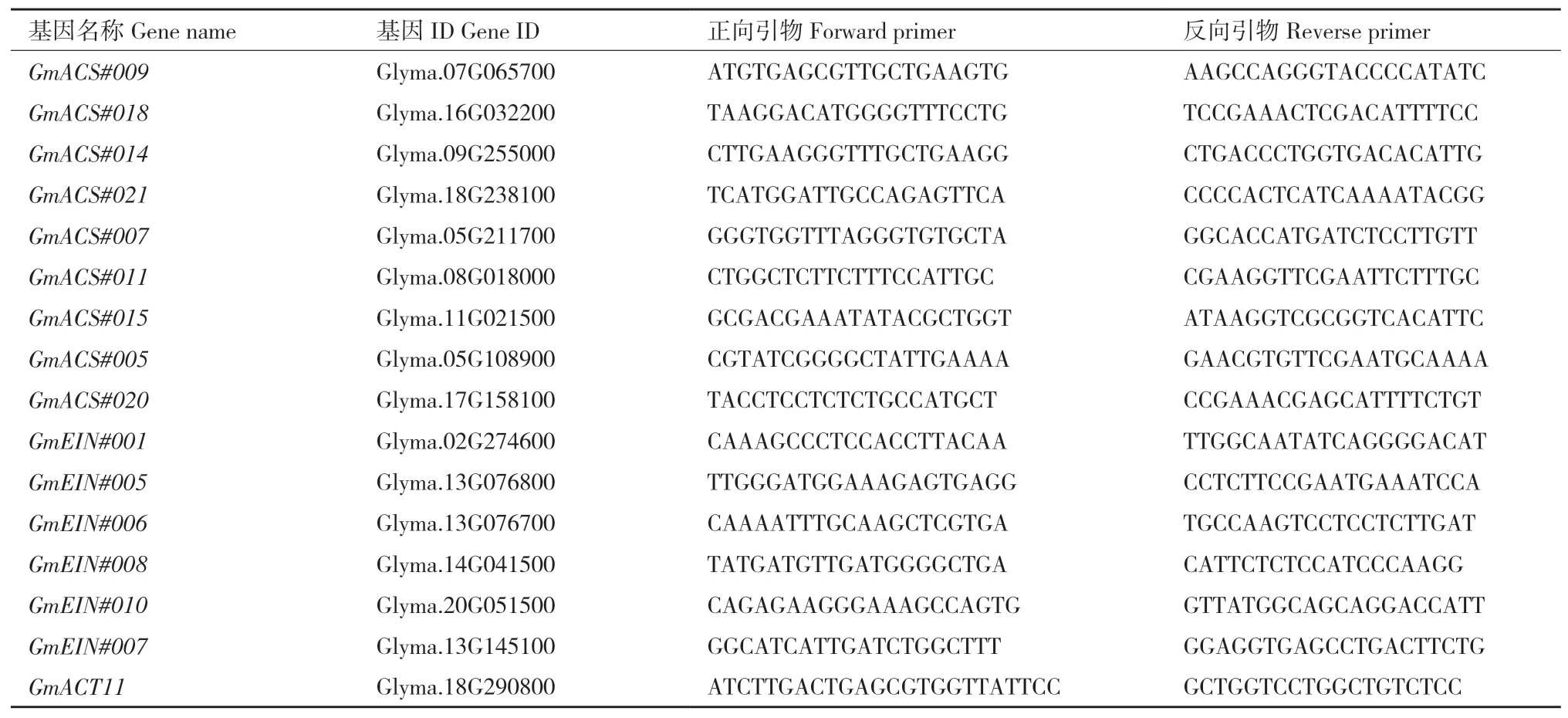
表1 乙烯相关基因及其RT-qPCR引物序列Table 1 Ethylene related genes and their RT-qPCR primer sequences
2 结果
2.1 大豆EIN和ACS家族的组织特异性表达分析
大豆基因组共编码21个GmACS基因及11个GmEIN基因。为了确定大豆EIN和ACS基因家族在不同组织的表达谱,我们对Phytozome数据库中的基因组织表达模式进行了分析。结果如图1所示,GmACS和GmEIN基因在大豆营养和生殖生长的不同组织中均有不同丰度的表达。在根和根毛中相对高表达的基因有GmACS#001、GmACS#005、G m A C S#0 0 6、G m A C S#0 0 7、G m A C S#0 1 0、GmACS#012、GmACS#015和GmACS#020, 其 中GmACS#015在叶组织中表达也较高。而GmEIN基因家族均无在根及根毛中有特异性高表达。

图1 GmACS和GmEIN基因家族的组织表达模式Fig. 1 Tissue expression patterns of GmACS and GmEIN gene families
2.2 SCN接种后侵染效果
为监测孢囊线虫接种效果,我们对3号生理小种感病的大豆品种Magellan分别在接种2、4、6和8 d后的侵染情况进行了观察。如图2所示,孢囊线虫经历了从J2-J4期的发育(2-A-D),表明SCN侵染成功,而且侵染效率较高。图2-E表明在单株不同的根中SCN侵染8 d后染色观察,结果表明SCN在大豆根系中不同根中的侵染效率也是较高的,为后续RNA表达水平分析提供保障。

图2 SCN(race 3)侵染大豆Magellan品种后根组织染色Fig.2 Root staining after SCN(race 3)infecting soybean Magellan variety
2.3 不同大豆品种中GmEIN基因在SCN侵染后的表达模式
我们根据GmEIN基因家族的相对表达水平及特异性组织表达模式,对其中6个基因进行了SCN侵染前后的表达模式分析。如图3所示,6个GmEINs基因在SCN侵染10 d后,表达变化水平较小,其中GmEIN#010和GmEIN#007在所有大豆品种中其表达水平均未受到显著调控。此外,在非抗病性品种Magellan和Essex中,以及抗性品种Forrest、Peking、PI 88788、PI 548316、PI 567516C中,6个GmEINs的表达均未受到显著调控。GmEIN#001、GmEIN#005、GmEIN#006和GmEIN#008的 表 达 在PI 438489B均受到SCN显著上调上调幅度较小,约1.5-2.2倍 左 右。另 外,GmEIN#001、GmEIN#005和GmEIN#008的表达在PI 437654、PI 89772和PI 90763中亦均受到SCN显著诱导。以上研究结果表明4个大豆抗性品种(PI 438489B、PI 437654、PI 89772和PI 90763)中乙烯的信号传导在SCN侵染后得到一定程度加强,但是其他5个抗病品种中的表达与2个感病品种相似。
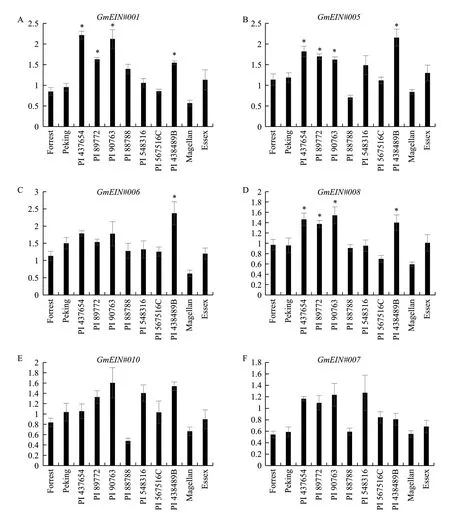
图3 GmEIN基因在SCN侵染10 d后与未侵染对照的相对表达水平Fig.3 Relative expressions of GmEIN genes in SCN infected root 10 d after inoculation compared with uninfected control
2.4 不同大豆品种中GmACS基因在SCN侵染后的表达模式
选取9个GmACS基因进行SCN侵染前后的表达模式分析。如图4和5所示,乙烯合成相关基因ACS家族9个基因在SCN侵染10 d后,在抗病品种中表达水平受到了显著调控(升高或抑制)。首先,PI 548316中有7个ACS基因(图4-C、图5-A-F)的表达被显著上调,其表达水平可升高6-260倍,如升高幅度最大的是GmACS#009,较未接种对照升高了260倍左右。其次,在PI 437654和 PI 88788中,多个GmACS基因的表达受到显著抑制。但是感病品种中,9个GmACS基因表达水平在侵染和未侵染植株中均无显著性差异。有些品种中仅其中几个基因受到显著调控,例如在Forrest品种 中,GmACS#009、GmACS#018和GmACS#014的表达受到了SCN侵染的显著上调(图5-A-C)。在Peking品种中,GmACS#020的表达受到了SCN侵染的显著上调(图5-F),但是SCN侵染却显著下调了GmACS#007、GmACS#011和GmACS#015的表达(图4-A-C)。上述结果表明乙烯的合成基因GmACS的表达在不同的抗性材料中受到了显著的差异调控。
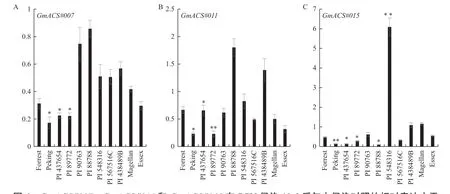
图4 GmACS#007、GmACS#011和GmACS#015在SCN侵染10 d后与未侵染对照的相对表达水平Fig.4 Relative expressions of GmACS#007,GmACS#011and GmACS#015 in SCN infected root 10 d after inoculation compared with uninfected control

图5 6个GmACS基因在SCN侵染10 d后与未侵染对照的相对表达水平Fig.5 Relative expressions of 6 GmACS genes in SCN infected root 10 d after inoculation compared with uninfected control
3 讨论
大豆孢囊线虫J2幼虫通过口针侵入大豆根部,到达维管束后注入大量的分泌物溶解相邻细胞的细胞壁,细胞壁溶解后原生质体融合即形成合胞体(syncytia)。因此,合胞体是线虫建立的多核取食位点来供其生长发育,合胞体在形态和生理上的变化是大豆基因表达变化调控的直接结果[12,22]。Ithal等[23]通过显微切割的方式对SCN侵染后大豆根中形成的合胞体的表达谱进行分析发现乙烯相关基因(如ACO,EIL1和ERF)受到调控。在SCN幼虫侵染及合胞体发育过程中,ACC氧化酶基因和ERF-TF基因的表达被显著调控[24]。本研究表明GmEIN基因主要在PI 437654、PI 89772、PI90763和PI438489B中表达被上调,在其余抗病及感病品种中均无显著变化。GmACS基因的表达调控分为两种类型:Peking、PI 437654、PI88988和PI 89772中被显著下调,而PI548316、PI567516C和PI438489B中的表达被显著上调,感病材料中无显著变化。由于本研究取材时间为SCN虫卵接种10 d后,此时合胞体已经形成,因此我们认为GmEIN和GmACS基因在不同抗性品种中的表达变化不仅与合胞体的发育相关,也与品种之间抗病程度及机制不同相关。未来进一步对合胞体中基因表达变化的深入解析将是挖掘SCN抗性机制的基础。
研究人员通过转基因技术发现乙烯合成或响应基因的确参与植物抗病虫性。Dahl等[4]发现下调烟草(N. attenuate)ACS基因的表达可减少虫害诱导的乙烯释放。过量表达ERF基因(RAP2.6)的转基因拟南芥对甜菜孢囊线虫的抗性增强[25]。过量表达rF113(AtRAP2.6的同源基因)的转基因大豆对大豆疫霉病的抗性增强[26]。另一方面,拟南芥AtRAP2.6L基因突变体对丁香假单胞菌的防御反应增强[27]。因此,乙烯的响应及信号传导在不同的植物品种及不同的抗病性中发挥复杂的调控功能。我国研究人员发现灰皮支黑豆(ZDD2315)是一个高抗SCN的大豆品种,在SCN 3号小种侵染后,与未接种对照相比,外源乙烯利施加降低灰皮支黑豆中SCN侵染率可达29.01%;而在敏感品种辽豆15中,乙烯利施加降低辽豆15中J2侵染率可达41.88%。因此,乙烯可能通过影响SCN幼体的感染率而发挥重要作用[16]。本研究中多个抗性品种的GmACS基因在SCN侵染后表达量受到大幅度调控,进一步说明乙烯的合成受到SCN侵染调控,而且这些GmACS基因可以作为提高大豆抗SCN育种的候选基因。但是有些抗性品种中未观察到GmACS基因表达的显著变化,说明在大豆SCN抗性品种及其抗性机制上可以分为两类,和乙烯合成相关或不相关。
目前我国报道的SCN生理小种已达11个,其中,1、3、4 号为主要致病小种且分布最广,3 号生理小种的致病力强且分布较广[28]。我国大豆品种资源丰富,筛选和利用抗性品种是控制大豆孢囊线虫危害的最经济有效的方法。然而,大豆防御大豆孢囊线虫的分子机制非常复杂,不仅涉及大豆品种,还有线虫的不同生理小种。目前,育种学家已经筛选出多个对抗不同生理小种的种质资源,然而仍有较多抗性种质资源的抗虫分子机制尚不清楚[29]。尽管多个抗性品种中GmACS基因的表达上调,但是PI548316品种中多个GmACS基因的诱导表达水平非常高,原因可能是该品种在受到SCN侵染10 d后的时间点,乙烯的合成被大幅上调。其他抗性品种中可能也有如此高的诱导表达水平,但是由于和侵染时间相关性较强,本次研究可能未检测到基因诱导峰值。其次,可能和不同的大豆孢囊线虫生理小种侵染相关。后续我们将对不同抗性品种在不同生理小种侵染不同时间段后检测ACS基因的表达水平,以期深入解析乙烯合成与孢囊线虫侵染之间的关系。
4 结论
本研究对大豆乙烯合成及信号响应基因在不同大豆材料(抗病或感病)中如何响应SCN侵染进行了表达水平的模式分析,研究结果表明乙烯合成基因GmACS在SCN侵染后的多个品种中的表达受到显著调控。研究结果不仅有助于更好地了解大豆-孢囊线虫互作,更为进一步解析不同种质资源中乙烯合成相关基因家族的响应及调控模式提供线索,从而为深入揭示不同大豆材料抗SCN机理提供理论依据。
致谢
本研究得到美国密苏里大学植物系Henry T.Nguyen教授的大力支持,实验结果均在该实验室取得。