青杄PwHAP5基因原核表达及多克隆抗体制备
覃雪晶 王雨涵 曹一博 张凌云
(北京林业大学林学院 森林培育与保护教育部重点实验室,北京 100083)
HAP(histone or heme-associated protein)是一种异源多聚体的蛋白复合物,作为一种常见的转录因子能够特异性结合顺式作用元件调控基因表达[1-2]。HAP类转录因子包含HAP2、HAP3和HAP5三个蛋白亚基,有报道称HAP复合物会在植物和酵母中与CCAAT的启动子序列结合,特异性地识别靶基因进行转录调控[3-5]。这3个亚基会在植物中产生大量的HAP2、HAP3、HAP5异源三聚体组合,从而为HAP复合物在高等植物中广泛参与基因转录过程和发挥多种作用提供了可能[6]。
现有研究显示,水稻XS11的OsHAP3H突变体抽穗期较野生型发生显著变化,说明OsHAP3H在抑制水稻光周期开花过程中起着关键作用[7]。部分HAP基因参与调控水稻抽穗期,这部分基因的过表达株系相较于WT都出现了花期延迟的现象[8-9]。此外,部分HAP基因也参与了水稻种子及胚乳发育的过程[10]。过表达水稻血红素激活蛋白基因(OsHAP2E)可以显著提高水稻对盐、干旱及病原菌的抗性,并提升光合速率和增加分蘖数[11]。过表达细菌植酸酶PaPhyC(HAP型)的拟南芥植株莲座叶面积和直径增大,磷含量增加,地上部干重增加,表明植物能够利用植酸作为磷源进行生长发育[12]。也可通过AtHAP5A与AtXTH21的CCAAT结合来参与响应拟南芥的抗冻机制[5,13],AtHAP5A可能在缺铁拟南芥中调控铁转运[14]。由此可见,HAP家族广泛参与了水稻和拟南芥花期调控、种子发育、光合作用等生长发育和干旱、盐碱、冻害等非生物胁迫响应的过程。目前HAP转录因子的研究大多集中在HAP2和 HAP3,关于HAP5功能的研究报道很少,HAP5作为HAP转录因子的重要成员之一,与其他亚基有密切的联系。由前人的研究推测,HAP5可能广泛参与多种植物花期调控及响应逆境胁迫反应等过程,需要深入研究其功能和参与调控的机制,为后续植物品种改良奠定研究基础。
青杄(Picea wilsonii)是松科(Pinaceae)云杉属(Picea)的常绿高大乔木,因美观的树型和优良的材质成为我国北方多个地区常见的园林绿化、造林、用材树种[15]。但随着近年来全球气候异常和环境污染加剧,干旱、盐碱化、冻害及高温胁迫等非生物胁迫因子严重影响了青杄的生存环境和生长。现代分子生物学技术的飞速发展推动了青杄抗逆的相关研究,通过一系列生物学手段挖掘青杄抗逆基因并验证基因功能、揭示转录因子调控机制等研究已有陆续报道。前人通过测序、结构分析、同源性及进化分析等方法发现青杄转录因子PwHAP5和拟南芥存在相近的亲缘关系[16]。本课题组前期从青杄中分离出HAP5亚基,验证了PwHAP5参与调控青杄花粉管的生长方向[17],经模式植物拟南芥验证了HAP5亚基在盐碱、干旱等非生物胁迫的过程中起到重要作用[4]。也通过制备目的蛋白的多克隆抗体分析青杄的蛋白定位和蛋白互作情况,这为研究PwHAP5基因参与调控青杄抗逆机制提供了方法参考[18]。
本研究通过构建原核表达载体pET-48b-PwHAP5并转入大肠杆菌,经诱导生成蛋白产物并纯化获得重组蛋白PwHAP5,将蛋白注射入新西兰兔体内获取抗PwHAP5兔血清,经纯化制备出高效价、特异性强的PwHAP5兔多克隆抗体,用于检测PwHAP5蛋白在青杄花粉中的表达情况,以便后续开展PwHAP5基因的功能研究。
1 材料与方法
1.1 材料
本试验青杄花粉样品采自中科院植物所北京植物园,样品室温晾干后存储于-80℃超低温冰箱备用。pET-48b载体由清华大学生命科学学院张大鹏实验室惠赠,健康成年的新西兰大白兔2只。
主要试剂:AP标记的羊抗兔抗体IgG、聚偏二氟乙烯膜(PVDF转印膜)、His标签抗体购于北京亚太恒信生物技术有限公司;大肠杆菌感受态BL21、质粒小量抽提试剂盒、RNA提取试剂盒、DNA marker、DNA纯化回收试剂盒购于北京天根生化科技有限公司;其他常用化学试剂为进口或国产的分析纯。
1.2 方法
1.2.1 青杄PwHAP5基因序列克隆 从数据库GenBank获取PwHAP5基因序列,使用Primer 5.0软件设计引物P1,P2,得到序列如表1所示。通过试剂盒提取青杄花粉RNA,再反转录合成cDNA。
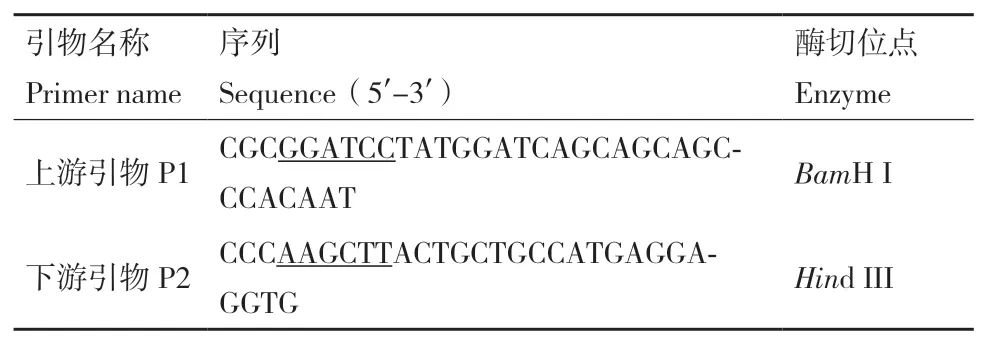
表1 引物信息Table 1 Quote sequence information
以cDNA为模板,PCR扩增PwHAP5基因CDS全长序列。反应体系如下:模板1 μL,2×Tap酶10 μL,上下游引物P1、P2各0.5 μL,ddH2O加8 μL。通过切胶回收目的片段。
1.2.2 pET-48b-PwHAP5原核表达载体的构建与鉴定通过BamH I和Hind Ⅲ将上述扩增的PwHAP5基因片段与表达载体pET-48b双酶切处理后再连接,导入大肠杆菌BL21,在LB培养基(含有50 μg /mL卡那霉素)活化与扩增,筛选出阳性菌落分别用于PCR检测和扩增培养进行质粒抽提。待扩增的阳性菌落需挑入上述LB液体培养基培养。经BamH I和HindⅢ对重组质粒pET-48b-PwHAP5进行双酶切鉴定后测序。
1.2.3 重组蛋白PwHAP5的诱导表达 将测序正确的阳性菌落接种入LB液体培养基(含有50 μg /mL卡那霉素),在37℃条件下培养至菌液OD600值为0.5-1.0,加入IPTG(终浓度为0.25 mmol/L)诱导蛋白表达。诱导时长设置有4、6、8、10 h共4个处理,之后取相同体积菌液离心收集沉淀,再加入适量PBS重悬菌体,通过SDS-PAGE检测PwHAP5融合蛋白表达情况。参考上述步骤,对离心温度和转速设置不同组合试验筛选最佳的转速和温度。
1.2.4 重组蛋白PwHAP5表达形式鉴定 当大肠杆菌菌液OD600值为0.5-1.0时,添加IPTG稀释菌液终浓度至5×10-4mol/L,在37℃条件下,培养8 h后离心收集菌落沉淀。此时加入NBB缓冲液(0.5 mol/L NaCl,50 mmol/L NaH2PO4,10 mmol/L 咪 唑,pH值为8.0)、蛋白酶抑制剂和溶菌酶混合重悬菌落沉淀。在冰上将菌体超声破碎,加入180 μL TritonX-100,继续在冰上振荡处理15 min,4℃离心收集澄清上清液和沉淀。
用NAA缓冲液重悬沉淀,按上述步骤离心保留沉淀备用。之后加入裂解液重悬,冰浴裂解包涵体1 h后,离心取上清液经由SDS-PAGE鉴定重组蛋白PwHAP5表达形式。
1.2.5 重组蛋白PwHAP5纯化 上述上清液经0.45 μm滤膜滤除杂质后,在含有琼脂糖亲和层的His-NTA纯化柱中与树脂混合,置于冰上振荡处理3 h。经Wash Buffer洗涤3次去除杂质,再用Elution Buffer洗脱3次,各组分需分开收集保存。取各离心管中蛋白样品进行SDS-PAGE电泳检测纯化效果。
1.2.6 重组蛋白PwHAP5兔多克隆抗体制备与鉴定
在抗体制备前需进行本底反应,排除试验动物血清背景对结果的干扰。从未进行免疫反应的兔子耳缘静脉抽取0.5 mL血液,提取的兔抗血清和AP标记山羊抗兔IgG(免疫球蛋白G)分别为一抗、二抗,重组蛋白PwHAP5作为抗原,用Western blot检测结果,选出符合试验要求的健康兔子。
通过对兔子皮下多点注射进行免疫反应。第一次注射的蛋白剂量为600 μg/只,蛋白液按1∶1比例与弗氏完全佐剂混合乳化;初次免疫后次日进行第二次注射,蛋白剂量为400 μg/只,蛋白液按1∶1比例与弗氏不完全佐剂混合乳化;之后分别在第35天和49天进行第3、4次免疫反应,免疫剂量和操作参考第2次免疫反应。
4次免疫试验结束后,在第10 天按上述相同步骤采血,间接ELISA法检测免疫试验后兔抗血清效价。重组蛋白PwHAP5稀释为2 μg/mL 的浓度,按照100 μL /孔的剂量加入酶标板中,置于4℃冰箱过夜处理,次日用PBST清洗3次,每次处理5 s。接着按每孔300 μL的剂量添加5%脱脂奶粉。之后在37℃条件下封闭2 h,以每孔100 μL的剂量往酶标板中加入按照1∶1 000、1∶3 000、1∶9 000、1∶27 000、1∶81 000、1∶243 000,1∶729 000倍数稀释的血清,37℃下孵育2 h后使用PBST清洗(参考上述步骤)。按100 μL/孔加带HRP标记山羊抗兔IgG(需按1∶10 000比例稀释),37℃条件下温育50 min后使用PBST清洗。在避光条件下,按100 μL /孔加TMB显色处理,5 min后每孔添加50 μL终止液(2 mol/L的H2SO4)停止反应。经ddH2O清洗后,使用酶标仪读取各孔中蛋白样品OD450值。检测效价达到试验要求后,次日穿刺心脏采集兔全血后提取抗血清。
1.2.7 抗体纯化 通过Protein A纯化抗体。兔抗血清经离心分离后取上清液经0.45 μm滤膜过滤后,按1∶1比例加入Binding Buffer缓冲液混合均匀上柱纯化,收集抗体穿流液重复上柱,再收集经由Eluting Buffer洗脱的样品,样品需通过SDS-PAGE检测重组蛋白PwHAP5兔多克隆抗体纯度。纯化后抗体需在PBS中保存,分别通过全自动蛋白定量检测仪、SDS-PAGE检测纯化后总IgG(免疫球蛋白G)的浓度和纯度。
1.2.8 Western blot检测评价抗体 制备的抗体经SDS-PAGE电泳处理后转移至硝酸纤维膜转膜处理80 min,电压和电流分别为100 V和400 A。在室温下用含5% BSA的TBST溶液(封闭液)处理蛋白膜,封闭处理2 h。用封闭液按1∶3 000比例稀释抗体后作为一抗保存于4℃冰箱过夜孵育,用TBST溶液洗膜。用封闭液按照1∶5 000的比例稀释含有AP标记的山羊抗兔IgG后作为二抗保存于室温孵育2 h,用TBST溶液洗膜。在室温进行NBT/BCIP显色反应检测PwHAP5兔多克隆抗体特异性。
1.2.9 花粉萌发实验 花粉培养时间设置有12、16、20、24 h,通过显微镜观察不同处理下花粉萌发情况、花粉管长度并记录。
1.2.10 PwHAP5兔多克隆抗体间接免疫荧光检测 Poly-Lysine包被载玻片制片前需清洗干净。将载玻片均匀涂上0.1%多聚-L-赖氨酸,此步骤不能有褶皱,室温晾干备用。载玻片和4%多聚甲醛都需要即做即用。
花粉经离心洗涤后用PBS溶液重悬(此步骤重复2次)。室温条件下,花粉重悬液细胞浓度调整为1×105个/mL,滴于载玻片预留位置,静置10 min后加入4%多聚甲醛,孵育2 h后去除并用PBS溶液清洗2次。使用PBS溶液(含0.2% Triton X-100)处理载玻片5 min,PBS溶液清洗5次。将载玻片放入PBS溶解的3%脱脂奶粉中,封闭1 h。
采用湿孵的方法,将PwHAP5兔多克隆抗体用PBS溶液(含1%脱脂奶粉)按1∶40比例进行稀释后,作为一抗孵育2 h。添加有FITC标记的1%脱脂奶粉用PBS溶液按1∶100比例稀释,孵育1 h。以上孵育步骤结束后需用PBS溶液清洗5次。通过共聚焦激光扫描显微镜观察一抗、二抗的结合情况。
2 结果
2.1 PwHAP5基因全长扩增及原核表达载体鉴定
如图1-A所示,以青杄花粉总RNA反转录的青杄cDNA为模板,PCR扩增PwHAP5全长,得到长约603 bp的条带,与理论分子量相符。
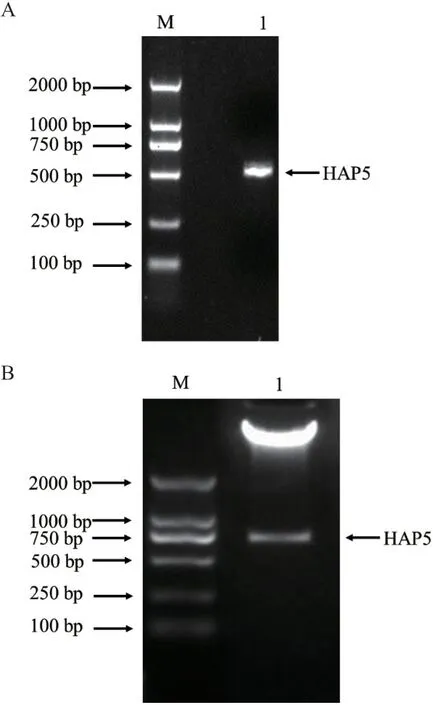
图1 PwHAP5基因片段的PCR扩增及重组质粒鉴定Fig. 1 PCR products of PwHAP5 and identification of the recombinant plasmid
重组质粒pET-48b-PwHAP5经BamH I和HindⅢ双酶切后,产物通过琼脂糖凝胶电泳检测,得到两条条带,大条带位置与pET-48b空载质粒吻合,小条带与PwHAP5大小相符。结果表明,原核表达载体pET-48b-PwHAP5构建成功。
2.2 目的蛋白表达形式与表达量鉴定
设置了不加IPTG诱导的对照组。超声波粉碎经IPTG诱导的大肠杆菌,分离上清液与沉淀物,分别进行SDS-PAGE检测。如图2-A可知,对照组中融合蛋白的表达并不明显,而经过IPTG诱导产生的蛋白明显多于其他分子量的蛋白,说明有大量重组蛋白表达。且在沉淀物中的蛋白表达量显著多于上清液的表达量,说明重组蛋白PwHAP5主要以包涵体形式表达。
经IPTG诱导的重组大肠杆菌,经离心温度和转速组合试验发现37℃、260 r/min的处理下重组蛋白表达量最高,以此作为最优条件培养,再对比不同时长处理下IPTG对蛋白表达量的诱导情况。如图2-B所示,蛋白产物经IPTG诱导明显增加,在4、6、8 h三种不同培养时长处理下均在45 kD有条带出现,且随着时长增加,产物表达量也在增加,在8 h处理时,蛋白产物表达量较高,说明在此条件下重组蛋白PwHAP5高效表达。
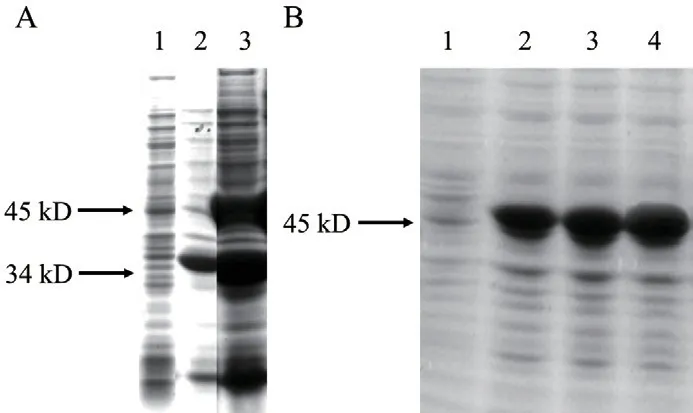
图2 目的蛋白PwHAP5表达形式和表达量鉴定Fig.2 Identification of expression form and expression amount of target protein PwHAP5
2.3 PwHAP5蛋白纯化
通过His-NTA镍柱纯化带有His标签的PwHAP5蛋白。由SDS-PAGE鉴定收集的多组份洗脱液成分。如图3-A所示,第3次洗脱处理后杂蛋白含量最低,重组蛋白条带清晰,浓度不低于1 mg/mL,由此可知第3次洗脱纯化效果最好。
2.4 未免疫兔血清本底反应
如图3-B所示,对多只未进行免疫反应的健康成年兔子血清进行Western blot检测。以兔血清为一抗,AP标记山羊抗兔IgG为二抗筛选出在45 kD位置无明显条带的两只兔子的血清,选定这两只兔子进行免疫试验。
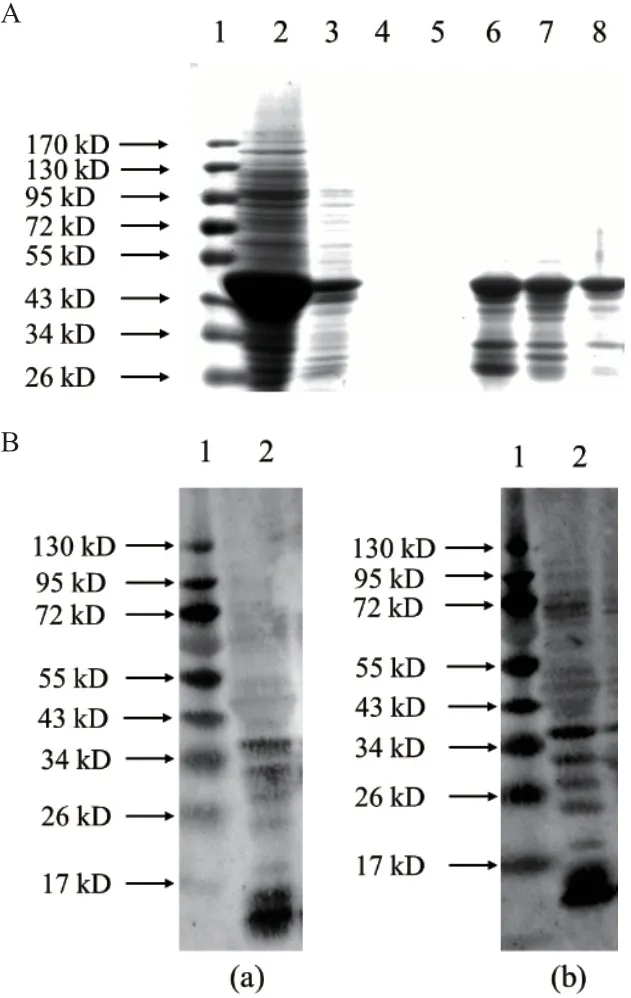
图3 纯化蛋白SDS-PAGE分析及未免疫兔血清的本底反应Fig.3 SDS-PAGE analysis of purified recombinant protein and Western blotting assay
2.5 抗体效价检测
实验组为PwHAP5多克隆抗体,对照组为未免疫兔血清。如图4所示,以P/N>2.1为参考标准[19],当血清按1∶729 000比例稀释时,实验组A450值为0.577,对照组A450为0.042,P/N>2.1,检测结果呈阳性。结果证明本试验制备的兔抗血清效价在1∶729 000以上,说明PwHAP5多克隆抗体具备较高的灵敏度。
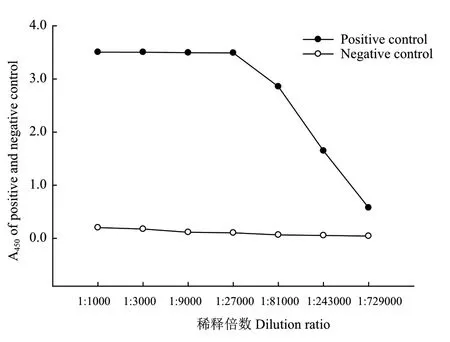
图4 间接ELISA法检测效价Fig.4 Detected titer of antibody detected by indirect ELISA
2.6 纯化后抗体的检测
兔抗血清经纯化后的体积为27 mL,测得总IgG量为50.49 mg,由此可知抗体浓度为1.87 mg/mL。如图5所示,由SDS-PAGE检测结果可知纯化后的抗体在45 kD位置出现单一清晰的条带,与目的蛋白分子量相符,说明抗体纯度高。

图5 纯化后抗体纯度检测Fig.5 Purity detection of purified antibody
2.7 抗体特异性检测
以不含目的蛋白的凝胶作为抗原,制备的兔抗血清作为对照组。如图6所示,以抗PwHAP5蛋白兔多克隆抗体为一抗,与AP标记的山羊抗兔IgG抗体杂交,在膜上45 kD位置出现条带,与重组蛋白PwHAP5大小相符。未经诱导的大肠杆菌菌体未出现条带,说明制备的PwHAP5多克隆抗体能够特异性识别PwHAP5蛋白。

图6 抗体特异性检测结果Fig. 6 Specificity of rabbit polyclonal antibody of PwHAP5
2.8 青杄花粉萌发试验
如图7-A所示,青杄花粉在培养至16 h时开始萌发,26 h的培养液污染情况严重。由此可知,18-26 h的培养时长适宜花粉管萌发,选用该处理下的花粉管作为间接免疫荧光试验材料。
2.9 抗体间接免疫荧光检测
预处理萌发的青杄花粉,在相同的处理条件下,设置不同的对照,PwHAP5兔多克隆抗体为一抗,带有FITC标记的1%脱脂奶粉(PBS溶解)作为二抗。如图7-B所示,a和d为未经一抗二抗处理的花粉管,花粉有微弱自发荧光,但不明显。b和e中以一抗处理花粉管,不加二抗,出现微弱的荧光信号,也不明显。c和f中同时添加了一抗二抗,可观察到图中荧光信号强烈,说明制备的抗体具有活性,可以结合FITC标记的二抗。
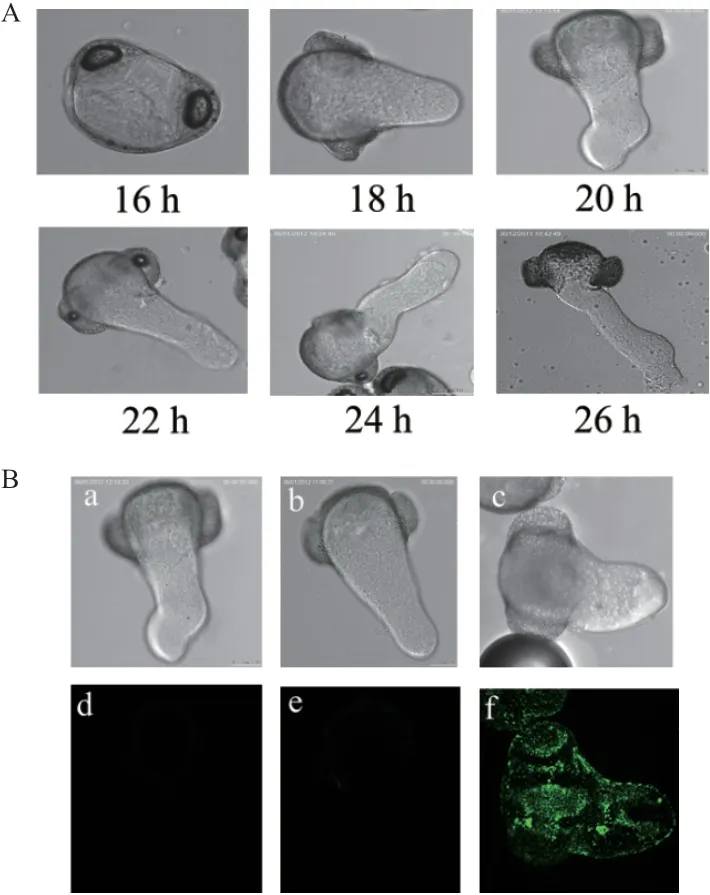
图7 花粉管萌发试验和间接免疫荧光检测Fig.7 Pollen tube germination test and indirect immunofluorescence assay
3 讨论
本研究克隆得到PwHAP5基因序列,并成功构建原核表达载体pET-48b-PwHAP5,经IPTG诱导重组蛋白PwHAP5表达。在诱导重组蛋白生成的过程中发现离心温度、转速、IPTG诱导时间等因素对蛋白表达量有影响,超声波处理时长、次数、IPTG浓度等步骤无显著影响。此外,大肠杆菌菌株活性会逐渐下降,为保证重组蛋白高效表达,大肠杆菌不宜存放太久。
青杄PwHAP5重组蛋白以包涵体的形式稳定高效地表达。由于包涵体的不溶性,需用缓冲液清洗去除杂质,经裂解液处理包涵体,离心收集到的上清液再纯化,可以有效提高目的蛋白的纯度。试验过程中为提高目的蛋白浓度,可适量减少Elution Buffer的用量。
本试验经SDS-PAGE检测纯化后的蛋白液,再通过切胶收集富含重组蛋白条带的方法,操作简单,回收效率高。且PAGE胶可起到缓慢释放抗原的作用,也可作为惰性载体,可确保蛋白纯度且免于在兔体内被降解或被免疫细胞吞噬[20]。制备的多克隆抗体经间接ELISA检测可知效价在1∶729 000以上,确认PwHAP5多克隆抗体具备良好的灵敏度。经Protein A柱子纯化的抗体通过Western blot检测可知能特异性识别抗原。
以青杄萌发的花粉为材料,进行间接免疫荧光实验检测PwHAP5蛋白在花粉管中的定位。结果显示,实验组的荧光信号强度发生明显变化,说明PwHAP5在青杄花粉中有表达,但不能确定具体位置,这可能是因为花粉壁表面吸附荧光染料造成干扰,这需要后续试验进一步验证。
目前HAP家族已经在多种植物中发现,以HAP2和HAP3亚基功能研究报道最多,其广泛参与到植物的生长发育、花期调控、非生物胁迫等多个过程[21-24]。为我们了解HAP家族在多种植物中的功能和作用提供了重要的信息和参考依据,如在青杄中HAP家族可能会参与花期调控、非生物胁迫等,指明今后PwHAP5基因的研究方向。但关于HAP5的研究较少,尤其缺乏HAP5亚基功能研究,其分子生物学机制尚未形成体系,还有很多亟须解决的问题。如青杄PwHAP5是否与拟南芥、水稻等植物的HAP家族具有相同的作用方式、功能之间的差异、在细胞中发挥的作用及作用的靶基因等方面都需要更深入的研究。免疫胶体金法是研究蛋白定位和功能的常见方法,制备和目的蛋白特异性结合的抗原是使用本方法的关键[25]。染色质免疫共沉淀方法也需要通过特异性结合的蛋白检测生物体内转录因子调控的下游靶基因[26]。本试验制备的PwHAP5多克隆抗体与目的蛋白杂交时有清晰的单一条带,证明抗体特异性强,可应用于染色质免疫共沉淀等技术。这对进行PwHAP5转录因子亚细胞定位和寻找下游作用靶基因,开展PwHAP5转录因子参与青杄生长发育和逆境胁迫响应等过程研究奠定基础。
4 结论
本试验通过克隆青杄目的基因PwHAP5与载体pET-48b相连构建原核表达载体pET-48b-PwHAP5,转入大肠杆菌后,经诱导产生目的蛋白PwHAP5。经Ni-His柱和树脂纯化后的重组蛋白作为抗原注射入兔子体内,制备抗重组蛋白PwHAP5兔血清,再通过Protein A纯化获得青杄PwHAP5多克隆抗体。制备的血清抗体效价可达1∶729 000,所制抗体纯度高、特异性良好。青杄PwHAP5多克隆抗体和二抗共同处理的花粉管荧光信号强烈,说明制备的抗体可以结合二抗,验证了PwHAP5在青杄花粉中有表达。