pOsHAK1:OsFLN2提高水稻的糖代谢水平和抗旱性
陈光 李佳 杜瑞英 王旭
(1. 广东省农业科学院农业质量标准与监测技术研究所,广州 510640;2. 中国水稻研究所,杭州 311401)
干旱造成的危害83%以上发生在农业领域,影响粮食供应和人民生活,已成为全球最严重的饥荒诱发因素[1]。水稻(Oryza sativaL .)是一种耗水量大的作物,对水分的需求使其极易遭受干旱胁迫,全球每年因干旱导致减产近1 800万t[2]。我国水资源条件无法支撑传统水稻的进一步发展,因此,创制抗旱水稻品种,可以缓解水稻生产中水资源的过度消耗,对保障粮食安全具有重要意义[3]。
植物的抗旱机制包括形态、生理适应和细胞调节等,在不同阶段受遗传因素控制。形态适应包括根系长度和生物量增加,蜡质或厚叶覆盖,叶重、叶形和表皮细胞减小,叶片衰老延缓以及绿叶面积增加。生理适应包括较高的气孔密度和导度,蒸腾速率降低,更优的生产、积累、同化以及营养器官的干物质分配。细胞调节需要提高叶绿素含量、收获指数和降低渗透势[4]。非还原二糖和寡糖等渗透调节物质的积累、光合效率的降低以及碳水化合物代谢的改变,在缓解胁迫中发挥重要作用[4]。光合产物主要以蔗糖的形式在体内长距离运输,既为组织代谢提供能量,又作为信号分子和渗透调节剂在有限的水分供应下防止器官损伤[5]。维持不同组织间的糖分稳态对逆境胁迫下植株的生长发育至关重要[6]。对C4-磷酸烯醇式丙酮酸羧化酶转基因株系的生理研究表明,蔗糖代谢影响水稻的抗旱性[7]。在干旱等非生物胁迫条件下增强海藻糖的生物合成可以显著提高水稻产量[8]。OsGolS2过表达水稻抗旱性的提高是体内棉子糖半乳糖苷系列寡糖的积累所致[9]。
本研究的目标,一是明确糖分代谢是否与水稻干旱胁迫响应有关;二是探讨在水分缺乏条件下,促进体内糖分代谢是否可以提高水稻的抗旱性。启动子和功能基因的确定基于前期研究结果,选择使用受干旱/渗透胁迫诱导上调表达的基因OsHAK1的启动子[10],驱动编码果糖激酶类似蛋白基因OsFLN2[11]在水稻中表达,发现干旱胁迫下,pHAK1:FLN2促进体内糖分的合成和运输,并显著提高植株的抗旱性。因此,将干旱诱导型基因启动子与糖代谢基因结合,是创造稳产、高抗种质有效的转基因策略。
1 材料与方法
1.1 材料
为了构建pHAK1:FLN2转基因水稻,以日本晴(Nipponbare)cDNA为模板扩增FLN2基因的编码序列(CDS,1 770 bp),纯化后用GBclonart无缝克隆试剂盒(苏州神洲基因有限公司)连接到经BamH I和SpeI双酶切的pTCK303线性载体上,获得中间载体pTCK303-FLN2;再以日本晴DNA为模板扩增OsHAK1的启动子(起始密码子上游3 037 bp),纯化后用同样方法连接到经Hind III和BamH I双酶切的pTCK303-FLN2线性载体上,获得最终载体pHAK1-FLN2。将该载体电转化到农杆菌EHA105中,并侵染日本晴愈伤,遗传转化方法详见Chen等[10]。T0-T2代转基因材料种植于广东省农业科学院农业质量标准与监测技术研究所广州大丰试验基地和中国水稻研究所杭州富阳试验基地的转基因苗圃。用水培营养液中加入15%(W/V)聚乙二醇(PEG)6000模拟干旱胁迫,选择两个生育期的水稻(1.苗期,2周苗龄;2.分蘖期,6周苗龄)分别处理7 d和10 d,记录表型、测定各项生理生化指标以及分析基因表达模式。实验在14 h光照(30℃)/10 h黑暗(25℃)光周期、相对湿度约70%的人工气候室进行,所有处理每隔2 d更换一次营养液,营养液组成和配制详见Chen等[12]。
1.2 方法
1.2.1 净光合速率(Pn)的测定 参照Chen等[13]的方法,利用Li-COR6400便携式光合仪(Li-COR,美国)测定上午9:00-11:00水稻叶片的净光合速率。
1.2.2 蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)活性测定 干旱处理后收获植株的叶片,液氮研磨成粉末,利用SPS试剂盒(苏州科铭生物技术有限公司)提取并参照Chen等[14]的方法进行测定。
1.2.3 蔗糖外运速率(rate of sucrose export,SER)的测定 参照Chen等[14]的EDTA法从源叶中收集韧皮部渗出液,叶片的切口端立即浸入20 mL 30 mmol/L EDTA溶液中(pH 7.0),黑暗中浸泡15 min。为了避免木质部渗出液的影响,弃去第一次的EDTA溶液,然后将叶片洗净,转移至10 mL 30 mmol/L EDTA溶液中,整个采集过程中,叶片置于高相对湿度的密闭暗室。4 h后,利用蔗糖试剂盒测定收集液中的蔗糖浓度。
1.2.4 蔗糖含量的测定 胁迫处理后收获植株的叶片和根系,液氮研磨成粉末,利用蔗糖试剂盒(苏州科铭生物技术有限公司)提取并参照Chen等[11]的方法进行测定。
1.2.5 实时荧光定量PCR(RT-qPCR) 参照Chen等[15]的步骤,分别提取正常和干旱处理下T1代转基因株系、不含目的片段的分离株系和野生型(WT)植株地上部以及T2代纯合株系和WT植株叶片的RNA。水稻UBQ5(LOC_Os01g22490)为内参基因,参照Chen等[16]的算法确定相对表达丰度,引物序列见表1。

表1 荧光定量PCR所用引物Table 1 Primers used for RT-qPCR assays
1.2.6 根长和根表面积的测定 参照Chen等[17]的方法,利用根系分析仪(WinRhizoV4.0b,Regent Instrument公司,加拿大)扫描不同处理的根系,记录总根长和根表面积。每个处理每个株系测量5个单株。
1.2.7 相对含水量和失水率的测定 相对含水量(RWC)的测定方法参照Chen等[17]:胁迫结束后将植株叶片离体称重,记录鲜重(FW),将这些叶片用去离子水浸泡4 h,测定其饱和重量(SW),叶片80℃烘干48 h,确定干重(DW),RWC按公式计算:RWC(%)=(FW-DW)/(SW-DW)×100%。参照Chen等[17]的方法测定离体叶片失水率。将苗期WT和转基因植株叶片剪碎称重,然后在室温下暴露于空气中,在指定时间点称重后计算。
1.2.8 电解质渗透率的测定 电解质渗漏分析参照Chen等[18]的方法进行:新鲜的叶片收获后用去离子水清洗以去除表面附着的离子,之后立即放入装有30 mL去离子水的烧杯中,将烧杯置于25℃,120 r/min振荡3 h,用电导率仪(EC215,Hanna,意大利)测定浸泡液的电导率(EC1)。然后将浸入溶液的样品在100℃下煮沸20 min,冷却至室温后测量溶液的电导率(EC2)。相对电解质渗透率(REL)按公式计算:REL(%)=EC1/EC2×100%。
1.2.9 脯氨酸含量的测定 参照Chen等[18]的方法测定叶片中的脯氨酸的含量:取叶片约0.5 g,用5 mL 3%磺基水杨酸匀浆,12 000×g离心10 min,取1 mL上清液与1 mL酸性茚三酮和1 mL冰乙酸混合,100℃孵育1 h,在冰浴中终止反应,用2 mL甲苯萃取显色,用酶标仪(SpectraMax M5,Molecular Devices公司,美国)在520 nm处测定吸光度。
2 结果
2.1 干旱胁迫影响水稻糖分代谢
15% PEG处理后,水稻体内糖分代谢发生显著变化,叶片的净光合速率、SPS活性和蔗糖外运速率分别降低31%、24%和39%(图1-A-C)。干旱显著抑制蔗糖从源到库的转运,表现为胁迫下叶片中蔗糖含量增加40%,而根中却减少25%(图1-D-E)。

图1 干旱胁迫对水稻糖分代谢的影响Fig. 1 Effects of drought stress on sugar metabolism in rice
2.2 构建pHAK1:FLN2转基因水稻
基于干旱诱导水稻糖代谢发生变化的研究现象,通过pHAK1:FLN2转基因株系与WT之间干旱胁迫响应的差异分析,验证促进糖分的合成和运输是否可以提高水稻的抗旱性。利用GUS染色鉴定阳性植株,T0代共获得24个独立的转基因株系(图2)。

图2 表达载体的构建及水稻遗传转化过程Fig. 2 Construction of expression vector and process of genetic transformation in rice
选择5个T1代阳性株系及其相应的不含目的片段的分离株系(null segregant,NS)分析FLN2的表达量和净光合速率,发现在正常和干旱条件下,NS和WT均没有差异;在WT和NS的地上部,干旱抑制FLN2的表达,但在转基因植株中,FLN2的表达量增加1-2倍(图3-A);与此同时,净光合速率的下降幅度显著低于WT和NS(图3-B),因此在T2代的水培试验中,选择GUS染色全部阳性的两个纯合pHAK1:FLN2株系并以WT作为唯一的阴性对照。

图3 干旱胁迫下T1代pHAK1:FLN2转基因株系与WT的FLN2表达量和净光合速率差异分析Fig. 3 Differential analysis of FLN2 expression and net photosynthetic rate between T1 generation of pHAK1:FLN2 transgenic lines and WT in response to drought stress
2.3 pHAK1:FLN2对水稻苗期生长的影响
在正常和含15% PEG的水稻营养液中培养WT和T2代pHAK1:FLN2纯合转基因株系,评估pHAK1:FLN2的表达如何影响水稻生长。如图4所示,在正常营养液中生长时,转基因植株与WT的生长没有差异,地上部和根系生物量相似。将幼苗置于干旱胁迫下,WT植株叶片严重萎蔫,而转基因植株的失水表型明显减轻,此外,干旱对转基因植株地上部和根系生长的抑制程度显著低于WT,导致胁迫下地上部干重高于WT 15%-17%,根系干重高于WT 13%-20%(图4-B,C)。

图4 干旱胁迫下pHAK1:FLN2转基因株系与WT的苗期生长差异分析Fig. 4 Seedling growth of pHAK1:FLN2 transgenic lines compared with WT in response to drought stress
2.4 pHAK1:FLN2对水稻体内糖代谢的影响
对WT和pHAK1:FLN2转基因植株体内的糖代谢水平进行分析比较,以验证转基因株系是否通过维持糖分稳态来提高水稻的抗旱性。糖分合成关键酶SPS的活性在对照条件下,WT和转基因植株没有显著差异(图5-A),在PEG处理下,WT的SPS活性只有转基因株系的87%(图5-A)。pHAK1:FLN2的表达在干旱胁迫下显著提高糖分从源到库的转运,具体表现为转基因株系叶片的蔗糖外运速率高于WT 25%-37%,叶片中的蔗糖含量比WT低6%-13%,而根中的蔗糖含量比WT高7%-10%(图5-B-D)。

图5 干旱胁迫下pHAK1:FLN2转基因株系与WT的糖代谢差异分析Fig. 5 Differential analysis of sugar metabolism between pHAK1:FLN2 transgenic lines and WT in response to drought stress
2.5 pHAK1:FLN2对水稻根系构型的影响
根系构型影响干旱条件下水分的高效获取,进一步明确pHAK1:FLN2转基因植株与WT根系对干旱的响应是否存在差异。如图6所示,PEG处理显著降低植株的总根长和根表面积,但对WT根的影响相对较强,导致受胁迫转基因株系的总根长高于WT 16%-21%,根表面积高于WT 9%-13%。

图6 干旱胁迫下pHAK1:FLN2转基因株系与WT的根系构型差异分析Fig. 6 Differential analysis of root system architecture between pHAK1:FLN2 transgenic lines and WT in response to drought stress
2.6 pHAK1:FLN2对水稻持水能力和脂质过氧化程度的影响
干旱胁迫下,与对照相比,WT和转基因株系的相对含水量均降低,但转基因植株的相对含水量显著高于WT(图7-A),可能归因于植株的失水率不同,即WT离体叶片失水的速度快于转基因株系(图7-B),这些结果表明pHAK1:FLN2的表达提高水稻的保水能力。
在正常生长条件下,WT和转基因水稻植株具有相似的电解质渗透率和脯氨酸含量,但在干旱处理后,转基因株系的电解质渗透率只有WT的74%-81%(图7-C),而脯氨酸含量高于WT 29%-33%(图7-D)。综上,pHAK1:FLN2转基因株系抗旱性的提高可能是由于植株较强的保水能力、较少的电解质外渗以及较多的脯氨酸积累。
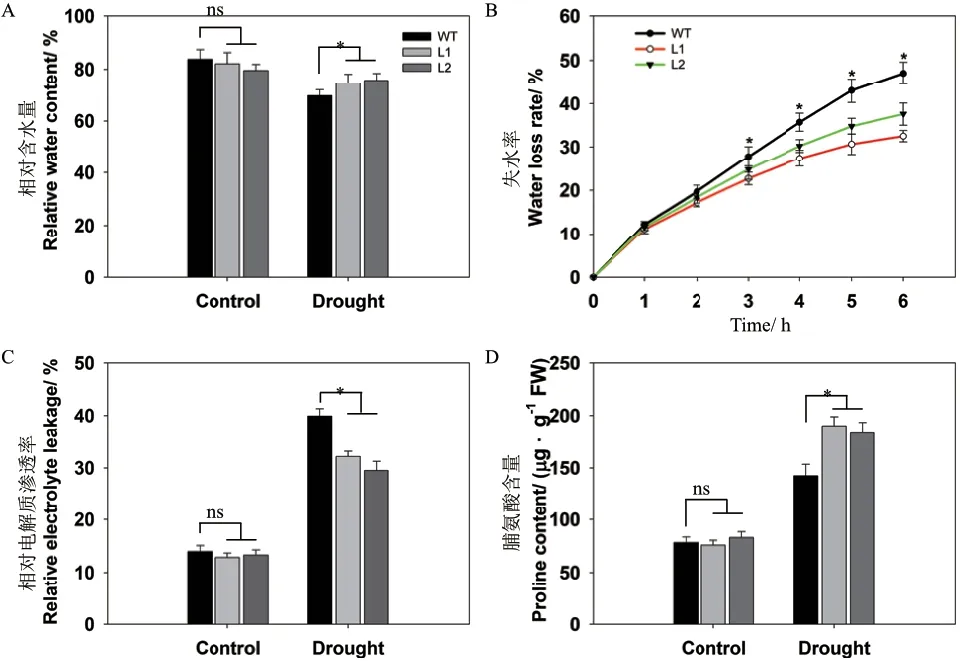
图7 干旱胁迫下pHAK1:FLN2转基因株系与WT的保水能力和脂质过氧化程度差异分析Fig. 7 Differential analysis of water-content ability and lipid peroxidation between pHAK1:FLN2 transgenic lines and WT in response to drought stress
2.7 pHAK1:FLN2对衰老、胁迫响应基因表达的影响
为进一步明确pHAK1:FLN2的表达提高水稻抗旱性的机制,对正常和干旱条件下生长的WT和转基因株系进行基因表达差异分析。所选基因分为两类,SGR和ATG8a属于衰老指示基因,SNAC1和MYB2是胁迫响应基因。正常条件下检测到所选基因相对较弱的表达,并且在WT和转基因植株中的差异不明显(图8)。胁迫处理后,基因的表达量相较于对照植株均显著提高,衰老指示基因在pHAK1:FLN2植株中的上调幅度低于WT,导致SGR表达量只有WT的56%-63%,ATG8a表达量只有WT的66%-74%(图8-A,B);而胁迫响应基因在转基因株系中的上调幅度高于WT,导致SNAC1表达量是WT的1.35-1.61倍,MYB2表 达 量 是WT的1.31-1.47倍(图8-C,D)。这些结果表明,抑制干旱诱导的衰老指示基因和促进胁迫响应基因的上调表达,是pHAK1:FLN2转基因株系抗旱性提高的重要原因之一。
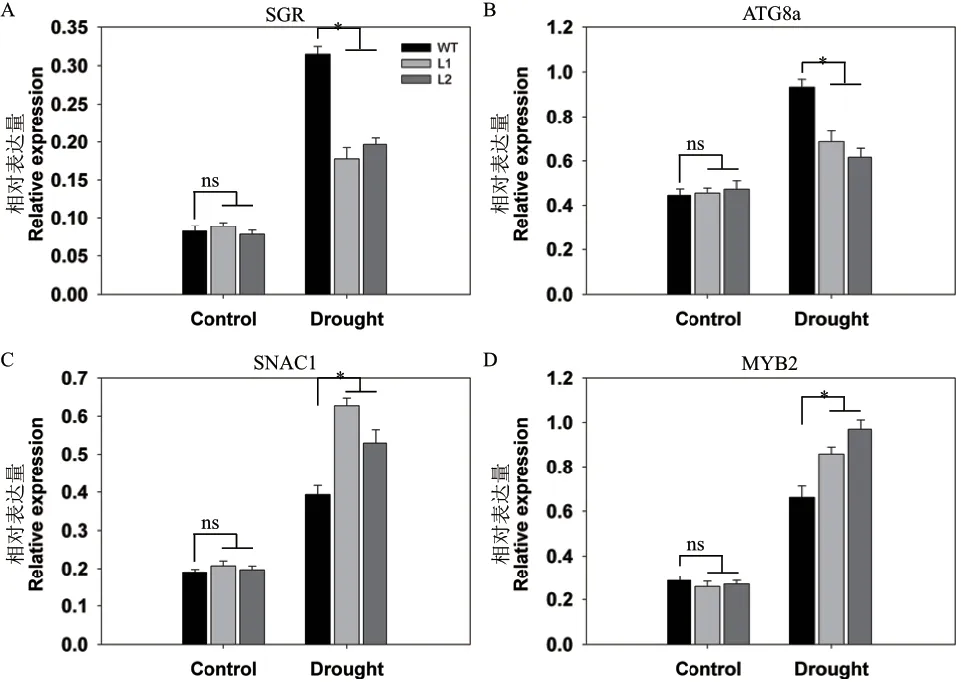
图8 干旱胁迫下pHAK1:FLN2转基因株系与WT中衰老和胁迫响应相关基因的表达差异分析Fig. 8 Differential analysis of expressions of senescenceassociated genes and stress-responsive genes between pHAK1:FLN2 transgenic lines and WT in response to drought stress
3 讨论
通过在正常营养液中加入15% PEG模拟干旱胁迫处理水稻,体内糖代谢发生显著变化,具体表现为糖合成受抑制(净光合速率和SPS活性降低)以及糖转运受阻(蔗糖外运速率和根系蔗糖含量减少),此结果与前人报道的相似,即干旱逆境下植物有限的光合作用附以能量需求和渗透调节的改变,影响光合产物在源和库组织之间的运输和分配[19-20]。基于此,我们提出通过促进干旱胁迫下的糖代谢来提高水稻抗旱性的实验假设,采取构建表达载体并遗传转化水稻的方式进行验证。鉴于组成型过表达功能基因常常导致不利的生长发育表型,而诱导型启动子可以有效避免这一问题[12,17],我们选择已经明确渗透/干旱响应关键区段的OsHAK1启动子[10]。糖代谢相关基因选择研究组前期克隆的FLN2,该基因编码pfkB家族中的果糖激酶类似蛋白,影响水稻前质体和叶绿体的发育,并且促进糖分的合成和运输,提高水稻的耐盐性[11]。与预期一致,pHAK1:FLN2转基因株系在对照条件下正常生长,没有出现不利的表型,而PEG处理后,糖代谢指标Pn、SPS、SER均显著高于WT,这与FLN2在干旱胁迫下的诱导表达密切相关,并且在T1代和T2代稳定遗传。
研究表明,pHAK1:FLN2转基因植株的耐旱性显著提高,可能是形态、生理和分子水平上变化的综合结果。首先,pHAK1:FLN2转基因植株产生更繁茂的根系,在形态水平上有助于抗逆性的改善。根系的大小和构型决定植物获得水分和养分的能力,是许多农业生态系统中限制生长和产量的关键因素,因此,根系构型优化与抗旱性呈正相关关系[21]。许多转录因子可以通过改变根系构型来提高植物的耐受性[22-23]。pHAK1:FLN2的表达,促进水稻根系生长,在干旱胁迫下,pHAK1:FLN2转基因植株根系的生物量、总根长和根表面积均显著高于WT,这可能与作为营养物质的蔗糖在库器官的含量有关。
pHAK1:FLN2引起的第二个重要变化是渗透调节物质积累量增加,有助于提高转基因植株的抗逆性。非生物胁迫可以改变韧皮部汁液中蔗糖的浓度,有助于植物抵御逆境[5],此外,可溶性糖也会在干旱胁迫的马铃薯库叶中积累[24],与这些报道一致,转基因植株中蔗糖外运速率和根系蔗糖含量与WT相比均显著增加。脯氨酸是一种渗透保护剂,与渗透调节和膜在干旱胁迫下的稳定性有关[25]。在本研究中,PEG处理后pHAK1:FLN2转基因株系脯氨酸含量显著高于WT。脯氨酸含量的增加会导致渗透势升高,从而降低水势,使植物更有效地保持水分[26],与之相似,转基因株系的叶片比WT具有更高的相对含水量和更低的失水率。鉴于脯氨酸可以作为抗氧化剂来减少胁迫过程中的氧化损伤[27],因此,干旱胁迫下,pHAK1:FLN2的表达导致较高的脯氨酸含量在一定程度上有助于降低电解质渗透率,表明干旱引起的转基因植株脂质过氧化程度低于WT。
第三,RT-qPCR分析显示基因表达差异与转基因植株的抗逆表型之间存在相关性。干旱胁迫诱导的早衰会引起水稻性状发生一系列变化,分蘖、叶片伸展和光合作用因早衰而受抑制[4]。衰老诱导的SGR基因在调控叶绿素降解中起重要作用[28]。自噬与植物衰老相关,是降解和转运大分子的主要机制[29],水稻自噬基因OsATG8a在叶片衰老过程中表达量增加[30]。SGR和OsATG8a在转基因株系中受干旱诱导增强表达的趋势显著低于WT,表明pHAK1:FLN2的表达减缓PEG处理引发的叶片衰老。许多研究表明,胁迫/ABA响应基因的诱导表达,增强植物对各种胁迫的耐受性[25,31]。本研究中,与干旱处理后的WT相比,转基因植株中2个胁迫相关基因的受诱导程度更为明显。SNAC1显著提高转基因水稻在营养和生殖生长期的抗旱性[32]。OsMYB2编码一个胁迫响应MYB转录因子,对水稻盐、冷、干旱逆境的耐受性起调控作用[33]。因此,这些基因的诱导表达可能是pHAK1:FLN2转基因株系抗旱性提高的另一重要原因。
4 结论
干旱抑制水稻体内糖分的合成和运输,利用干旱诱导型基因OsHAK1的启动子驱动FLN2的表达,可以改善胁迫下的糖代谢水平,进而提高水稻的抗旱性。