3.74 μm远红外激光致小鼠角膜损伤修复观察
尹贻雪,焦路光,王嘉睿,王 超,任子淇,赵乙珑,郑 红,杨在富*
(1. 安徽医科大学基础医学院,合肥 230032;2. 军事科学院军事医学研究院辐射医学研究所,北京 100039)
处于大气传输窗口的3~5 μm远红外激光在分子光谱学[1]、环境遥感[2]、红外光电对抗[3]等领域有重要的应用价值。近年来,随着红外光参量振荡器(optical parametric oscillator,OPO)技术的发展[4-7],该波段的激光器已经实现小型化和较高功率输出,极大地促进了该光谱区段的开发和应用,但其对人身健康的危害也应引起足够重视。人眼是激光损伤最重要的靶器官。红外(0.7 μm~1.0 mm)激光具有强烈的“水吸收”作用[8],人眼受到该波段激光照射时,辐射能量主要被含水量丰富的角膜组织吸收,通过热效应造成角膜损伤[9]。角膜被红外激光损伤后可造成混浊、瘢痕、不透明甚至失明,危害严重,是近年来激光损伤防护研究的重要方向[10-12]。以往的红外激光角膜损伤研究主要集中在近红外(0.7~1.4 μm)和中红外(1.4~3.0 μm)波段,包括波长1.315 μm的氧碘化学激光(chemical oxygen-iodine laser, COIL)[13]、波长1.319 μm的钇铝石榴石晶体(yttrium aluminium garnet,YAG)激光[14-16]、波长1.338 μm的YAG激光[10]、波长1.54 μm的铒(erbium,Er)激光[17-19]、波长2.0 μm的铥(thulium,Tm)激光[20-22]、波长2.94 μm的自由电子激光 (free electron laser,FEL)[23]等。远红外波段(3 μm~1 mm)激光角膜损伤的研究主要集中在波长为10.6 μm的CO2激光上[24]。目前,3~5 μm波段激光角膜损伤的研究尚未见报道。我们前期通过试验研究确定出了处于该波段的3.74 μm激光兔角膜损伤阈值[25]。本文在前期研究的基础上,构建3.74 μm激光小鼠角膜损伤模型,观察激光角膜损伤特点和损伤修复过程,为激光角膜损伤危害评价和损伤治疗研究提供试验依据。
1 材料与方法
1.1 试验对象
C57BL/6J小鼠(Mus musculus)30 只,6~8 周龄,体重25~30 g,雌雄不限,由北京斯贝福实验动物养殖中心提供,在军事医学研究院实验动物中心饲养。经裂隙灯显微镜和检眼镜检查,小鼠眼屈光介质和眼底均正常。
1.2 仪器
远红外激光器由国防科技大学提供,波长为3.74 μm。采用光参量振荡技术,输出激光中包含1.06、1.50和3.74 μm三个波长,发射方式为连续输出。滤除1.06和1.50 μm激光,保留3.74 μm激光,其最大功率为12.8 W。
1.3 光路搭建
3.74 μm激光依次经过楔形分束片、凸透镜、快门、反射镜后垂直入射到小鼠角膜,光路中所有光学元件均为适合于远红外透射传输的CaF2材质。楔形角为8o的楔形分束片分出的部分激光,照射到激光功率计1(power meter 1,PM1)上,用于监测激光照射过程中的功率。另一个激光功率计2(power meter 2,PM2)测量到达小鼠角膜处的激光功率。焦距为500 mm的凸透镜用于改变光束直径,调节角膜光斑大小,凸透镜与小鼠眼角膜间的距离为28.3 cm,此处光斑直径为2 mm。机械快门控制曝光时间为0.8 s。两个低功率的655 nm激光笔发射的激光束交叉点与3.74 μm激光光斑中心重合,用于精确指示小鼠角膜位置。试验前先测出PM2与PM1读数的比值即监视比,角膜照射时撤掉PM2,根据PM1读数和监视比计算出实际辐射功率。通过调整激光器驱动电流,激光照射角膜的功率可自由改变。
1.4 构建小鼠角膜激光损伤模型
试验前30 min,30 只C57BL/6J小鼠采用5%水合氯醛(750 mg/kg)腹腔注射全身麻醉,然后用盐酸奥布卡因滴眼液表面麻醉。将小鼠固定在升降台上,微调小鼠眼的位置和角度使激光束照射角膜中心。根据本研究前期试验结果[23],光照时间为1.0 s、光斑直径为1.5 mm的条件下,3.74 μm远红外激光致兔角膜损伤阈值为7.91 J/cm2。依据该数据,预试验分别用大约2 倍、3 倍、4 倍阈值剂量激光照射小鼠角膜,每个照射剂量1 只小鼠,摸索可导致热凝固损伤但不会发生角膜缺损或穿孔(中度损伤)的激光照射条件,得出能量密度为23.2 J/cm2,对应的激光照射功率为0.91 W。正式试验时,每只眼仅照射一个光斑,照射位置尽量靠近角膜中心。对照组为3只小鼠,试验组为照后3 h、6 h、12 h、1 d、3 d、7 d、14 d、21 d等8个时间点,每个时间点3只小鼠。
1.5 大体观察
在激光损伤后各观察时间点,肉眼或借助放大镜观察小鼠角膜损伤斑情况,用数码相机拍照记录。
1.6 裂隙灯显微镜观察
在激光损伤后各观察时间点,用TOPCON裂隙灯显微镜观察小鼠角膜损伤情况,观察方法包括大光斑斜照法以及窄裂隙照明法,评估角膜混浊程度、损伤深度,并拍照记录。
1.7 光学相干断层扫描(optical coherence tomography, OCT)
在激光损伤后各观察时间点,采用光学相干断层扫描仪(Cirrus HD-OCT 5000)对小鼠角膜损伤区进行断层扫描,并进行拍照记录。用Cirrus HD-OCT系统自带标尺测量损伤中心的角膜厚度,用于统计分析。
1.8 组织病理观察
在激光损伤后各观察时间点,颈椎脱臼处死小鼠,摘取眼球,快速置入甲醛-乙酸固定液(10%中性甲醛80 mL,乙酸20 mL)固定24 h[26],固定后标本经梯度酒精脱水,二甲苯使之透明,石蜡包埋后制作4 μm切片,苏木精-伊红染色(hematoxylin-eosin staining,HE),中性树脂封片,光学显微镜下进行病理切片的观察和拍照。
1.9 统计分析
使用SPSSv23.0统计软件包对Cirrus HD-OCT测得的损伤中心角膜厚度进行统计分析,数据以平均值±标准差(±s)表示,采用Student’sttest比较损伤后各个时间点与损伤前厚度是否有显著性差异。
2 结果与分析
2.1 大体观察
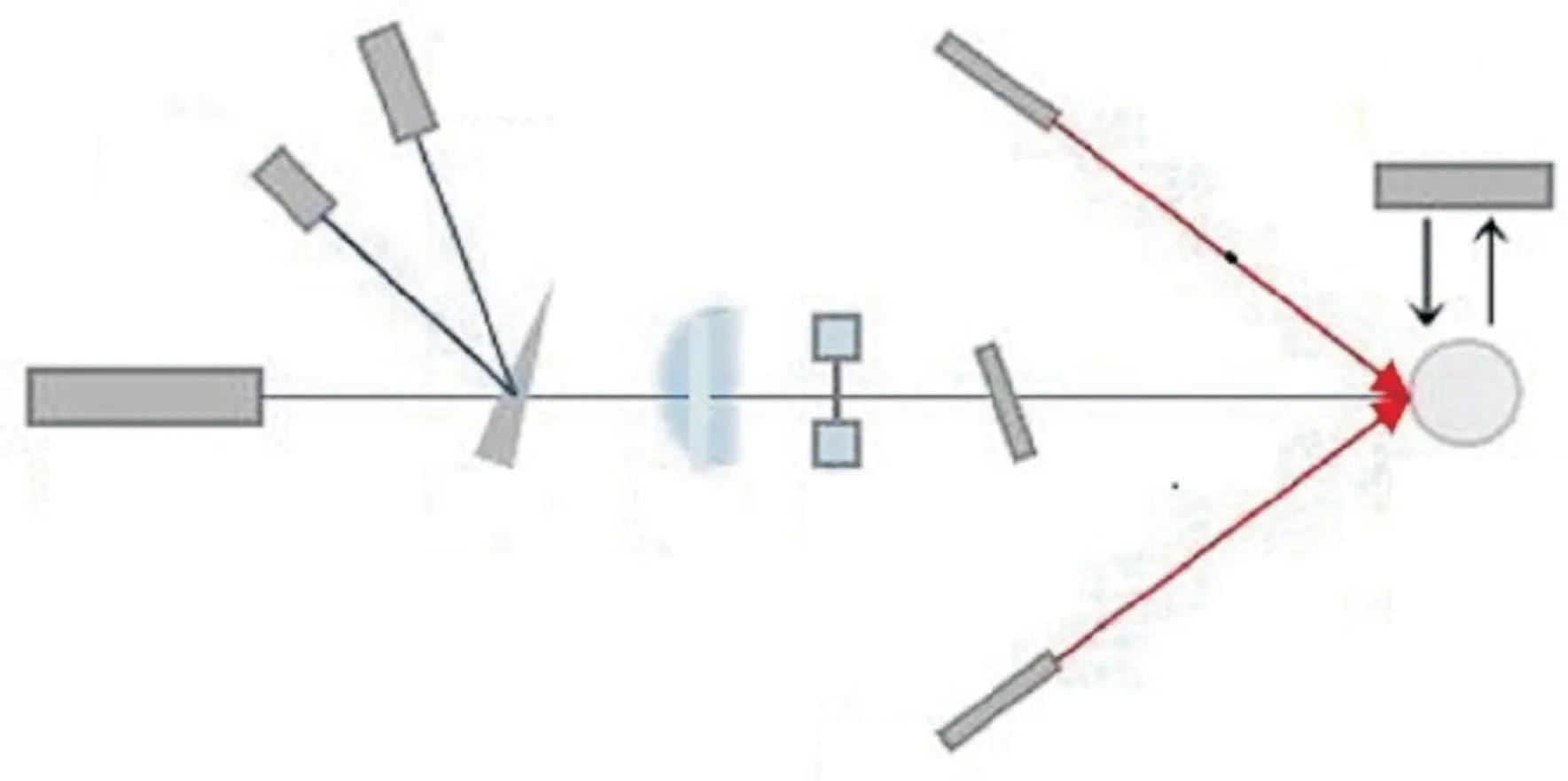
图1 3.74 μm远红外激光致小鼠角膜损伤光路示意图Fig. 1 Schematic drawing of 3.74 μm laser set up for the mice corneal exposure
如图2所示,C57BL/6J小鼠正常角膜表面光滑,清澈透明。3.74 μm远红外激光所致角膜损伤即刻可见为灰白色凝固斑,损伤后3~12 h角膜表面凹凸不平,角膜混浊程度随时间逐渐加重,1 d时最重,3~7 d逐渐减轻,14 d再次加重,21 d角膜仍不透明,未恢复正常。另外,激光损伤后12 h可见上下眼睑肿胀和分泌物增多,1 d时症状最为明显,其后逐渐消退。

图2 3.74 μm远红外激光损伤角膜后损伤斑的变化Fig. 2 Corneal lesions under digital camera after 3.74 μm laser irradiation
2.2 裂隙灯显微镜观察
大光斑斜照法观察(图3a)正常角膜透明度高,其后方的虹膜和瞳孔清晰可见。3.74 μm远红外激光损伤后,角膜混浊非常明显,后方虹膜和瞳孔被遮挡不可分辨,角膜混浊随时间的变化特性与大体观察一致。损伤后6 h混浊区扩展至损伤斑周边,1 d时混浊面积达到顶峰,3~7 d混浊面积明显减小,14 d混浊再次加重,21 d角膜未恢复正常。
窄裂隙照明法观察发现(图3b):正常角膜光散射弱,为厚薄均匀的淡灰白色条带,虹膜清晰可见;角膜受损后光散射显著增强,为亮白色条带,损伤累及角膜全层,损伤区角膜增厚,虹膜模糊;白色条带随时间先增强后减弱,1 d时条带最显著,21 d时角膜厚薄仍不均匀,未恢复正常。
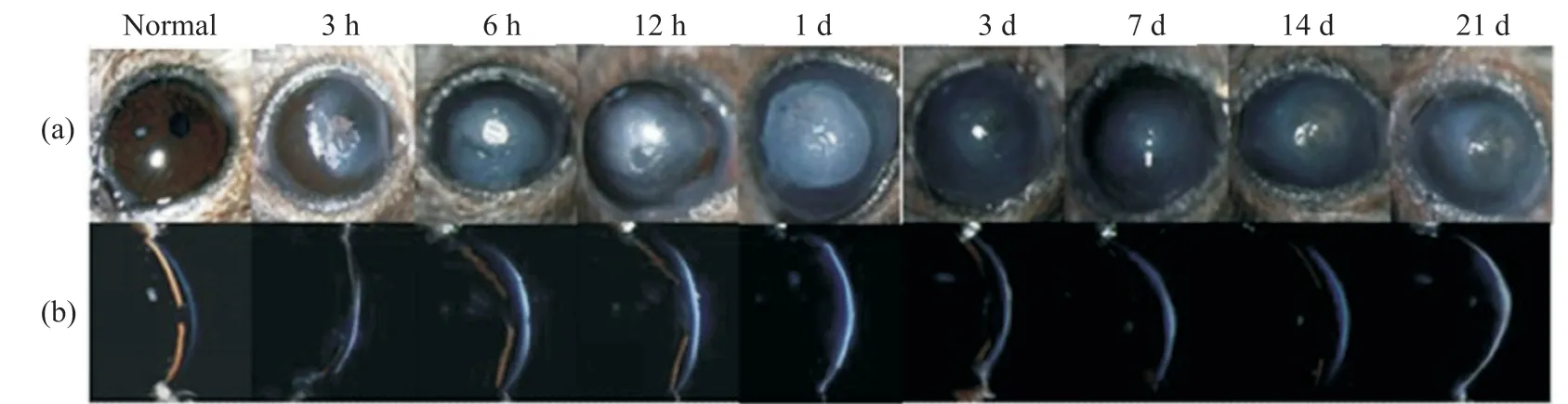
图3 裂隙灯显微镜观察3.74 μm远红外激光损伤角膜后损伤斑的变化Fig. 3 Corneal lesions under slit lamp microscope after 3.74 μm laser exposure
2.3 OCT观察
OCT观察正常角膜为亮度均匀的高反射光带。3.74 μm激光损伤后,损伤区角膜反射光带增强,角膜凸起明显;反射光带增强区域随时间先扩大后逐渐缩小,1 d时反射光带增强区域达到最大,21 d时角膜损伤区反射光带仍较强,未恢复正常(图4)。此外,损伤后6 h~1 d可观察到虹膜与角膜黏连(但无法判断虹膜是否与晶状体黏连)。

图4 OCT观察3.74 μm远红外激光损伤角膜后的损伤区的变化Fig. 4 Corneal lesions under OCT after 3.74 μm laser exposure
激光损伤引起角膜肿胀,角膜厚度随时间先增大后减小,12 h时最厚,达(218.30±8.18)μm,约为正常角膜厚度的2 倍;21 d角膜厚度基本恢复正常(图5)。

图5 3.74 μm远红外激光损伤后角膜厚度的变化Fig. 5 The thickness of corneal after injury induced by 3.74 μm laser
2.4 组织病理观察
HE染色观察发现:正常小鼠角膜组织结构清晰,上皮层由4~5 层上皮细胞构成,排列规整;基质层纤维规则排列,包含梭形基质细胞;内皮层为单层内皮细胞均匀分布。3.74 μm激光致C57BL/6J小鼠角膜损伤后3 h,上皮细胞核固缩深染,成拉伸状,基质细胞核染色质大部分脱失,仅有少量残存,内皮细胞完全脱落;6 h上皮细胞核染色变淡,基质细胞核染色质消失,出现无核区,后表面平整;12 h上皮层不再平整,出现皱褶,上皮细胞核染色消失,基质层出现浸润细胞,基质后表面皱褶弯曲;1 d坏死上皮脱落,1~2 层新生上皮细胞完全覆盖损伤区,细胞排列不规则,基质层浸润细胞增多,基质后表面出现零星椭圆形核的内皮细胞;3 d上皮层细胞增多,出现单层扁平上皮,表面恢复平整,基质层浸润细胞进一步增多,且多集中在深层,内皮层椭圆形内皮细胞增多;7 d新生上皮增加到3~4 层细胞,大量细胞呈空泡状,基质浸润细胞多集中在浅层,扁平内皮细胞呈单层分布,恢复平整;14 d 上皮层有少量空泡细胞,排列趋向规整,基质层浸润细胞减少;21 d上皮层基本恢复正常,厚薄均匀,由4~5 层排列规整的上皮细胞构成,单层内皮细胞均匀分布,铺满内皮层,基质层浸润细胞进一步减少,基质层出现空隙,基质纤维排列仍不规则,未恢复正常(图6)。

图6 3.74 μm中红外激光照射角膜损伤病理切片Fig. 6 Corneal histological sections after 3.74 μm laser exposure
组织病理显示:损伤后6 h虹膜与角膜黏连;12 h虹膜组织碎裂,部分与角膜黏连,部分与晶状体黏连;1 d可见虹膜与角膜缘黏连,偶见与晶状体黏连(图7),说明虹膜也已经受损。上述虹膜与角膜黏连的特征与OCT观察结果一致。

图7 3.74 μm远红外激光致角膜损伤后组织黏连的病理切片Fig. 7 Iris adhesion to the cornea or lens revealed by histological sections after 3.74 μm laser exposure
3 讨论
本研究中,我们构建了3.74 μm远红外激光致C57BL/6J小鼠角膜热凝固损伤模型,损伤累及小鼠角膜全层,损伤后角膜肿胀增厚,混浊随时间加重,随着受损上皮细胞脱落以及水肿消退,角膜变薄,混浊减轻。新生上皮细胞迁移覆盖损伤区,先形成1~2 层细胞组成的薄层上皮,然后逐渐增厚形成接近完整的正常上皮;基质层受损基质细胞核染色质消失,出现浸润细胞,其自房水途经受损内皮进入基质深层,进而迁移至基质浅层。21 d浸润细胞退去,基质层胶原纤维未恢复正常结构;受损内皮细胞脱落,新生内皮细胞迁移覆盖损伤区,形成均匀分布的单层扁平结构。
与本试验中3 倍阈值剂量造成小鼠角膜全层损伤特征不同,该激光致新西兰白兔角膜阈值损伤研究的观察只持续到24 h。在阈值水平损伤仅累及角膜上皮层,损伤后上皮坏死脱落,24 h上皮层即可恢复正常[25]。2 倍阈值剂量的损伤累及角膜上皮层和浅层基质,损伤后6 h上皮坏死脱落,浅层基质细胞核染色质大部分脱失;24 h可见上皮层基本恢复正常,浅层基质细胞核染色质消失,未恢复正常[25]。本试验眼损伤明显偏重,原因一方面是激光照射剂量高,另一方面是小鼠角膜厚度低。
就动物模型的选择上,角膜损伤阈值研究多以兔作为动物模型[13-24],而角膜损伤修复研究则多以小鼠作为动物模型[27-29]。3~4月龄兔角膜厚度在350~380 μm[30],而6~8 周龄C57BL/6J小鼠的角膜厚度为85~95 μm[31]。3.74 μm激光在1.97 倍损伤阈值条件下损伤累及兔角膜上皮层和基质浅层,损伤深度约是兔角膜厚度的一半[25];按损伤深度推断,本试验所用照射剂量不仅能损伤小鼠角膜全层,还包括角膜后组织。因此,在损伤修复中观察到虹膜与角膜黏连,或者虹膜与晶状体黏连的现象。总之,本研究通过观察3.74 μm远红外激光在23.2 J/cm2的剂量下致小鼠角膜损伤后的修复过程,为红外激光角膜损伤修复研究提供了试验依据。

