核黄素对IL-17A-/-氟中毒小鼠肾脏纤维化的影响
程陈凯,杨 威,李 想,杨 婕,王俊东,张建海
(山西农业大学动物医学学院,太谷 030801)
氟在自然界中分布广泛,主要应用于工业、农业和医药领域[1]。过量摄入氟不仅会导致氟斑牙和氟骨症,还会损害肝脏、肾脏、肠道等软组织[2-5]。肾脏是机体主要的排泄器官,氟主要通过尿液排出体外,易加重对肾脏的损伤。核黄素(riboflavin)是黄素腺嘌呤二核苷酸的中心成分,其在细胞功能、生长发育和能量代谢中起着关键作用[6-7]。王国光等[8]发现,核黄素可以通过抗氧化作用来实现延缓链脲佐菌素诱导的糖尿病肾病的发展进程。白细胞介素-17A(interleukin-17A,IL-17A)是一类促炎细胞因子,主要参与机体的炎症反应,在自身免疫性疾病中发挥重要作用[9]。实验室前期的研究证实,IL-17A在氟中毒所致的小鼠肝脏、睾丸和肠道等组织损伤中起重要作用[4,10]。因此,本试验构建了核黄素干预IL-17A-/-氟中毒小鼠的模型,通过苏木精-伊红(hematoxylineosin,HE)染色、马松(Masson)染色,以及血清肾脏功能指标肌酐(creatinine,Cr)、尿酸(uric acid,UA)、尿素氮(blood urea nitrogen,BUN)的检测,探究核黄素在正常和IL-17A-/-氟中毒小鼠肾脏纤维化中的影响,为氟中毒的诊断和干预提供一定的理论依据。
1 材料与方法
1.1 主要试剂
氟化钠、苯胺蓝、酸性品红、丽春红、磷钼酸购自天津市化学试剂三厂;核黄素磷酸钠购自北京国药集团化学试剂有限公司;HE试剂盒购自北京索莱宝科技有限公司;Cr、UA、BUN试剂盒购自南京建成生物公司。冰醋酸、无水乙醇等均为实验室常规试剂。
1.2 试验动物及分组
选取体重相近的6周龄的野生型(wild type,WT)和IL-17A-/-C57BL/6J雄性小鼠(Mus musculus),各32只,分别分成4组,每组8只小鼠:1)对照组(Ctrl,0.9% NaCl);2)氟化钠组(NaF,24 mg/kg NaF);3)核黄素组(Ribo,5 mg/kg 核黄素磷酸钠);4)氟化钠+核黄素组(NaF+Ribo,24 mg/kg NaF+ 5 mg/kg核黄素磷酸钠)。每组小鼠进行连续灌胃90 d。
1.3 样本采集和前处理
采集血液,离心取上清液保存于-80℃冰箱,用于 Cr、UA、BUN的检测。每组取3只小鼠的左肾固定于4%多聚甲醛溶液,用于组织形态学和纤维化的检测。
1.4 肾脏脏器指数测定
称取小鼠的体重和肾脏的质量,计算肾脏脏器指数:脏器指数=脏器湿重(g)/体重(g)×100%。
1.5 HE染色
肾脏组织包埋切片后,苏木精染液染色1 min,盐酸酒精分化1 min,伊红染液染色3 min,梯度酒精脱水,利用二甲苯使之透明后封片,在光学显微镜下镜检观察肾脏形态学变化。
1.6 Masson染色
肾脏组织包埋切片后,用Weigert铁苏木素染液染色7 min,充分水洗分化,丽春红酸性品红复合液染色1 min,磷钼酸分化7 min,苯胺蓝染液倒进倒出,1%冰醋酸分化1 min,梯度酒精脱水,利用二甲苯使之透明后封片,在光学显微镜下镜检观察肾脏纤维化状况。
1.7 血清肾脏功能指标检测
使用试剂盒对小鼠血清中的肾脏功能指标(Cr、UA、BUN)含量进行测定,所有操作严格按照试剂盒说明书操作进行。
1.8 数据处理
采用GraphPad Prism 8软件进行数据统计,数据用平均数±标准差(±s)表示。差异显著性利用one-way analysis of variance(ANOVA)进行分析,*P<0.05表示差异显著。
2 结果与分析
2.1 核黄素对IL-17A-/-氟中毒小鼠肾脏脏器指数的影响
各组小鼠肾脏脏器指数如图1所示,在核黄素干预氟中毒90 d之后,无论是WT小鼠,还是IL-17A-/-小鼠,各组之间的肾脏脏器系数均没有明显差异(P>0.05)。
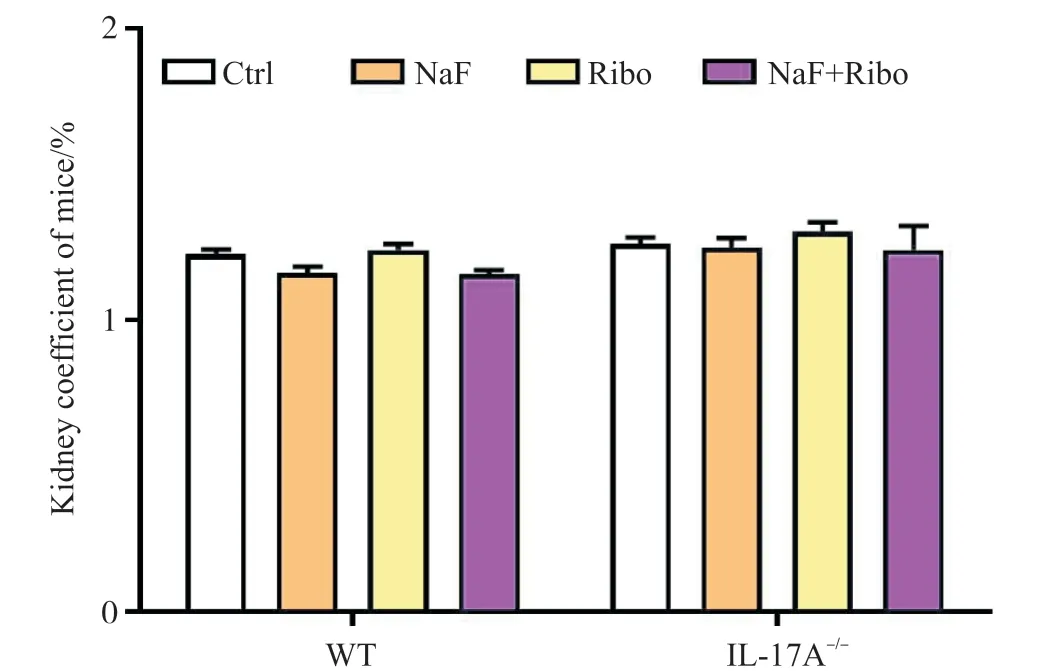
图1 核黄素对IL-17A-/-氟中毒小鼠肾脏脏器指数的影响(n=8)Fig. 1 Effects of riboflavin on kidney coefficient of IL-17A-/- mice induced by fluoride (n=8)
2.2 核黄素对IL-17A-/-氟中毒小鼠肾脏组织形态学的影响
各组小鼠肾脏组织形态变化如图2如示,在WT小鼠中,Ctrl组肾小球的结构清晰完整,肾小管排列较为整齐,基底膜完整和突出,管腔间隙正常,没有明显的组织病变发生。NaF组中肾小球结构变大且变得模糊,肾小管上皮细胞排列紊乱、管腔变窄。Ribo组肾小球结构清晰,肾小管上皮细胞排列紧凑且有规律。NaF+Ribo组中的肾小球结构变得清晰,肾小管上皮细胞排列变得规则,管腔增宽。而在IL-17A-/-小鼠中,与Ctrl组相比,NaF组肾小球变大,肾小管排列变得紊乱,Ribo组无明显变化,与NaF组比较,NaF+Ribo组的肾脏结构明显变得清晰,肾小球变小,肾小管排列整齐,肾脏形态病变得到改善。
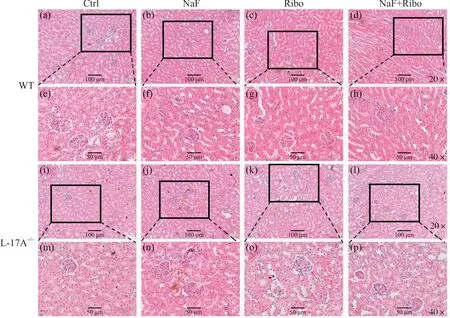
图2 核黄素对IL-17A-/-氟中毒小鼠肾脏组织形态学的影响Fig. 2 Effects of riboflavin on renal histomorphology in IL-17A-/- mice induced by fluoride
2.3 核黄素对IL-17A-/-氟中毒小鼠血清Cr、UA 和BUN的影响
如图3a所示:在WT小鼠中,与Ctrl组相比,各处理组的血清Cr水平明显上升(P<0.05);在IL-17A-/-小鼠中,与Ctrl组相比,各组之间的血清Cr水平没有明显变化(P>0.05)。如图3b和3c所示:与WT小鼠Ctrl组相比,NaF组的血清UA和BUN水平均显著升高(P<0.05);而在IL-17A-/-小鼠中,各组之间的UA和BUN水平均无显著差异(P>0.05)。
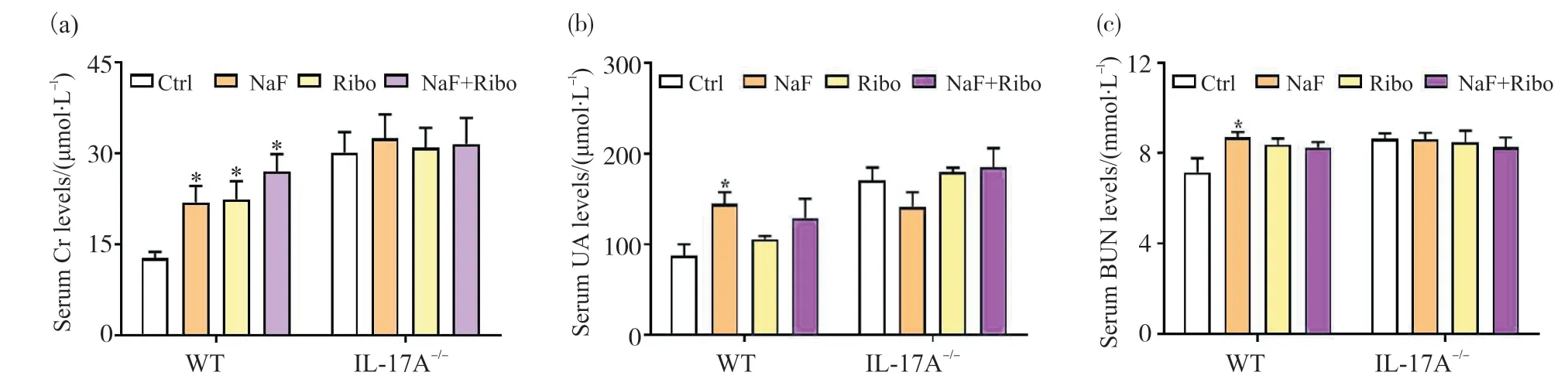
图3 核黄素对IL-17A-/-氟中毒小鼠肾脏功能的影响(n=6)Fig. 3 Effects of riboflavin on renal function of IL-17A-/- mice induced by fluoride (n=6)
2.4 核黄素对IL-17A-/-氟中毒小鼠肾脏纤维化的影响
Masson染色可以直观反映出小鼠肾脏纤维化的程度,胶原纤维呈蓝色,肌纤维和胞质呈红色。由图4可知,在WT小鼠中,Ctrl组小鼠肾脏组织肾小球、基底膜结构完整,纤维化程度低。与Ctrl组相比,NaF组出现大面积的蓝染,胶原纤维沉积较多,呈现纤维化,而Ribo组以及NaF+Ribo组未出现大面积蓝染明显的胶原沉积现象,纤维化程度较轻。在IL-17A-/-小鼠中,与Ctrl组相比,NaF组的蓝色胶原纤维沉积较多、纤维化程度加重,Ribo组无明显变化,与NaF组相比,NaF+Ribo组中的蓝色胶原沉积减少,纤维化程度减轻。与WT小鼠相比,IL-17A-/-小鼠各组的胶原纤维沉积减少,肾脏纤维化程度降低。
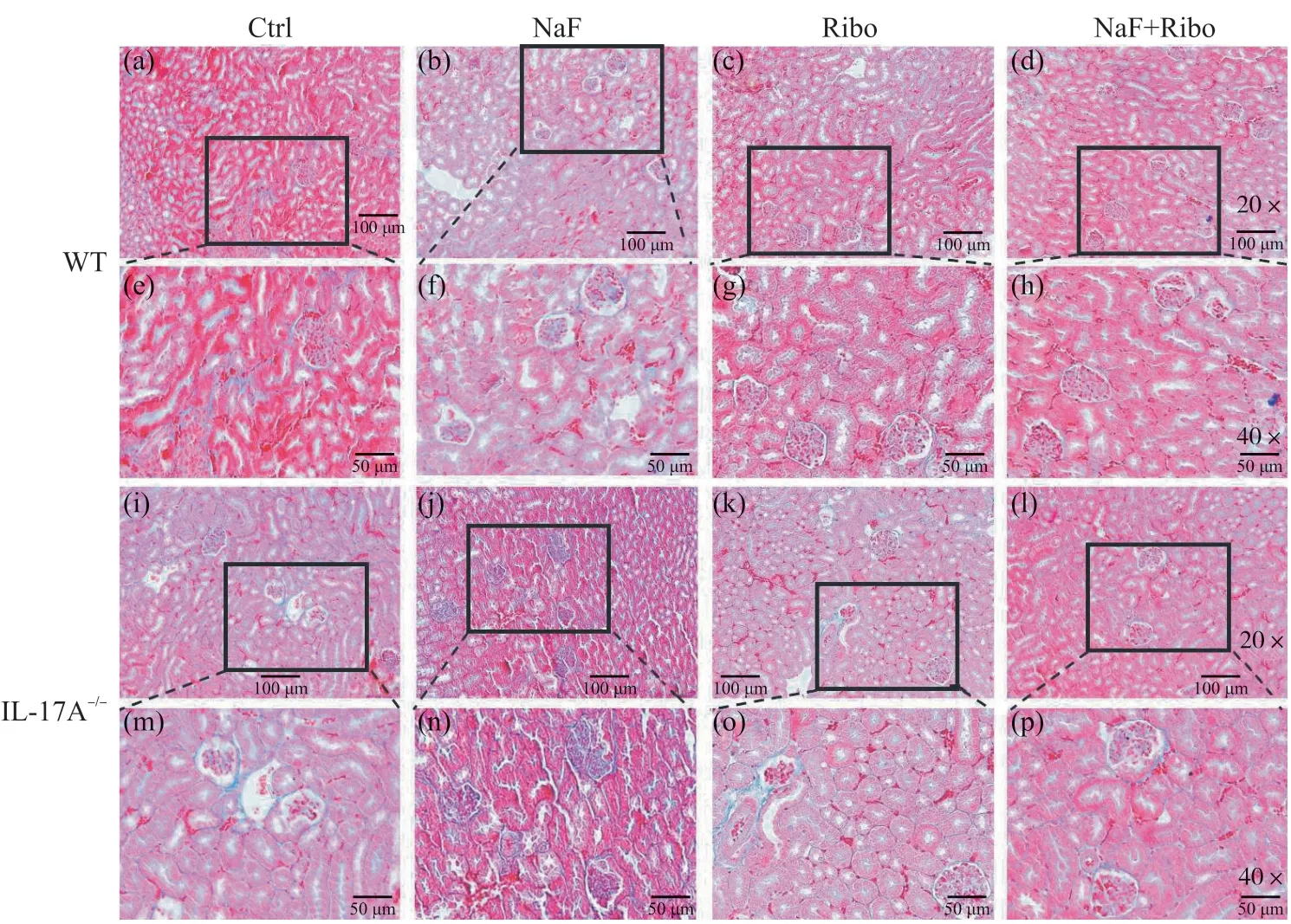
图4 核黄素对IL-17A-/-氟中毒小鼠肾脏组织纤维化的影响Fig. 4 Effects of riboflavin on renal fibrosis in IL-17A-/- mice induced by fluoride
3 讨论
肾脏纤维化是肾脏功能逐渐损伤到丧失的一个过程。氟可以引起机体氧化应激,导致肾脏纤维化[11]。作为一种广泛存在的维生素,核黄素具有强的抗氧化作用,而IL-17A在肾脏纤维化过程中起着关键的作用[6,12]。我们构建核黄素干预IL-17A-/-氟中毒小鼠模型,探究核黄素在氟致肾脏结构功能损伤及纤维化中的潜在保护作用。
肾脏的脏器指数是反映肾脏生长发育的一个重要指标。本试验中,氟、核黄素以及IL-17A-/-均未对肾脏生长发育产生影响。长期氟暴露会损坏肾脏的组织结构[3]。本试验中,氟暴露同样引起了小鼠肾脏肾小管排列紊乱和管腔变小等形态学病变。添加核黄素之后,肾小管排列变得整齐,管腔增大,而IL-17A敲除以后,各组的肾脏组织的形态损伤得到缓解,表明核黄素在氟导致小鼠肾脏组织形态损伤中起着重要的缓解作用,且核黄素在IL-17A-/-小鼠中的缓解效果更明显。
血清中Cr、UA和BUN是临床上检验肾脏功能的常用指标,当肾脏功能受损时,这三个指标含量都会上升[13-14]。研究表明,氟暴露会引起ICR雄鼠Cr、UA、BUN的含量明显上升[15]。在本试验中,氟同样引起了小鼠血清Cr、UA、BUN的上升,而单独补充核黄素以及氟和核黄素共处理后,也引起了Cr的上升,但是对UA和BUN没有影响。 Mehrotra等[16]发现IL-17A的活化会加速肾脏的损伤进程。本试验中,我们发现在敲除IL-17A后,各组小鼠血清之间的Cr、UA和BUN含量均无明显变化,进一步证明了核黄素在IL-17A-/-小鼠氟中毒引起的肾脏功能损伤中未起到明显的缓解效果。
Kido等[11]发现SD大鼠(Rattus norregicus)饮用150 mg/L NaF 14 d,可加重单侧输尿管梗阻引起的肾脏纤维化程度。在本试验中,氟同样会引起正常小鼠胶原纤维的沉积,诱导肾脏纤维化,这与前人的结果一致。添加核黄素后,胶原纤维沉积减少,纤维化程度降低,表明核黄素能够减轻氟引起的肾脏纤维化。据报道,IL-17A可以调节各种纤维化信号通路,促进肾脏纤维化的进程[17-19]。本试验中,敲除IL-17A之后,和WT小鼠相比,各组肾脏纤维化程度减轻,表明核黄素可以缓解氟致IL-17A-/-小鼠的肾脏纤维化程度,且缓解效果要好于野生型的小鼠。
综上所述,核黄素对氟中毒引起的IL-17A-/-小鼠肾脏组织形态损伤和纤维化程度有着积极的缓解作用,且缓解效果要优于野生型的小鼠,其具体的分子机制值得我们深入研究。

