Bacillus coagulans X3角蛋白酶的酶学性质 及其应用研究
雷 平,尹红梅,陈 薇,吴民熙,郭照辉,刘惠知,刘 标*
(1. 湖南省微生物研究院,长沙 410009;2. 湖南省农用微生物应用工程技术研究中心,长沙 410009)
随着我国畜禽规模养殖的发展,饲用蛋白质原料的需求量持续增加,同时又产生了大量的角蛋白废弃物,如羽毛。如果能采用适宜方法水解利用这些角蛋白废弃物,以部分代替畜禽日粮中的蛋白质原料,不仅可解决环境污染的问题,还将产生较大的经济效益[1-2]。角蛋白含有大量的二硫键,结构稳定,不易被动物消化道中的蛋白酶(胃蛋白酶、胰蛋白酶等)降解,动物消化率极低,需要处理后才能应用[3-4]。采用传统方法(如高温高压法、膨化法、碱性水解法)加工角蛋白废弃物存在能耗高、二次污染、营养损失严重等问题,而利用微生物或角蛋白酶处理具有操作简单、成本低、不会破坏氨基酸等优点,是最有前景的替代方法之一[2,5-7]。
目前已报道了较多能够产生角蛋白酶的微生物[8],由于微生物的来源不同,其产生的角蛋白酶酶学性质差异很大。如地衣芽孢杆菌(Bacillus licheniformis)PWD-1分泌的角蛋白酶最适反应pH为7.5,最适反应温度为50℃[9],而高温放线菌(Thermoactinomyces)CDF分泌的角蛋白酶最适pH为11.0,最适反应温度为80℃[10]。金属离子对不同来源角蛋白酶活性的影响也不同,如Cu2+对拟蕈状芽孢杆菌(Bacillus paramycoides)Gxun-30分泌的角蛋白酶有显著的抑制作用[11],但10 mmol/L的Cu2+可使蜡样芽胞杆菌(Bacillus cereus)DHW-06相对角蛋白酶活力提高120%[12]。
课题组在前期研究中获得了1株可高效降解角蛋白废弃物的凝结芽孢杆菌(Bacillus coagulan)X3,其产生的角蛋白酶的酶学性质尚不明晰,应用工艺条件有待进一步明确。因此,本研究对该菌株粗酶液的酶学性质及降解羽毛角蛋白的效果进行了测试,以期为其实际应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
凝结芽孢杆菌(Bacillus coagulan)X3菌株由本课题组筛选获得并保存。
1.1.2 培养基
种子培养基(g/L):牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,pH 7.0。
发酵产酶培养基(g/L):羽毛15.0 g,K2HPO40.5 g,KH2PO40.5 g,NaCl 0.5 g,pH 7.0。羽毛从家禽屠宰场收集,用蒸馏水洗净,60℃烘干至恒重。
1.2 方法
1.2.1 发酵粗酶液的制备及角蛋白酶活性的测定
1.2.1.1 发酵粗酶液的制备
将菌株X3接种至种子培养基中培养24 h制备种子液,以体积分数为2%的接种量接种到发酵产酶培养基中,35℃、200 r/min培养72 h,发酵液经10 000 r/min离心10 min后去除沉淀,收集上清液。向上清液中添加饱和度为40%的硫酸铵,4℃过夜盐析,10 000 r/min离心10 min收集沉淀,用蒸馏水复溶,利用透析袋透析去除残留的铵离子,获取粗酶液。
1.2.1.2 角蛋白酶活性测定方法
取适当稀释的粗酶液500 μL与500 μL用Tris-HCl缓冲液(50 mmol /L,pH 8. 0)稀释的 1%角蛋白溶液混匀,50℃水浴1 h,加入500 μL 0.4 mol/L三氯乙酸(trichloroacetic acid,TCA)溶液终止反应,对照组在反应前先加入TCA溶液。10 000 r/min离心10 min后,吸取500 μL上清液,依次加入2.5 mL 0.4 mol/L Na2CO3溶液和0.5 mL福林酚试剂,50℃反应20 min,660 nm处检测吸光值。一个酶活单位定义为每分钟催化水解角蛋白产生1 μg酪氨酸所要的酶量。
1.2.2 粗酶液的酶学性质分析
1.2.2.1 粗酶液的最适反应温度及热稳定性的测定
反应温度分别设定为20、30、40、50、60、70、80、90℃,测定不同反应温度下的酶活力,以试验组中最大酶活力定义为100%,确定其他试验组的相对角蛋白酶活力。每组处理设置3个重复试验,下同。
将粗酶液分别在70、80、90℃的条件下保温2、4 h后,测定不同温度处理后的剩余酶活力,以未经处理的初始酶液为对照,活性设为100%。
1.2.2.2 粗酶液最适反应pH的测定
分别配制pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的不同缓冲液:柠檬酸-柠檬酸钠缓冲液(0.1 mol/L,pH 4.0~7.0)、Tris-HCl缓冲液(0.1 mol/L,pH 7.0~8.0)、甘氨酸-氢氧化钠缓冲液(0.1 mol/L,pH 9.0~10.0)、KCl-NaOH缓冲液(0.1 mol/L,pH 11.0)。将角蛋白底物溶于其中,在最适酶反应温度下进行试验。以试验组最大酶活力为100%,确定其他试验组的相对角蛋白酶活力。
1.2.2.3 金属离子对粗酶液活性的影响
在反应体系中分别加入低浓度(5 mmol/L)和高浓度(20 mmol/L)的Na+、Ca2+、Mg2+、Zn2+、Fe3+、Cu2+、Mn2+、Ni2+,室温下放置1 h后,在最适反应温度下测定角蛋白酶活性。以不加金属离子的处理为对照,酶活设为100%,计算各处理组的相对酶活力。
1.2.2.4 化学试剂对粗酶液活性的影响
蛋白酶抑制剂:苯甲基磺酰氟(phenyl methyl sulfonyl fluoride,PMSF,10 mmol/L)、乙二胺四乙酸(ethylene diamine tetra acetic acid,EDTA,10 mmol/L);还原剂:二硫基苏糖醇(dithiothreitol,DTT,10 mmol/L)、β-巯基乙醇(10 mmol/L);表面活性剂:十二烷基磺酸钠(sodium dodecyl sulfate,SDS,1%);有机溶剂:二甲基亚砜(dimethyl sulfoxide,DMSO,1%)。依次向酶液中添加上述化学试剂,常温下保持1 h后,在最适反应温度下测定酶活性。以添加蒸馏水处理组为对照,酶活性设为100%,计算各处理组的相对角蛋白酶活力。
1.2.3 粗酶液水解羽毛角蛋白的应用
将粗酶液与鸡羽毛在最适反应条件下(60℃、pH 8.0)混合反应6 h,取反应上清液以1∶5的体积比与5%磺基水杨酸均匀混合,4℃、12 000 r/min离心15 min,收集上清液并用0.22 μm滤膜过滤,利用全自动氨基酸分析仪(日立L-8900)分析游离氨基酸的组成。同时,将降解前后的羽毛用无菌水冲洗后烘干,利用扫描电镜观察粗酶液对其降解效果。
1.2.4 数据处理与分析
试验数据利用软件SPSS 25.0和Microsoft Excel 2007进行统计分析和作图。图表中的数据为平均值±标准差(±s),采用One-way ANOVA方法对不同处理间的差异显著性进行分析。
2 结果与分析
2.1 凝结芽孢杆菌 X3所产角蛋白粗酶液的酶学 性质
2.1.1 最适反应温度和热稳定性
图1a结果显示:菌株X3产生的角蛋白粗酶液在60℃以下时,酶活性随着反应温度升高而逐渐增加;60℃时酶活性达到最大值,此后随着反应温度升高酶活性显著下降。热稳定性结果显示(图1b):粗酶液在70、80℃条件下分别处理4 h后仍能保留95.0%、86.7%的残余酶活性,说明菌株X3产生的角蛋白酶热稳定性较好;但在90℃条件下处理4 h后,残余酶活性仅为37.5%,可能是酶蛋白结构在过高温度下遭到了破坏。
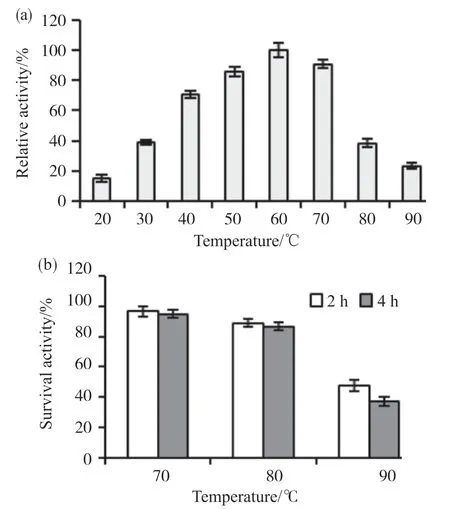
图1 菌株X3粗酶液的最适反应温度(a)和热稳定性(b)Fig. 1 Optimal temperature (a) and thermal stability (b) of crude enzyme from strain X3
2.1.2 最适催化反应pH
如图2所示:菌株X3的粗酶液在pH 4.0、5.0的条件下,相对角蛋白酶活力较低,仅为14.2%、31.8%;调节反应体系pH 在7.0~10.0范围内时,均显示出较高的酶活性,其中在pH 7.0~8.0时相对酶活力达到最高值;当pH增大至11.0时,相对酶活性又显著下降。试验结果表明,菌株X3的粗酶液在微碱性环境中能发挥最大的催化角蛋白降解活性。

图2 菌株X3粗酶液的最适反应pHFig. 2 Optimal pH of crude enzyme from strain X3
2.1.3 不同金属离子对粗酶液活性影响
由表1可知,不同类型金属离子对粗酶液角蛋白酶活的影响差异较大。Ca2+和Mn2+对粗酶液角蛋白酶活力具有显著的促进作用,其中Mn2+的促进作用较强,20 mmol/L的Mn2+可使相对酶活力达125%;不同浓度的Cu2+、Ni2+对角蛋白酶活性有较强的抑制作用,而Na+、Mg2+、Fe3+对角蛋白酶活性无显著影响;Zn2+对酶活性的影响与使用浓度有关,浓度为5 mmol/L时对酶活性产生较强抑制作用,提高浓度至20 mmol/L时则有促进作用。

表1 金属离子对粗酶液活力的影响Tab. 1 Effects of metal ions on keratinase activity of crude enzyme
2.1.4 化学试剂对粗酶液活性影响
如图3所示:反应体系中加入蛋白酶抑制剂PMSF、EDTA对酶活性有较强的抑制作用,相对酶活力仅为30.8%、41.8%;而β-巯基乙醇和DTT对酶活性有显著的激活作用,分别使相对酶活力提高至123.4%和129.2%;SDS和DMSO对酶活性没有显著影响。

图3 化学试剂对X3粗酶液角蛋白酶活性的影响Fig. 3 Effects of chemical reagent on the keratinase activity of strain X3
2.2 凝结芽孢杆菌X3粗酶液的应用效果
Bacillus coagulasX3粗酶液水解羽毛6 h后,大部分羽小枝被降解,羽轴变软,空间结构被分解(图4)。水解产物的游离氨基酸组成如表2所示,水解前共检测到17种游离氨基酸,水解后增加到18种(增加的种类为半胱氨酸),游离氨基酸的含量从0.035 3 mg/mL提高至4.322 6 mg/mL。降解产物中所有种类氨基酸的含量均有较大程度的增加,其中含量较高的氨基酸为缬氨酸、苯丙氨酸、酪氨酸、谷氨酸等。结果表明,X3的粗酶液可提高羽毛角蛋白的营养价值,能有效改善动物对降解产物的吸收利用。

图4 X3粗酶液水解羽毛扫描电镜观察Fig. 4 SEM analysis of chicken feather degradation by crude enzyme of X3

表2 羽毛酶解液中游离氨基酸组成Tab. 2 Free amino acid composition in feather degradation broth
3 讨论
大部分来源于微生物的角蛋白酶最适反应温度在35~70℃之间,少部分来源于热泉中的角蛋白酶最佳温度为100℃,这均与来源微生物的生存环境有关[13]。菌株X3从畜禽粪便堆肥高温期样品中分离获得,其粗酶液最适反应温度为60℃,与堆肥高温期温度范围相吻合。大部分微生物角蛋白酶是中性或碱性蛋白酶,最适pH 在7.0~9.0之间,菌株X3所产角蛋白酶最适pH与目前文献报道类似[13]。本研究中,Ca2+对酶活性具有显著的促进作用,这与已报道的Bacillus paramycoidesGxun-30[11]、Bacillus cereusDHW-06[12]、枯草芽孢杆菌(Bacillus subtilis)KS12[14]结果一致,但与菌株耐辐射奇异球菌(Deinococcus actinosclerus) RM[15]结果相反;Cu2+可强烈抑制菌株X3粗酶液的角蛋白酶活性,这一结果与菌株Gxun-30、KS12相同[11,14],但文献报道菌株DHW-06、RM分泌的角蛋白酶可被Cu2+激活[12,15];其他金属离子对菌株X3酶活性的影响也与其他已报道菌株不完全一致。结果表明,同种金属离子对不同微生物来源角蛋白酶活性的影响差异较大。目前已报道的角蛋白酶均属于金属蛋白酶或丝氨酸蛋白酶家族[16-19]。本研究中常见的丝氨酸蛋白酶抑制剂PMSF可抑制X3的酶活力,表明该菌株所产生的酶可能属于丝氨酸蛋白酶类。角蛋白降解的关键步骤是二硫键的断裂,还原剂β-巯基乙醇和DTT可显著提高X3的角蛋白酶活性,可能是因为还原剂能够催化二硫键的断裂,有助于角蛋白的水解。
X3粗酶液降解羽毛角蛋白产物中的游离氨基酸种类丰富、含量高,说明其在废弃角蛋白饲料化利用方面具有一定的应用潜力。降解产物中的主要氨基酸为缬氨酸、苯丙氨酸、酪氨酸、谷氨酸,这与菌株贝莱斯芽孢杆菌(Bacillus velezensis)NLG1[20]降解羽毛产物的氨基酸组成类似,但与放线菌(Thermoactinomyces)YT-06降解产物组成有差异(主要氨基酸为甘氨酸、缬氨酸和天冬氨酸)[21],这说明不同来源的角蛋白酶性质不同,对底物作用位点不同,导致游离氨基酸的组成和含量有差异。

