内镜下黏膜切除术对早期胃癌患者肿瘤切除率、血清PG、CA125水平的影响
陈敬成 肖小梅
胃癌是临床病死率较高的消化道恶性肿瘤[1-2]。国家癌症中心统计发现,2015 年我国胃癌死亡49.80 万例,仅次于肺癌[3]。早期胃癌(EGC)癌组织仅局限于黏膜层和黏膜下层,采用根治术治疗,病灶切除率较高,预后良好[4]。近年来,随着手术治疗微创化、精准化及个体化理念的提出,胃癌根治术由传统的开腹手术,转变为单孔或多孔腹腔镜治疗,手术切除范围也由全胃切除、2/3 以上的远端胃切除缩小为保留幽门的胃切除、近端胃切除及局部胃切除等,淋巴清扫范围也由标准的D2清扫调整为D1或D1+,最大限度地保留胃部解剖结构,提高患者的术后生活质量[5-6]。内镜下黏膜切除术(EMR)是目前治疗EGC 及癌前病变的重要手段,该术具有术野清晰、并发症少的优势[7]。本研究旨在分析EMR 与保留幽门胃切除术对EGC 患者肿瘤切除率及血清PG、CA125 水平的影响。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2019 年5 月-2021 年6 月于井冈山大学附属医院就诊的120 例早期胃癌患者的临床资料。纳入标准:(1)经临床胃镜、CT、病理组织诊断等检查确诊,并符合文献[8]中早期胃癌诊断标准,癌组织仅限于胃黏膜层或黏膜下层的胃癌;(2)年龄20~70 岁;(3)参考文献[8-9]符合胃癌内镜下切除术适应证,①病灶≤3 cm、有溃疡的分化型黏膜内癌;②胃黏膜高级别上皮内瘤变;③病灶位于胃中部1/3,无远端转移,且病灶边缘距幽门距离>4 cm。排除标准:(1)癌组织浸润肌层或麻醉不耐受者;(2)合并心、肝、肾等严重功能不全者;(3)合并其他恶性肿瘤者;(4)患有精神疾病或凝血功能障碍者;(5)入组前接受胃癌放/化疗治疗者。将120 例患者根据手术方法分为观察组(n=70)和对照组(n=50)。该研究经医院医学伦理学委员会批准。
1.2 方法
1.2.1 对照组 应用保留幽门胃切除术治疗:术前明确原发病灶位置、大小、浸润程度及转移情况;患者取仰卧位,常规麻醉,选取剑突至脐上为切口区域,在距离病灶上缘5 cm 做胃近端切割线,在距离幽门括约肌侧缘3 cm 做远侧端切割线,尽量保留胃窦长度,同时保留幽门支神经、腹腔支、肝支迷走神经;合并No.5、No.6 组淋巴结转移者,以胃网膜右动脉为起始部,以廓清或不廓清方法行淋巴结清扫,避免损伤迷走幽门支神经;合并其他部位淋巴结转移者,采用D1或D1+淋巴结清扫;部分胃切除术完成后,采用可吸收线行残胃端端吻合,注意电凝止血,创面喷洒硫糖铝混悬凝胶,将切除组织送检;术后给予患者常规抗感染、饮食指导等干预。
1.2.2 观察组 应用EMR 术治疗:患者取侧卧位,常规麻醉,腹腔镜下于病灶边缘0.5 cm 处做间隔0.2 cm 的电凝标记,在标记点周围以0.9% 氯化钠溶液行多点黏膜下注射,使病灶充分隆起;退出内镜,于内镜前端安装透明帽,置入高频圈套器;再次进镜,利用负压持续吸引将病灶黏膜吸入透明帽内,确保电凝标记点内组织清除吸引完全后,停止负压吸引,收紧圈套器,行病灶电凝切除;较大的病灶采用分次切除方法,病灶切除完毕后,检查创面情况,电凝止血,并于创面喷洒硫糖铝混悬凝胶,将切除组织送检;术后给予EMR 术常规护理。
上述两组患者均由同组经验丰富的医师施术;所有患者出院后仍采用质子泵抑制剂及幽门螺杆菌根除药物治疗,叮嘱患者每3 个月进行镜检复查。
1.3 观察指标与评价标准(1)比较两组患者的手术时间、术中出血量及住院时间;(2)成功切除病灶后,进行组织病理检验,统计两组肿瘤切除率。①完全切除:术后病理学检查显示病灶标本边缘无癌变组织残余,无血管淋巴浸润,病变侵犯深度未超过黏膜肌以下500 μm[10];②基底病灶残余:术后6 个月内原切除部位以及周围1 cm 发现肿瘤病灶[10];(3)分别于术前1 d 及术后30 d 时留取两组患者清晨空腹静脉血,3 500 r/min 离心5 min,取上清采用酶联免疫吸附法检测血清胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)水平,计算PGⅠ/PGⅡ,得到PGR;采用电化学发光法检测血清糖类抗原125(CA125)水平;(4)比较两组术前1 d 及术后6 个月时的体重指数(BMI)及血红蛋白(Hb)、血清总蛋白(TP)水平;(5)比较两组术中急性出血,迟发性出血、穿孔等围手术期不良事件发生率。急性出血指术中活动性渗血或喷射性出血,内镜下止血困难,需中断手术和/或采用输血治疗。迟发性出血指内镜术后出血,需进行内镜下止血,迟发性出血患者至少具备以下2 项症状:①黑便、呕血、头晕;②内镜治疗前后血红蛋白下降20 g/L 以上;③内镜下治疗前后血压下降20 mmHg 以上;④胃镜检查提示术后溃疡出血。
1.4 统计学处理 应用SPSS 21.0 处理数据,两组围手术期指标、血清PG、CA125 水平、营养指标等计量资料采用()表示,组间比较行独立样本t 检验,组内比较行配对样本t 检验;两组手术切除率及围手术期不良事件发生情况等计数资料以率(%)表示,采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 对照组男30 例,女20 例;年龄22~70 岁,平均(52.25±16.33)岁;病灶直径1.0~2.9 cm,平均(1.90±0.64)cm。观察组男39 例,女31 例;年龄20~68 岁,平均(51.13±15.02)岁;病灶直径1.3~3.0 cm,平均(1.92±0.53)cm。两组年龄、性别等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组围手术期指标比较 观察组手术时间及住院时间均短于对照组、术中出血量显著少于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组围手术期指标比较()
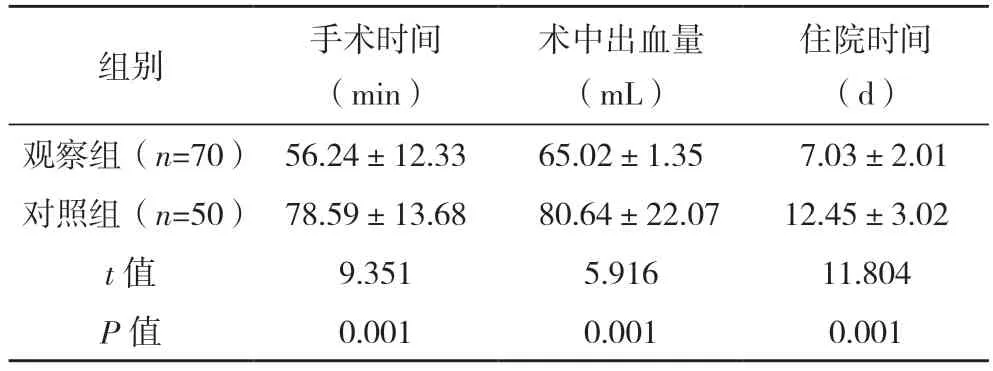
表1 两组围手术期指标比较()
2.3 两组肿瘤切除率比较 观察组患者共切除70 个病灶,对照组患者共切除50 个病灶,两组完全切除率及基底病灶残余率比较,差异均无统计学意义(P>0.05),见表2。
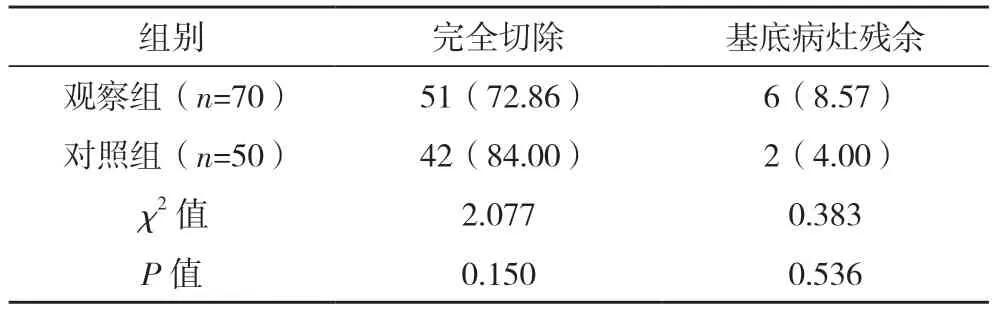
表2 两组肿瘤切除率比较[例(%)]
2.4 两组血清PGⅠ、PGⅡ、PGR 及CA125 水平比较 两组术前1 d 时血清PGⅠ、PGⅡ、PGR 及CA125 水平比较,差异均无统计学意义(P>0.05);术后30 d 时两组血清PGⅠ、PGR 水平较术前1 d 均显著升高,血清PGⅡ、CA125 水平较术前1 d 显著降低(P<0.05),两组术后30 d 血清PGⅠ、PGR 水平比较,差异均有统计学意义(P<0.05),两组术后30 d 血清PGⅡ、CA125 水平比较,差异均无统计学意义(P>0.05),见表3。
表3 两组血清PGⅠ、PGⅡ、PGR及CA125水平比较()
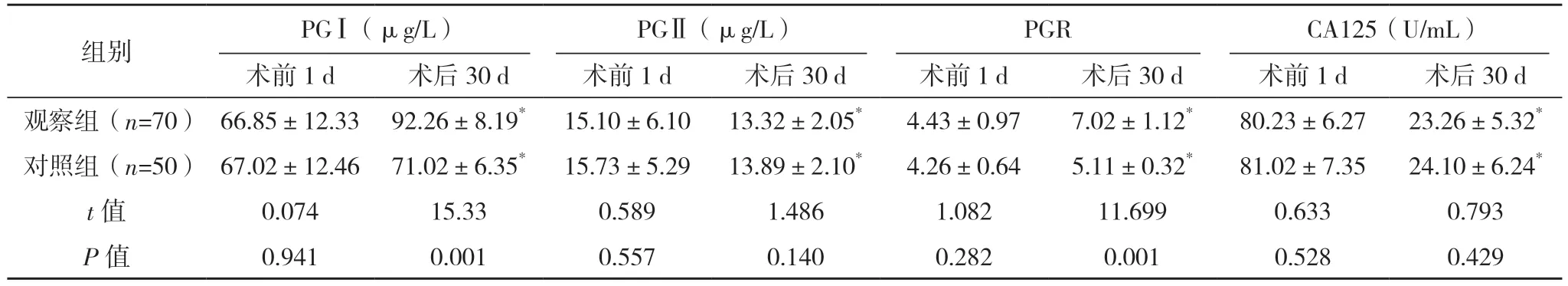
表3 两组血清PGⅠ、PGⅡ、PGR及CA125水平比较()
*与术前1 d 比较,P<0.05。
2.5 两组营养指标比较 两组术前BMI、Hb 及TP水平比较,差异均无统计学意义(P>0.05),术后6 个月时,两组上述指标较术前1 d 均明显升高,且观察组均显著高于对照组(P<0.05),见表4。
表4 两组营养指标比较()
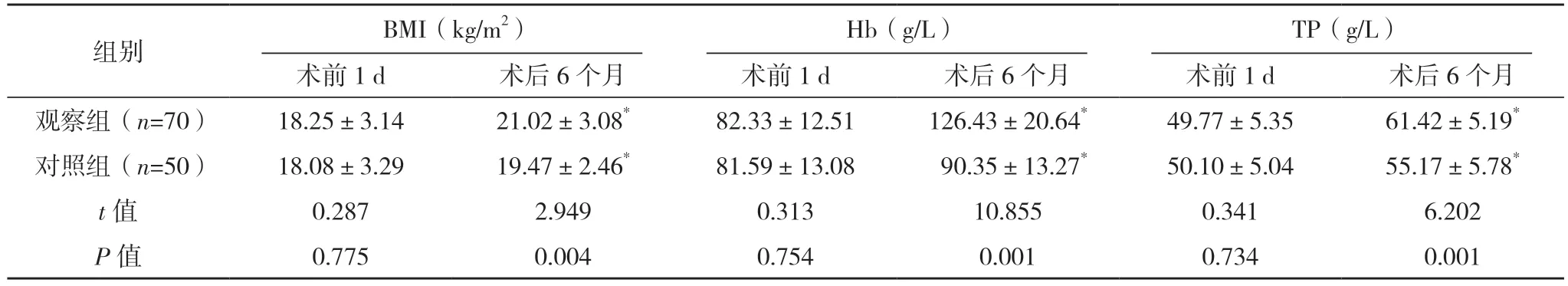
表4 两组营养指标比较()
*与术前1 d 比较,P<0.05。
2.6 两组围手术期不良事件比较 两组术中急性出血、迟发性出血、穿孔及切口感染发生率比较,差异均无统计学意义(P>0.05);观察组餐后恶心、呕吐发生率显著低于对照组,组间比较差异有统计学意义(χ2=4.325,P=0.038),见表5。

表5 两组围手术期不良事件比较[例(%)]
3 讨论
保留幽门胃切除术于1967 年被首次报道,日本学者Maki 等[11]将其应用于良性胃溃疡治疗,发现患者的近期及远期预后均良好。而后随着改良胃切除术的提出,保留幽门胃切除术得以在EGC 的治疗中开展,并逐渐获得认可[12]。由于保留幽门胃切除术需要保留胃窦的神经及幽门下区的血供,因此要求临床医师切除肿瘤的同时,注重胃功能保护,手术耗时长,施术要求高[13]。EMR 操作的原理相对简单,内镜下通过多点黏膜下注射使黏膜层与肌层分离,而后对病灶组织行负压吸引,并采用电刀切除[14]。与保留幽门胃切除术相比,EMR 操作时间短、出血量少,利于术后恢复。
保留幽门胃切除术可保护迷走神经及幽门结构,保留胃部生理功能[15];EMR 可降低病灶周围组织损伤、促进术后康复[16],但上述两种术式是否可彻底根除病灶,保证预后是临床医患共同关注的焦点。本研究中经术后病理组织检验显示,观察组病灶完全切除率为72.86%,对照组病灶完全切除率为84.00%,组间比较差异无统计学意义(P>0.05)。说明EMR 与保留幽门胃切除术均可有效切除EGC病灶。对两组患者跟踪随访6 个月发现,观察组基底病灶残留率为8.57%,对照组为4.00%,组间比较差异无统计学意义(P>0.05)。因此,上述两种术式在病灶切除率及术后6 个月复发方面效果相近。PG 包括PGⅠ和PGⅡ两种类型,PGⅠ主要由胃底主细胞分泌,PGⅡ由全胃黏膜层腺体分泌[17]。胃癌发生时,致癌因子可影响胃底主细胞功能,故EGC 患者血清PGⅠ水平明显降低[18]。PGR 是PGⅠ与PGⅡ的比值,可评估胃黏膜腺体功能及胃壁细胞活性[19]。CA125 是筛查EGC 的敏感标志物,可有效反映患者肿瘤负荷状态[20]。本研究显示,两组术后30 d 时的血清PGⅠ、PGR 水平较术前1 d 均显著升高,血清PGⅡ、CA125 水平较术前1 d 均显著降低,且两组PGⅠ、PGR 水平比较差异有统计学意义(P<0.05),而两组PGⅡ、CA125 水平比较无显著差异(P>0.05)。这是由于,EMR 与保留幽门胃切除术均可有效切除病灶,抑制癌症,稳定CA125 水平;与EMR 相比,对照组患者进行局部胃体切除,影响PGⅠ的分泌水平,而PGⅡ可在胃体中广泛表达,故水平相对稳定。
本研究还就两组患者术后营养状况进行探究,发现观察组术后6 个月时的BMI、Hb 及TP 水平均显著高于对照组(P<0.05)。这得益于EMR 仅切除病灶组织,保留完整胃部解剖结构及生理功能的优势[21]。术后不良事件跟踪回访显示,观察组患者餐后恶心、呕吐的发生率为8.57%,显著低于对照组的22.00%(P<0.05),EMR 术可有效保留胃部解剖结构,有利于术后对营养物质的消化吸收。另外,本研究还发现,两组术中急性出血、迟发性出血、穿孔、切口感染不良事件的发生率无显著差异(P>0.05),说明EMR 与保留幽门胃切除术治疗EGC 安全可靠。
综上所述,EMR 术与保留幽门胃切除术治疗EGC 均可有效切除病灶,恢复机体CA125 水平,但前者具有明显的微创优势,在减少手术时间、降低术中出血、纠正血清PG 水平及提高术后营养状态方面效果更佳。本研究为EGC 的内窥镜治疗积累临床经验:术前应充分评估患者病灶大小、浸润程度,利于手术操作,减少术中出血;若进行多点黏膜下注射后无法使病灶隆起,则病灶多侵犯固有肌层,应终止EMR,转保留幽门胃切除术;锯齿形一次性圈套器可更好的锁定病灶,利于准确切除。本研究分别给予患者EMR 及保留幽门胃切除术干预,为当前EGC 的临床治疗提供有价值参考,但存在诸多不足:为单中心临床设计,研究样本量较少,仅探究两组患者术后6 个月的病灶残余情况,缺乏远期生存资料,故研究结论局限性明显,需后续补足。

