赤峰地区结直肠癌相关KRAS和PIK3CA基因多态性及临床意义
李敬楠,白春英,房 芹
(1.锦州医科大学,辽宁 锦州 121001;2.赤峰学院附属医院普通外科,内蒙古 赤峰 024000;3.赤峰学院内蒙古人类遗传病研究重点实验室,内蒙古 赤峰 024000;4.赤峰学院附属医院肿瘤内科,内蒙古 赤峰 024000)
结直肠癌(Colorectal cancer,CRC)是常见恶性肿瘤,早期无明显症状,随癌肿增大表现为便血、腹泻及腹痛,晚期表现为贫血、体重减轻[1]。近年来,CRC发病率逐渐上升,据统计其发病率居全球第三位,病死率居第四位,已成为全球的公共卫生问题,严重威胁人类的健康[2]。近年来,随着抗表皮生长因子受体(Epidermal growth factor receptor,EGFR)靶向治疗单抗类药物的问世,CRC的靶向治疗有效延长了患者生存时间,并避免了化疗带来的不良反应[3]。而KARS是EGFR所依赖的下游信号转导通道中的重要调控基因,RAS基因通过突变激活RAS蛋白,能够激活EGFR下游信号因子,导致CRC不能从EGFR单克隆抗体治疗中获益[4]。因此,对存在转移的CRC,应在使用抗EGFR靶向药物前检测RAS基因。但在对抗EGFR靶向药物无效的患者中约50%是RAS基因突变,这是因为EGFR下游丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)通路中的BRAF基因和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)通路中的PIK3CA基因突变后,患者不能从抗EGFR单克隆抗体中获益,因此在靶向治疗前应检测PIK3CA基因[5]。基于此,本研究探讨赤峰地区CRC患者KRAS和PIK3CA基因多态性,以及基因突变率与临床病理特征、血常规及肿瘤标志物的关系,为个体化、精准化治疗提供理论和依据。
1 对象与方法
1.1 研究对象 选择2018年1月至2021年6月赤峰学院附属医院收治的CRC患者107例为研究对象,其中男性68例,女性39例;年龄32~80岁,平均(58.23±7.44)岁。病例纳入标准:首生结直肠癌变,术前未行任何放化疗,术后均进行了基因检测,并进行了联合化疗;符合《中国结直肠癌诊疗规范(2020)版》[6]中诊断并经病理学证实;对本研究知情并签署知情同意书。排除标准:免疫系统疾病;急性或慢性感染;合并其他原发性肿瘤。同时,选取同期体检健康者376例为对照组,其中男性231例,女性145例;年龄30~75岁,平均(57.24±6.27)岁。两组性别、年龄比较差异无统计学意义(均P>0.05)。本研究通过医院伦理委员会审批。
1.2 研究方法
1.2.1 样本制备:切除1 cm×1 cm×1 cm肿瘤组织,福尔马林溶液固定后石蜡包埋组织,常规切片(10~15 μm),共20片,置于4 ℃冰箱保存。
1.2.2 KRAS、PIK3CA基因突变检测:取出其中2~5片切片,间断使用二甲苯脱蜡,离心处理后提取最上层清液,加入无水乙醇1 ml,然后离心、静置、沉淀,使用达安样品DNA分离试剂盒进行组织切片DNA的提取(具体步骤遵从说明书),测定所提DNA浓度及纯度。以调整出合适浓度的DNA作为模板在荧光定量PCR仪(雅睿MA-6000,山东博科生物产业有限公司)上进行PCR扩增,使用基因突变联合检测试剂盒(批号:360016-201701,深圳海思安生物技术有限公司)检测KRAS基因(第2~4外显子)、PIK3CA基因(20号外显子)的突变情况,测序结果按相应软件处理,并与CRC基因库序列对比分析。PCR反应体系:10×PCR缓冲液2.5 μl,dNTP 3 μl,上下游引物各0.8 μl,LA Taq酶0.1 μl,DNA模板2 μl,无菌水13 μl,反应体系为20 μl。反应条件:95 ℃变性5 min;95 ℃ 25 s,56 ℃退火40 s,72 ℃ 15 s,共46个循环;72 ℃延伸7 min。
1.2.3 血常规检测:采集血样2~3 ml,采用全自动生化分析仪(长春迪瑞CS-1200型)检测白细胞(WBC)、红细胞(RBC)、血小板(PLT)、大血小板比率(PLCR)、血小板体积分布宽度(PDW)、血小板比容(PCT)、有核红细胞(NRBC)、中性粒细胞百分比(NEU%)、平均血小板体积(MPV)、单核细胞百分比(MON%)、平均红细胞体积(MCV)、平均血红蛋白浓度(MCHC)、平均血红蛋白量(MCH)、淋巴细胞百分比(LYM%)、血红蛋白(Hb) 、血细胞比容(HCT)、嗜酸性粒细胞百分比(EOS%)、嗜碱性粒细胞百分比(BAS%)。
1.2.4 肿瘤标志物检测:采集晨起空腹肘正中静脉血3 ml,保存于EDTA抗凝管中,以3000 r/min离心10 min,分离上清后-70 ℃恒温冰箱保存。采用酶联免疫吸附法测定检测血清癌胚抗原(CEA)、糖类抗原72-4(CA724)、糖类抗原19-9(CA199)、甲胎蛋白(AFP)。检测试剂盒(批号:20160909、20160306、20180530、20170912)由中山生物工程有限公司提供。

2 结 果
2.1 KRAS和PIK3CA基因突变情况 107例患者中,KRAS基因突变58例,突变率为54.2%;PIK3CA基因突变26例,突变率为24.3%;KRAS和PIK3CA基因同时突变18例,突变率为16.8%。其余患者未发生突变。
2.2 KRAS、PIK3CA基因突变与CRC患者临床病理特征的关系 见表1。KRAS和PIK3CA基因突变与CRC患者性别、年龄、肿瘤部位、病理类型、分化程度、TNM分期及远处器官转移无关(均P>0.05)。
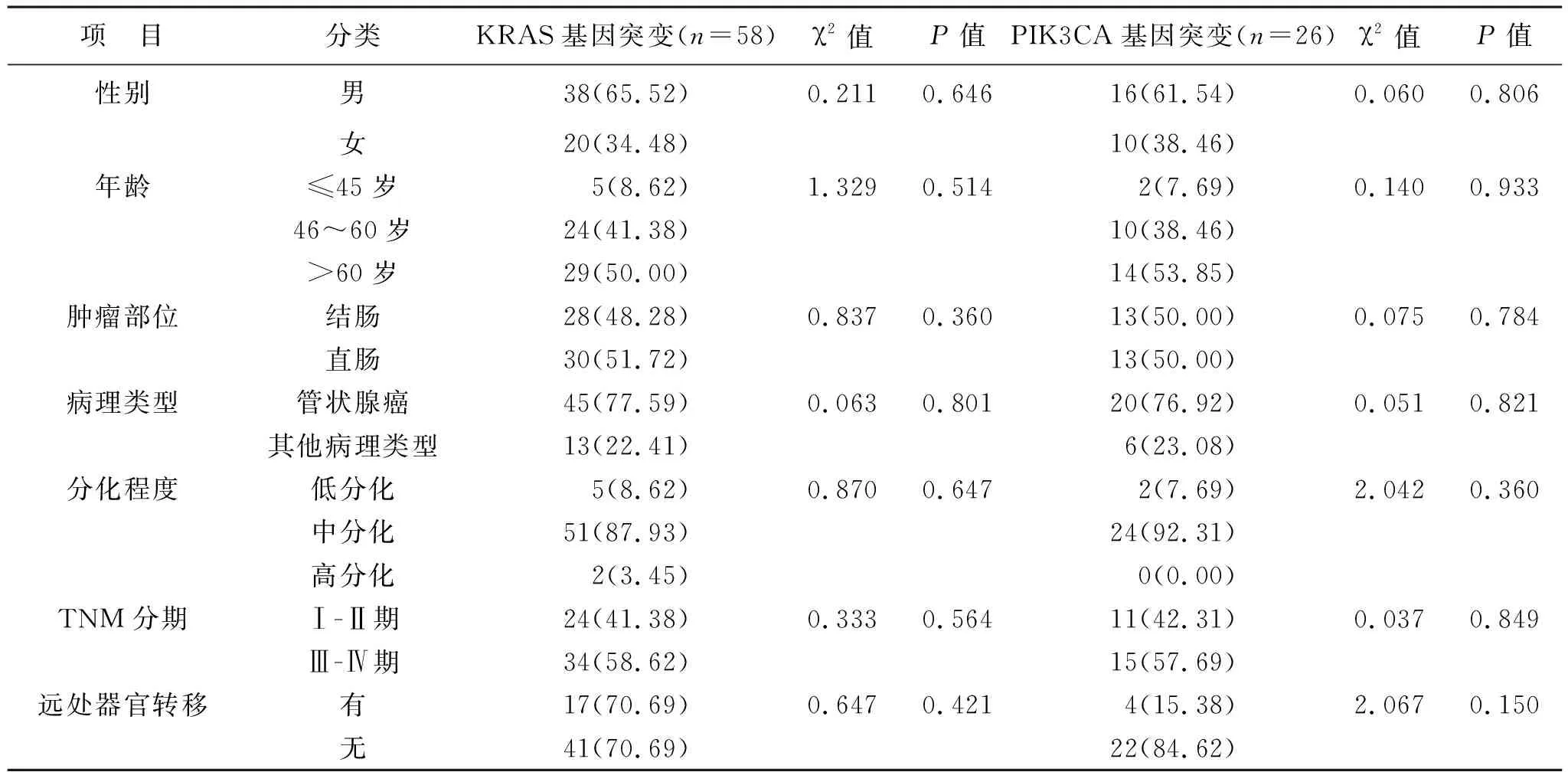
表1 KRAS、PIK3CA基因突变与CRC患者临床病理特征的关系[例(%)]
2.3 KRAS、PIK3CA基因突变与血常规的关系 见表2。①KRAS突变组和KRAS野生组RBC、PDW、NEU%、MCV、MCH、LYM%、Hb、HCT、BAS%低于对照组(均P<0.05),而KRAS突变组和KRAS野生组比较无统计学差异(均P>0.05)。KRAS突变组WBC、PLT高于对照组,而MCHC低于对照组(均P<0.05),而KRAS野生组和对照组比较无统计学差异(均P>0.05)。三组PLCR、PCT、NRBC、MPV、MON%、EOS%比较无统计学差异(均P>0.05)。②PIK3CA突变组、PIK3CA野生组RBC、MCV、MCH、LYM%、Hb低于对照组,NEU%、HCT高于对照组,且PIK3CA突变组MCHC、Hb低于PIK3CA野生组(均P<0.05),其余比较无统计学差异(均P>0.05)。PIK3CA突变组PCT高于对照组,MCHC低于对照组(均P<0.05),而PIK3CA野生组和对照组比较无统计学差异(均P>0.05)。PIK3CA野生组PDW、BAS%低于对照组(均P<0.05),PIK3CA突变组和正常对照组比较无统计学差异(均P>0.05)。三组WBC、PLT、PLCR、NRBC、MPV、MON%、EOS%比较无统计学差异(均P>0.05)。

表2 KRAS、PIK3CA基因突变与血常规的关系
2.4 KRAS、PIK3CA基因突变与肿瘤标志物的关系 见表3。①KRAS突变组CEA、CA724、CA199高于对照组,CA199高于KRAS野生组(均P<0.05)。三组AFP比较差异无统计学意义(P>0.05)。对照组和KRAS野生组CEA、CA724、CA199、AFP比较差异无统计学意义(均P>0.05)。②PIK3CA突变组和PIK3CA野生组CEA高于对照组,但PIK3CA突变组与PIK3CA野生组比较差异无统计学意义(P>0.05)。PIK3CA野生组CEA、CA724、CA199高于对照组,AFP低于对照组(均P<0.05),但PIK3CA突变组和对照组比较差异无统计学意义(均P>0.05)。

表3 KRAS、PIK3CA基因突变与肿瘤标志物的关系
3 讨 论
目前,CRC病因尚未完全清楚,但有研究[7]证实CRC的发生发展与饮食、生活方式等环境因素及遗传因素相关。更有学者认为CRC发病的遗传因素与地域差异有关[8]。手术切除是早期CRC的治疗手段,但对发生转移者常辅助药物化疗。近年来,潜在分子序列已被发现,较为常见的是EGFR单克隆抗体,针对于该受体研究的靶向治疗药物使得CRC的治疗步入个体化、精准化时代,患者生存率得以提高,同时可避免普通化疗带来的不良反应,提升了患者生存质量[9-10]。而CRC是多基因突变作用的结果,所以导致不同个体对靶向药物治疗反应差异较大,因此预测不同个体对靶向药物的反应可避免过度治疗,同时减少患者不必要的经济负担[11]。
KRAS基因是EGFR信号转导通路中下游调控基因。研究[12]表明,KRAS基因突变在CRC中占30%~40%,携带KRAS基因突变者会对西妥昔单抗或帕尼单抗产生耐药。这与KRAS基因突变导致EGFR信号转导通路激活有关,因此对于KRAS基因突变的CRC不考虑抗EGFR靶向药物治疗[13]。此外,能够使EGFR信号转导通路独立且激活的因素会导致CRC对分子靶向药物产生耐药,而EGFR信号转导系统下游通路中的NRAS、BRAF、PIK3CA基因突变会导致EGFR信号转导通路持续激活,所以对KRAS野生型基因CRC约30%~40%会对抗EGFR靶向药物产生应答并取得疗效,这可能与NRAS、BRAF、PIK3CA基因突变有关[14]。PIK3CA是编码EGFR的下游效应蛋白p110a激酶,其基因突变在5.6%~18%的CRC中被报道,可与RAS和BRAF基因突变共存,80%以上的PIK3CA基因突变发生在第9、20外显子[15]。PIK3CA突变可激活p110a蛋白激酶,进而激活EGFR下游信号通路,诱导肿瘤发生及生长[16]。有研究[17]显示,携带PIK3CA基因20外显子突变的CRC患者反应率低于携带PIK3CA基因野生型者,且PIK3CA基因20外显子突变与较短的无进展生存期呈正相关。因此,PIK3CA基因20外显子的突变可预估对西妥昔单抗或帕尼单抗是否产生耐药。本研究结果显示,KRAS基因突变率为54.2%,PIK3CA基因突变率为24.3%,提示赤峰地区CRC患者KRAS、PIK3CA基因突变率较高,考虑与赤峰地区所处内蒙古的地理环境及族群生活习性有关;KRAS、PIK3CA基因同时突变率为16.8%,提示CRC患者存在PIK3CA、KRAS基因双突变,因此临床应对两者进行检测。分析其与临床病理特征的关系发现,KRAS和PIK3CA基因突变与性别、年龄、肿瘤部位、病理类型、分化程度、TNM分期及远处器官转移无关。而蒋洪波等[18]研究显示,CRC患者KRAS基因突变与性别、肿瘤部位有关。白杨等[19]研究显示,CRC患者PIK3CA基因突变与性别、年龄和病理分期均无关。本研究与上述研究略有不同,考虑与样本量、地区个体差异等有关。
外周血常规检查是临床上较理想且简便的检测手段,可作为评估CRC病情发展的指标,因此本研究分析血常规与KRAS、PIK3CA基因突变的关系,结果显示KRAS突变组和KRAS野生组RBC、PDW、NEU、MCV、MCH、LYM%、Hb、HCT、BAS%低于对照组,KRAS突变组WBC、PLT高于对照组,MCHC低于对照组;PIK3CA突变组和PIK3CA野生组RBC、MCV、MCH、LYM%、Hb低于对照组,NEU%、HCT高于对照组,且PIK3CA突变组MCHC、Hb低于PIK3CA野生组;PIK3CA突变组PCT高于对照组,MCHC低于对照组,PIK3CA野生组PDW、BAS%低于对照组,提示RBC、PDW、NEU%、MCV、MCH、LYM%、Hb、HCT、BAS%与KRAS和PIK3CA基因突变有关,临床上可将其作为CRC的初筛指标,但特异性较低,因此需结合其他检查确诊。
近年来,肿瘤标志物已用于肿瘤的诊断。CEA、CA724、CA199、AFP为临床常见肿瘤标志物,其中CEA是广泛性肿瘤标志物,存在于消化系统肿瘤血清中,是筛查和诊断癌细胞复发、转移的标志物;CA724属于黏蛋白类癌胚抗原,是检测消化道肿瘤的标志物;CA199可用于消化道肿瘤的特异性诊断;AFP是诊断原发性肝癌最敏感的指标,现已用于诊断、评估疗效及判断复发[20]。因此,本研究分析其与KRAS、PIK3CA基因突变的关系,结果显示KRAS突变组血清CEA、CA724、CA199水平高于对照组,CA199高于KRAS野生组;PIK3CA突变组和PIK3CA野生组CEA高于对照组,PIK3CA野生组血清CEA、CA724、CA199水平高于对照组,AFP低于对照组,提示赤峰地区CEA、CA199升高可作为CRC的主要筛查指标,CA724升高在一定程度上反映了KRAS基因突变的可能,而AFP在排除其他干扰因素影响下显著降低,加之CEA、CA724、CA199的显著升高,有助于判断CRC患者PIK3CA基因是否处于野生状态的可能。
综上所述,赤峰地区CRC患者KRAS、PIK3CA基因突变率较高,且与RBC、PDW、NEU%、MCV、MCH、LYM%、Hb、HCT、BAS%及血清CA199、CEA水平有关,可作为CRC的筛查指标,且联合检测KRAS、PIK3CA基因对指导临床制定治疗方案具有重要意义。同时,临床应对RBC、PDW、NEU%、MCV、MCH、LYM%、Hb、HCT、BAS%以及血清CA199、CEA水平进行监测,以提高CRC检出率。

