结直肠癌术后辅助化疗患者肠内营养不耐受影响因素及小野寺预后营养指数预测价值分析
张晓峰,冯 景,季飞燕,凌 莹,郝 华
(1.同济大学附属杨浦医院临床营养科,上海 200090;2.同济大学附属杨浦医院病理科,上海 200090)
结直肠癌指发生于直肠或结肠的恶性肿瘤,其中以直肠癌更常见,病理类型以腺癌最常见,是全球范围内发病率第三高的恶性肿瘤[1]。在我国,结直肠癌患者每年新发病例数高达37.6万例,每年死于结直肠癌的患者超过19万,并且近年来我国结直肠癌的发病率与病死率均呈现逐年上升的趋势[2-3]。化疗、放疗以及手术治疗是目前结直肠癌患者常用的治疗方式。大多数结直肠癌患者在初次确诊时已经处于疾病晚期,如果检查发现肿瘤偏大,需先进行化疗使肿瘤缩小再考虑手术切除[4]。近年来,尽管结直肠癌的化疗药物和化疗方案均都取得显著进展,但化疗对患者自身的损伤依然是不可避免的,化疗常常给结直肠癌患者带来严重的不良反应,很多患者因化疗引起的营养不良或免疫功能下降而不得不放弃治疗[5-6]。
肠内营养是向有营养风险或营养不良患者提供的营养治疗,是临床上首选的营养支持方法,不仅可以有效地改善患者营养不良和免疫功能低下,而且有助于提高化疗患者的临床疗效和延长其生存期[7-8]。预后营养指数是临床上用于评估患者营养状况的主要方法,最早由小野寺等人提出,故又被称为小野寺预后营养指数(Onodera Prognostic Nutrition Index,OPNI)[9]。本研究分析76例结直肠癌术后辅助化疗患者肠内营养不耐受情况的影响因素以及与OPNI的相关性,探讨OPNI对结直肠癌术后辅助化疗患者肠内营养不耐受的预测价值。
1 对象与方法
1.1 研究对象 选取2020年10月至2021年12月在我院接受结直肠癌术后辅助化疗的患者76例为研究对象,其中男性48例,女性28例;年龄35~72岁,平均(56.8±12.4)岁。病例纳入标准:年龄18~80岁;符合结直肠癌临床诊断标准;患者或家属签署知情同意书;患者接受化疗治疗且研究期间存活;患者接受肠内营养辅助治疗;精神、智力正常,可完成本研究所有评估。排除标准:合并其他恶性肿瘤;合并严重心脑血管疾病,或肝、肾等器官功能障碍;哺乳期或妊娠期妇女;既往有胃肠道疾病史;既往腹部手术患者;临床资料不完整。本研究经医院伦理委员会批准后进行。
1.2 研究方法
1.2.1 临床资料收集:收集患者临床资料,包括年龄、性别、体重指数(BMI)、肿瘤直径、肿瘤分化程度、淋巴结转移情况、远处转移情况、TNM分期以及腹膜转移情况等。
1.2.2 肠内营养不耐受评估与分组:根据2012年欧洲危重病医学学会制定的肠内营养不耐受标准对结直肠癌术后辅助化疗患者肠内营养不耐受情况进行评估。具体标准:患者在被实施肠内营养(口服肠内营养混悬液)后出现胃肠道不良反应,包括呕吐或反流、腹胀、胃痛、腹泻以及便秘等;或给予肠内营养72 h后,无法满足每日20 kcal/kg的能量需求;或因其他临床原因终止肠内营养。评估后将患者分别纳入营养耐受组和营养不耐受组。
1.2.3 OPNI评估与分组:所有患者在实施肠内营养前1周,抽取外周血5 ml进行常规血液和生化检查,并根据公式计算OPNI。OPNI=白蛋白(g/L)+5×淋巴细胞计数(109/L)。根据OPNI将患者分为营养不良组(OPNI<45)和营养良好组(OPNI≥45)。

2 结 果
2.1 结直肠癌术后辅助化疗患者肠内营养不耐受发生情况 本研究共纳入结直肠癌术后辅助化疗患者76例,有35例(46.05%)患者发生肠内营养不耐受,其中发生呕吐或反流、腹胀、胃痛、腹泻以及便秘的患者分别有12例(34.29%)、10例(28.57%)、5例(14.29%)、5例(14.29%)和3例(8.57%)。患者在进行肠内营养(2.12±1.27)d后出现肠内营养不耐受,平均持续时间(1.42±0.62)d,其中9例(25.71%)因肠内营养不耐受而中止肠内营养。
2.2 结直肠癌术后辅助化疗患者肠内营养不耐受单因素分析 见表1。单因素分析结果显示,肿瘤分化程度、肿瘤直径、腹膜转移、远处转移以及TNM分期是结直肠癌术后辅助化疗患者肠内营养不耐受的影响因素(均P<0.05)。

表1 结直肠癌术后辅助化疗患者肠内营养不耐受单因素分析[例(%)]
2.3 结直肠癌术后辅助化疗患者肠内营养不耐受影响因素Logistic回归分析 见表2。以结直肠癌术后辅助化疗患者肠内营养不耐受单因素分析中差异具有统计学意义的项目为自变量,以是否发生肠内营养不耐受为因变量,进行Logistic回归分析。结果显示,肿瘤分化程度、肿瘤细胞腹膜转移和TNM分期是结直肠癌术后辅助化疗患者肠内营养不耐受的独立危险因素(均P<0.05)。
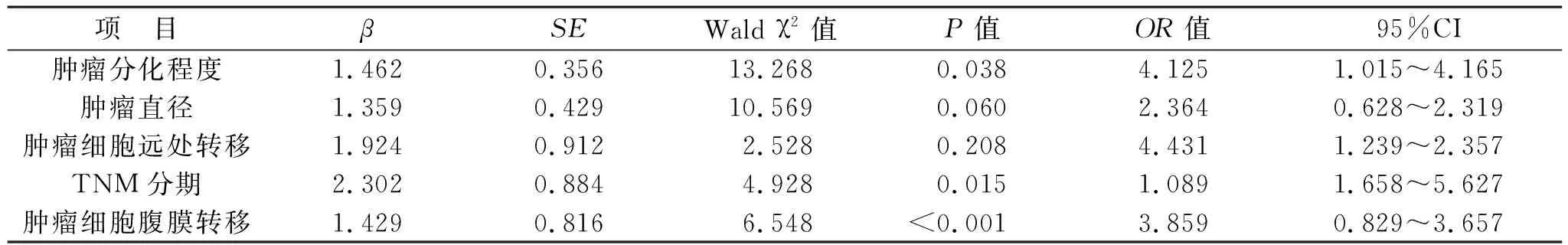
表2 结直肠癌术后辅助化疗患者肠内营养不耐受Logistic回归分析
2.4 OPNI与结直肠癌患者临床病理特征相关性分析 见表3。根据OPNI评估结果,营养良好组和营养不良组各38例。OPNI与肿瘤分化程度、TNM分期、远处转移、腹膜转移以及肠内营养耐受存在相关性(均P<0.05)。
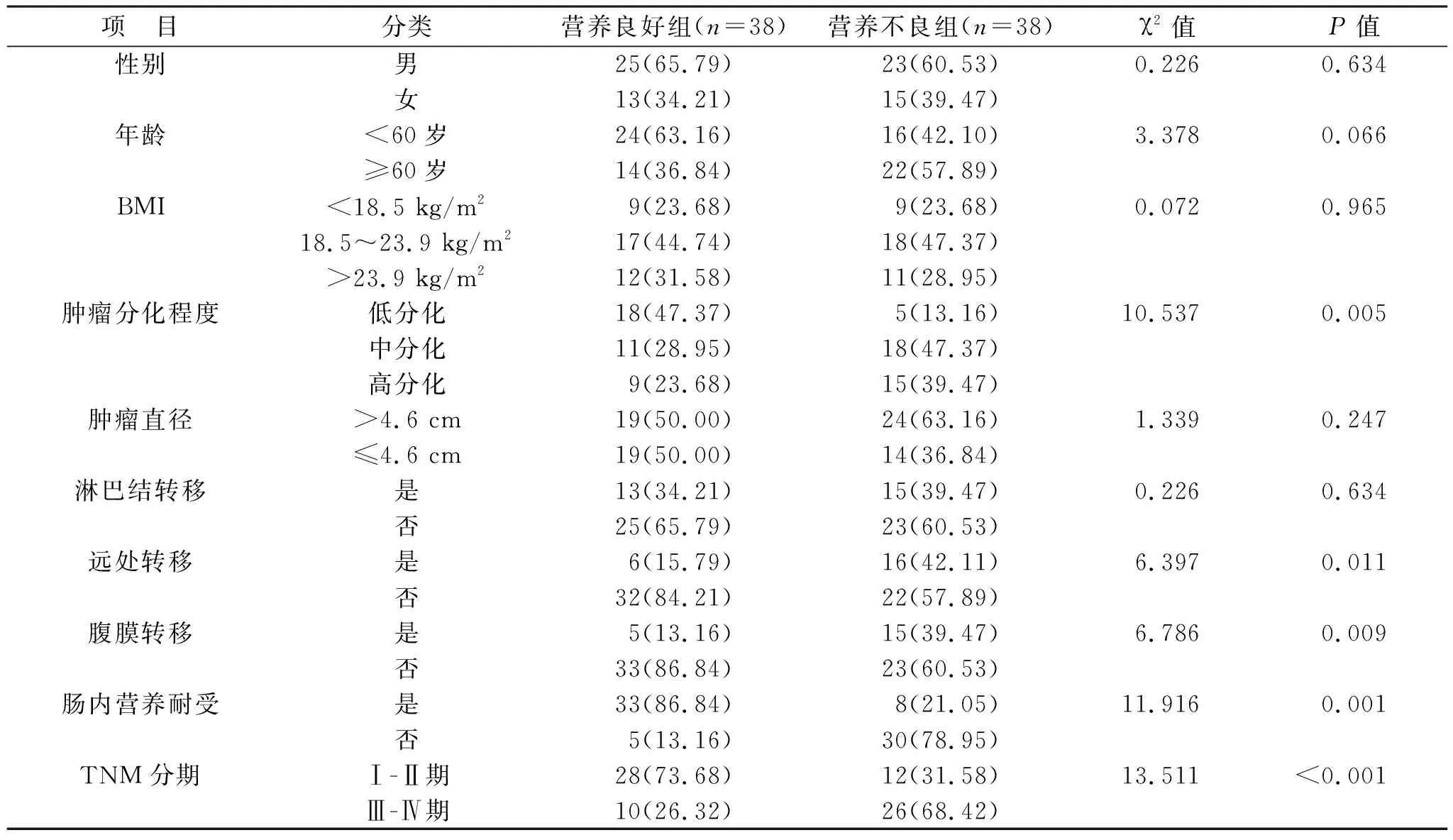
表3 OPNI与结直肠癌患者临床病理特征的相关性[例(%)]
2.5 OPNI对结直肠癌术后辅助化疗患者肠内营养不耐受的预测价值 见图1。ROC曲线分析结果显示,OPNI预测结直肠癌术后辅助化疗患者肠内营养不耐受的曲线下面积为0.874,在最佳截断值44.5预测肠内营养不耐受的敏感度为89.40%,特异度为88.70%。
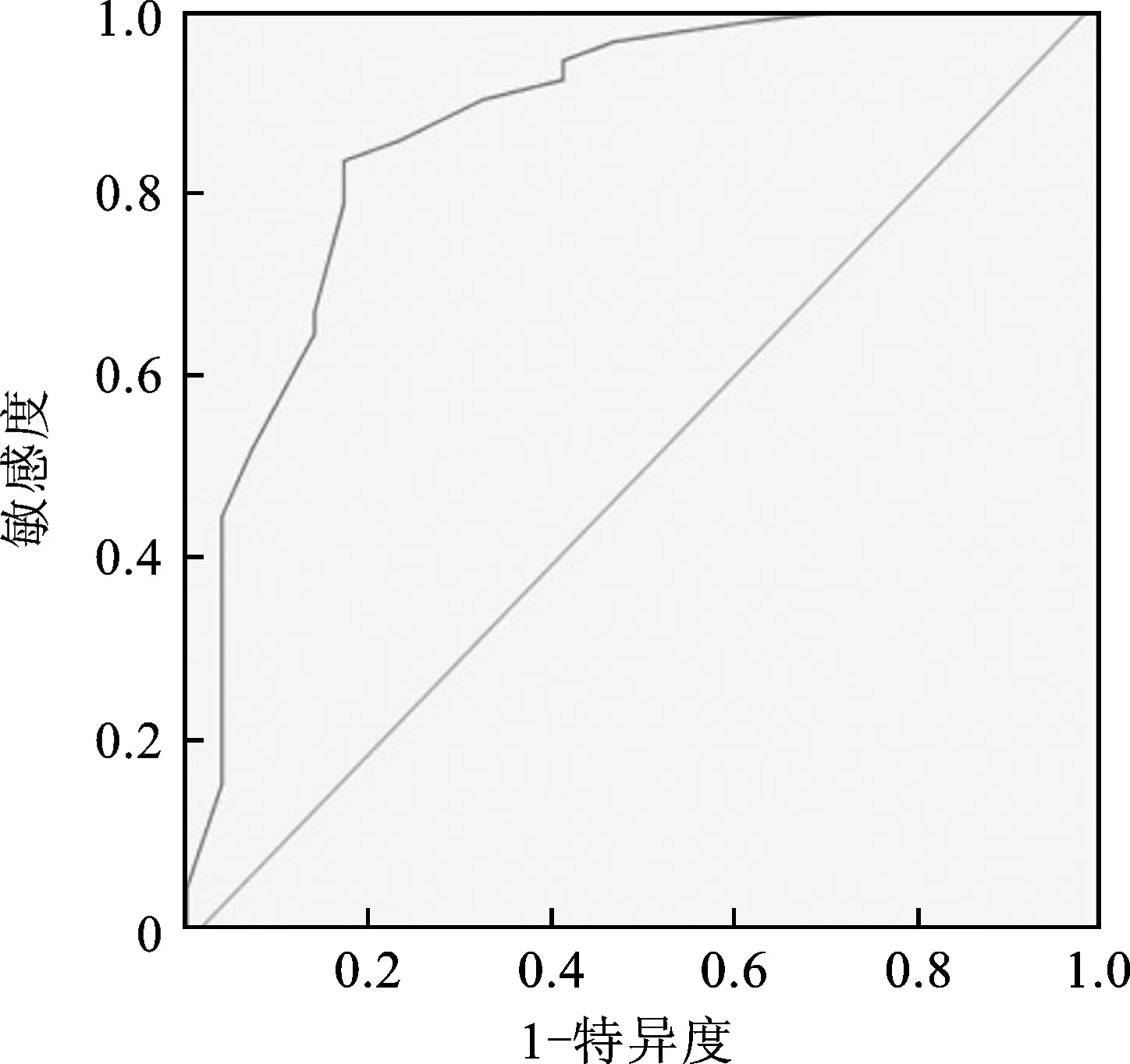
图1 OPNI预测结直肠癌术后辅助化疗患者肠内营养不耐受ROC曲线
3 讨 论
结直肠癌是大肠上皮来源的肿瘤,包括结肠癌和直肠癌,其发病原因目前未知,但认为与环境、饮食习惯和遗传等多种因素有关[10-11]。手术治疗是结直肠癌患者常见的治疗方式,但研究[12]发现约50%结直肠癌患者在术前已经出现体重丢失,约20%患者术前已经存在营养不良,这可能与疾病本身和术前化疗有关。此外,研究[13-16]还发现术前体重丢失超过3 kg的结直肠癌患者病死率是体重丢失低于3 kg患者的2倍,所以良好的营养干预和治疗不仅可以提高患者对手术的耐受度、降低手术并发症的发生率、节约住院花费和缩短住院时间,还可以延长患者生存期。
本研究给予76例结直肠癌术后辅助化疗患者肠内营养,结果35例患者发生肠内营养不耐受,不良反应包括呕吐或反流、腹胀、腹痛、腹泻以及便秘,这表明结直肠癌术后辅助化疗患者肠内营养不耐受发生率较高,与王爱华等[17]研究结果一致。王爱华等[17]在总结结直肠癌患者肠内营养支持时指出,结直肠癌患者围手术期肠内营养不耐受发生率为30.5%~75.0%,主要与患者自身体质、病情以及临床药物使用等多种因素有关。对于出现肠内营养不耐受的结直肠癌患者,可通过抬高床头、辅助给予胃动力药物或麻醉拮抗剂等方式促进胃肠道蠕动,从而缓解肠内营养不耐受状况[18-19]。在本研究中,26例肠内营养不耐受患者经干预后已可耐受肠内营养,9例患者因不耐受而中止肠内营养。
进一步分析结直肠癌术后辅助化疗患者出现肠内营养不耐受的影响因素,单因素和多因素Logistic回归分析表明肿瘤分化程度、腹膜转移和TNM分期是结直肠癌术后辅助化疗患者发生肠内营养不耐受的独立危险因素,表明患者病情是影响化疗期间肠内营养不耐受发生的主要影响因素。曾佳琪等[20]在分析122例恶性肿瘤患者肠内营养不耐受状况时发现,使用钾制剂、镇静药物以及低蛋白血症是引起52例恶性肿瘤患者出现肠内营养不耐受的主要危险因素。这与本研究不同,可能原因是该研究纳入的患者为接受手术治疗的恶性肿瘤患者,术后需要接受多种药物治疗,而本研究纳入的患者主要为进行化疗的结直肠癌术后患者,除化疗药物外未接受其他药物治疗。
此外,本研究还发现,结直肠癌术后辅助化疗患者肿瘤分化程度、TNM分期、远处转移、腹膜转移以及肠内营养不耐受与OPNI显著相关,并且ROC曲线分析显示OPNI预测结直肠癌术后辅助化疗患者肠内营养不耐受的曲线下面积为0.874,敏感度和特异度分别为89.4%和88.7%,表明可通过OPNI对结直肠癌术后辅助化疗患者是否实施肠内营养支持进行指导,这与宁洁等[21]研究结果一致。宁洁等[21]对120例结直肠癌患者进行营养干预时发现,基于预后营养指数而实施营养干预的56例观察组患者不仅术后排气排便和进食时间短于64例常规营养干预的对照组患者,而且术后感染率更低,表明基于预后营养指数对结直肠癌患者进行营养干预指导可显著改善患者营养状况并降低并发症的发生率。科学合理的肠内营养支持不仅可以帮助患者改善营养状况,提高免疫力,还可以降低并发症发生率并延长患者生存期[22]。
综上所述,肿瘤分化程度、腹膜转移和TNM分期是结直肠癌术后辅助化疗患者肠内营养不耐受的独立危险因素。OPNI对结直肠癌术后辅助化疗患者肠内营养不耐受具有良好的预测价值。但同时需要指出,本研究仅纳入76例结直肠癌术后辅助化疗患者,样本量有限,因此本研究结论尚需多中心大样本临床研究进一步验证。

