中间入路与侧方入路腹腔镜右半结肠癌根治术疗效对比研究
仝 聪,周哲琦,李 毅,肖 扬,阎立昆,王国荣
(1.陕西省人民医院普外一科,陕西 西安 710068;2.陕西省人民医院肛肠外科,陕西 西安 710068)
结直肠癌为胃肠道恶性肿瘤,其发病率与病死率在2018年国内恶性肿瘤数据中分别位于第3位和第5位,且近年均呈上升趋势[1-3]。结直肠癌治疗手段包括手术、化疗、放疗等,其中根治性手术可有效延长患者生存期[4]。既往结肠癌根治手术为创伤较大的开腹手术,随着医疗技术的发展与进步,创伤更小的腹腔镜术式得到应用且趋于成熟,但目前腹腔镜右半结肠癌根治术的入路较多,尚无统一标准[5-6]。侧方入路和中间入路是腹腔镜右半结肠癌根治术中临床医师较常选择的两种入路方式,前者具有较好的操控性与安全性,后者更符合无瘤要求,但对医师手术操作技巧要求更高,关于两种入路的选择仍存在争议[7-8]。基于此,本研究比较腹腔镜右半结肠癌根治术中侧方入路与中间入路两种不同手术入路的疗效,为临床选择提供参考依据。
1 资料与方法
1.1 一般资料 对2019年1月至2022年1月于陕西省人民医院行腹腔镜右半结肠癌根治术治疗的106例右半结肠癌患者的临床资料进行回顾性分析,根据手术入路差异分为中间组(56例,中间入路)和侧方组(50例,侧方入路),两组患者一般资料比较差异无统计学意义(均P>0.05),见表1。病例纳入标准:诊断参照《中国结直肠癌诊疗规范(2017年版)》[9]标准,经术后病理确诊为右半结肠癌;首次接受手术治疗;于我院顺利完成腹腔镜右半结肠癌根治术;术前未接受其他抗肿瘤治疗;临床资料完整。排除标准:合并其他恶性肿瘤;存在肠梗阻或溃疡性结肠炎;既往有腹部手术史;合并严重内分泌系统、血液系统、免疫系统疾病;合并其他消化道疾病;临床资料缺失。本研究符合医学伦理学规定,已征得患者同意且均与之签署知情同意书。
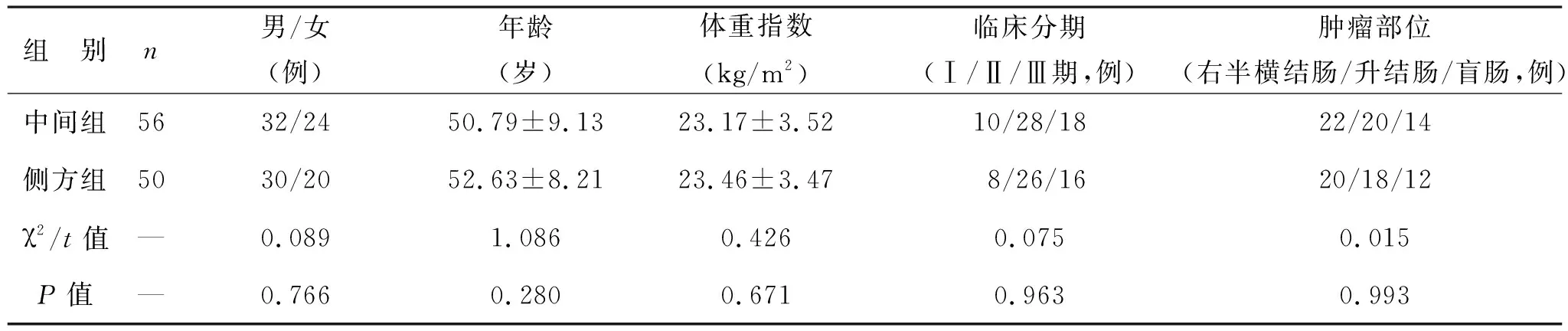
表1 两组患者一般资料比较
1.2 手术方法 患者均采取全麻,体位取轻度头低脚高仰卧位,采用五孔法进行腹腔镜手术操作。主操作孔取脐下1 cm小切口,常规建立CO2气腹。辅助操作孔取两侧正反麦氏点、两侧肋下缘。术后均给予常规抗感染、镇痛、饮食指导及康复锻炼指导。
1.2.1 侧方组:腹腔镜下行腹腔探查,仔细向上游离升结肠、盲肠、回肠,将肠组织及横结肠网膜向左上腹推送,将患者体位换至头高脚低仰卧位,再将小肠向左下方牵引推移,将胃结肠、肝结肠韧带离断,将右半结肠完全游离并切断,对应血管均结扎处理,常规清扫淋巴结。体位再次变更,取平卧位,取脐上正中约5 cm纵行切口,以无菌塑料套保护,拉出游离肠管,将其拉至体外后切除,以吻合器处理残端,冲洗腹腔,常规置管引流,关闭切口。
1.2.2 中间组:腹腔镜下进行腹腔探查,以明确病灶位置、肿瘤大小及邻近脏器的整体情况,确定切除范围。将大网膜推向头侧位置,牵拉横结肠推移小肠至左下方,以便快速寻找肠系膜血管。右结肠血管、回结肠血管和结肠中血管均从根部结扎处理。将胃结肠、肝结肠韧带离断,常规清扫淋巴结。将患者体位换至头低位,向上腹方向推移小肠、结肠,切开右侧腹膜,游离并切除右半结肠,吻合器处理残端,冲洗腹腔,常规置管引流,关闭切口。
1.3 观察指标
1.3.1 临床疗效:包括显效、有效和无效。疗效标准[10]:经CT、MRI影像学检查,病灶完全切除且肿瘤标志物水平恢复正常,为显效;基本无病灶残留,肿瘤标志物水平显著降低,为有效;肿瘤标志物下降不明显,为无效。总有效=(显效+有效)例数/总例数×100%。
1.3.2 围手术期参数:统计手术时间、术中输血量、淋巴结清扫数、切除标本长度、引流管拔除时间以及中转开腹等各项参数。
1.3.3 胃肠功能指标:统计术后肠鸣音恢复、肛门排气、流质饮食恢复时间及排便时间。
1.3.4 血清肿瘤标志物水平:采集患者术前、术后7 d血液标本,采用化学发光法检测糖蛋白抗原19-9(CA199)、胸苷激酶1(TK1)、Polo样激酶1(Plk1)水平。
1.3.5 外周血T淋巴细胞亚群水平:采集患者术前、术后7 d血液标本,采用流式细胞仪检测外周血T淋巴细胞亚群,包括CD3+、CD4+、CD8+细胞水平,计算CD4+/CD8+。
1.3.6 术后并发症:统计术后出现的并发症。

2 结 果
2.1 两组患者临床疗效比较 见表2。中间组与侧方组手术治疗总有效率比较差异无统计学意义(χ2=0.471,P=0.492)。
2.2 两组患者围手术期参数比较 见表3。相比于侧方组,中间组手术时间、引流管拔除时间缩短,术中出血量减少,淋巴结清扫数增加(均P<0.05)。两组切除标本长度、中转开腹率比较差异无统计学意义(均P>0.05)。
2.3 两组患者术后胃肠功能指标比较 见表4。相比于侧方组,中间组肠鸣音恢复、肛门排气、流质饮食恢复时间缩短(均P<0.05)。两组排便时间比较差异无统计学意义(P>0.05)。
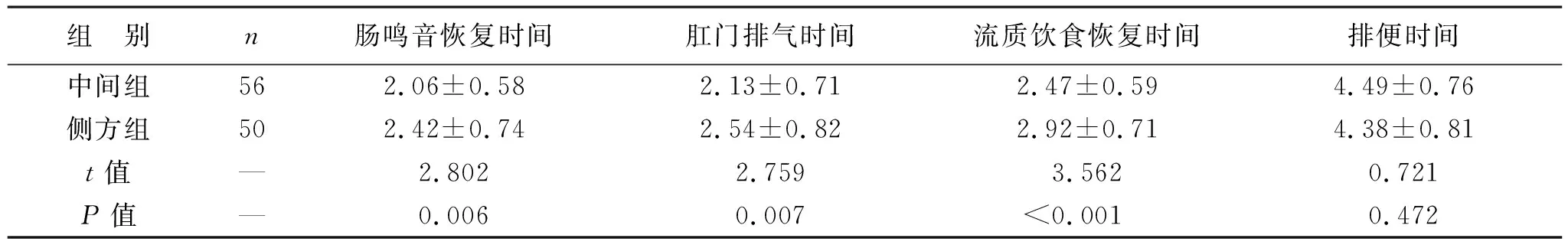
表4 两组患者术后胃肠功能指标比较(d)
2.4 两组患者手术前后血清肿瘤标志物水平比较 见表5。术后7 d,两组血清肿瘤标志物CA199、TK1、Plk1水平较术前降低,且中间组各指标低于侧方组(均P<0.05)。

表5 两组患者手术前后血清肿瘤标志物水平比较
2.5 两组患者手术前后外周血T淋巴细胞亚群水平比较 见表6。术后7 d,两组CD3+、CD4+、CD4+/CD8+水平较术前降低,但中间组各指标高于侧方组(P<0.05)。

表6 两组患者手术前后外周血T淋巴细胞亚群水平比较
2.6 两组患者术后并发症发生情况比较 见表7。中间组和侧方组并发症发生率比较差异无统计学意义(χ2=0.052,P=0.820)。

表7 两组患者术后并发症发生情况比较[例(%)]
3 讨 论
随着微创外科的发展,腹腔镜术式可达到与传统开腹手术相当的切除及淋巴结清扫效果,且相较于传统开腹术式还具有术野清晰、手术创伤少、患者疼痛轻、术后恢复快等优势,已成为治疗结直肠癌的首选手术方式[11]。但结直肠解剖位置复杂,且腹腔镜手术在有限空间中进行,与传统开腹手术相比缺乏手触觉反馈,手术入路和术中操作可能对腹部其他脏器造成损伤,不利于患者术后恢复[12]。因此,选择何种入路方式能够减少手术损伤并确保手术效果已成为临床研究热点。
腹腔镜手术发展初期,外科医师在行腹腔镜右半结肠癌根治术时多沿用开腹手术的习惯选择侧方入路。侧方入路有突出的解剖学标志,易于掌握,从侧腹膜寻找天然间隙后游离结肠系膜可直接将右半结肠拉出腹腔,迅速清扫淋巴结,但侧方入路并不符合肿瘤根治术的“no-touch”原则,且侧方入路不能充分暴露肠系膜血管,使患者出血风险增高,若分离肠系膜时深度过大又易造成腹膜后器官的损伤,操作难度也随之增大[13-14]。而中间入路则符合“no-touch”原则,可准确定位系膜间隙,充分显露并结扎肠系膜血管,沿Toldt筋膜间隙游离结直肠及其系膜和侧腹膜,对淋巴结清扫更为彻底,但该入路对术者操作技术要求较高[15]。目前,对于腹腔镜右半结肠癌根治术选择中间入路还是侧方入路尚无定论,仍需临床研究验证。本研究比较中间入路与侧方入路的手术效果,结果显示两种入路手术治疗的临床疗效并无统计学差异;相较于侧方入路,中间入路患者各项围手术期参数(除切除标本长度、中转开腹率)、术后胃肠功能恢复时间更具优势,提示腹腔镜右半结肠癌根治术选择中间入路疗效确切,且术程短、出血少,更有利于彻底清扫淋巴结和患者术后胃肠功能恢复,这可能与中间入路能够充分显露肠系膜血管、更易识别Toldt筋膜间隙使该层面解剖流畅有关。但也有研究[16]指出,相较于中间入路,侧方入路操作简单,手术时间更长,与本研究结果相反,这可能与本研究术者能够熟练掌握中间入路操作有关。此外,还有研究[17]指出,在患者腹部脂肪较多时,中间入路不利于暴露肠系膜血管和回结肠从而降低手术创伤,效果会被大大限制,但本研究纳入患者的体重指数偏低,尚无法比较,有待后续研究验证。
结肠癌根治术的目的是彻底清除病灶,合理并充分清扫淋巴结,消除肿瘤细胞对机体的不良影响。临床中可通过检测肿瘤标志物水平判断患者肿瘤恶性程度,同时还可将该类指标用于评估手术效果及患者预后。CA199是与消化系统肿瘤发生、发展密切相关的常用标志物;TK1是参与机体脱氧核糖核酸合成过程的胸苷酸激酶,其表达水平能够在一定程度上反映肿瘤细胞恶性程度;Plk1为促增殖分子,在细胞周期运行、细胞质分离等环节具有重要作用,在肿瘤细胞内呈高表达状态,是结直肠癌预后不良的独立影响因子[18-20]。本研究中,中间入路患者血清CA199、TK1、Plk1水平改善状况均优于侧方入路患者,说明腹腔镜右半结肠癌根治术中选择中间入路较侧方入路更有利于减轻恶性肿瘤的影响,这可能与中间入路更符合肿瘤根治术操作原则以及更有利于彻底清除肿瘤病灶、降低肿瘤细胞扩散风险有关。此外,恶性肿瘤具有细胞免疫抑制作用,可能会导致患者出现不同程度的免疫功能下降,而腹腔镜右半结肠癌根治术的手术创伤虽较传统开腹手术降低,但手术操作仍会引起机体应激,对免疫功能造成一定影响[21]。本研究中,两组患者术后外周血T淋巴细胞亚群水平均有所降低,但术后短期内中间入路患者外周血T淋巴细胞亚群水平高于侧方入路,说明中间入路的腹腔镜右半结肠癌根治术相较于侧方入路对患者免疫功能的影响更小,这可能也是中间入路患者术后胃肠功能恢复更好的原因之一。本研究还比较了两组术后并发症情况,发现差异并无统计学意义,提示中间入路与侧方入路安全性一致。但本研究样本量较少,且未能观察患者长期预后情况,有待在后续研究中改进。
综上所述,在腹腔镜右半结肠癌根治术入路选择中,中间入路相较于侧方入路具有创伤少、胃肠功能恢复快、肿瘤学安全性高、对免疫功能影响小的优势。但对于肥胖患者中间入路可能难以充分显露系膜血管,术野受限,使其效果受限,临床中可根据患者实际情况合理选择入路进行手术。

