神经干细胞促进大鼠局部神经元降钙素基因相关肽生成及脊柱骨折愈合机制研究
李 鹏,李晓博,王林钦
(1.安康市人民医院脊柱外科,陕西 安康 725000;2.西北妇女儿童医院骨科,陕西 西安 710061)
脊柱骨折会对中枢神经系统(Central nervous system,CNS)造成损伤,导致损伤水平以下由脊髓支配的身体部位的肌肉功能、感觉或自主功能发生暂时或永久性变化[1-2]。目前,脊髓损伤没有有效的治疗方法,主要是因为成人CNS中的大多数神经元都是终末分化的,受伤后无法再生。研究[3-4]表明,脊柱骨折引起的骨丢失是骨形成受到抑制和骨吸收增加所致。其病因复杂,其中缺乏机械刺激和营养不足被认为是脊柱骨折相关性骨质疏松症发生的重要原因[5-6]。目前可用的非药物疗法主要是对骨骼施加机械力(如站立、辅助行走和体育锻炼),而疗效仍有争议[7-8]。此外,这些方法对于大多数脊柱骨折患者来说,不方便且难以实施。最近在一些成熟的CNS区域(如脊髓)中发现了少量的神经干细胞(Neural stem cells,NSC)。神经元和NSC的损伤后修复和再生对于脊髓损伤的治疗至关重要。NSC可以在体外维持在积极增殖状态,并能够分化为成熟的神经元和神经胶质,是用于移植修复受损的CNS的理想种子细胞[9-10]。用于治疗脊柱骨折的NSC移植已成为一种越来越有吸引力的策略。降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)是一种含37个氨基酸的肽,主要在背根神经节和脊髓腹角合成,其沿着轴突运输到全身感觉神经纤维的外周和中央末端,在脊髓中浓度最高。CGRP在修复组织、激活其同源G蛋白偶联受体及启动细胞内信号传导方面发挥着关键作用。在脊柱周围等组织损伤后,CGRP参与血管舒张、感觉传递、免疫调节和神经再生。本研究通过建立脊髓损伤(Spinal cord injury,SCI)模型探讨NSC促进大鼠局部神经元中CGRP生成和脊柱骨折愈合的机制。
1 材料与方法
1.1 实验动物 体重180~220 g的30只成年SD雄性大鼠购自陕西省中医药研究院食品化妆品检验检定中心,许可证号:SYXK(陕)2018-009。所有动物都被安置在空气过滤、湿度控制的房间中,12 h光照/12 h黑暗循环,室温下饲养。所有动物实验方案均经大学实验动物护理和使用伦理委员会批准,并按照动物福利国际标准和中国动物福利立法进行。
1.2 主要试剂 胰高血糖素酶联免疫吸附(ELISA)检测试剂盒(批号:PG357)购自上海碧云天生物科技有限公司;蛋白定量检测试剂盒(批号:23227)购自美国Thermo Fisher公司;辣根过氧化物酶(HRP)标记的兔抗大鼠IgG一抗和二抗(批号:ab6734、ab6734)购自英国Abcam公司。
1.3 实验方法
1.3.1 SCI建模与分组:使用水合氯醛腹膜内注射麻醉大鼠,在T8-9椎体水平切除椎板,使用手术刀片完全横断脊髓或用改良的动脉瘤钳挤压1 s,施加180 g(大约1.77 N)闭合力。将3 mm×3 mm×3 mm的明胶海绵放入窗孔中进行充分止血。将一个由Ⅰ型胶原蛋白制成的支架切割成约2 mm×2 mm×2 mm大小,作为移植细胞的载体填充到腔中。将大鼠分为对照组(不进行任何手术和细胞移植)、脊柱骨折组(如前所述建立SCI模型,将无任何细胞的培养基支架移植到横断的脊髓中)和神经干细胞组(在SCI基础上显微注射5 ml NSC悬浮液),每组10只。闭合手术切口后,将大鼠送回到饲养笼,给予广泛护理,包括腹腔内注射青霉素[50000 U/(kg·d)]3 d。
1.3.2 损伤脊髓神经营养素-3(NT-3)和CGRP水平检测:采用ELISA检测受损脊髓组织蛋白样品中的NT-3和CGRP水平。D(λ)值(波长=450 nm)通过酶标仪测量。绘制标准曲线并计算受伤脊髓组织中NT-3和CGRP的含量。
1.3.3 相关蛋白表达检测:采用Western blot检测各组大鼠巢蛋白(Nestin)、CGRP和神经元核心抗原(NeuN)蛋白表达情况。获得每只大鼠T10脊髓并在冰上匀浆,使用蛋白提取试剂盒提取总蛋白质,并根据制造商说明使用BCA试剂盒进行定量。通过SDS-PAGE电泳分离等量总蛋白(30 μg)并转移到聚偏二氟乙烯膜上。在室温下将膜在含有5%脱脂牛奶和0.1% Tween-20的TBS缓冲液中封闭 2 h,并与适当的一抗(1∶1000)在4 ℃条件下孵育过夜。将膜用TBST洗涤并与HRP标记兔抗大鼠二抗(1∶5000)在37 ℃条件下孵育2 h。用 TBST彻底清洗膜,每次5 min,然后进行ECL检测。通过凝胶成像仪检测条带的强度,并通过Image Lab 2.0软件分析条带的灰度值。
1.3.4 尼氏染色与神经元计数:取自每只大鼠L1段的50个连续脊髓切片用中性红染色,每6个连续选择1个。基于立体学原理,在配备网格的显微镜下计数锥体外系和内锥体层内的神经元密度。计数每只大鼠L1节段50个连续脊髓切片中L1脊髓节段处的整个神经元数。计算锥体外系和内锥体层神经元密度。但是L1脊髓节段的域很窄,一个切片中的L1脊髓节段神经元很少。为了获得有价值的结果,对每只大鼠L1脊髓节段50个连续切片中L1脊髓节段的全神经元数进行计数。
1.3.5 骨转换血清标志物检测:采集血液后立即以12000 r/min 离心5 min,将上清液储存于-80 ℃。使用商业ELISA试剂盒测量骨钙素(OC)和Ⅰ型前胶原氨基端延长肽(P1NP)N末端前肽作为骨形成标志物。然后检测骨吸收标志物的血清水平,包括抗酒石酸酸性磷酸酶(TRACP-5b)和Ⅰ型胶原交联C-末端肽(CTX-1)。所有血清测量均根据制造商推荐的程序进行。
1.3.6 显微结构指标分析:使用高分辨率显微CT扫描左侧股骨以获得三维骨骼微结构。参数设置:电压80 kV,电流80 μA,曝光时间2.96 s,旋转角210°,旋转步长0.4°。基于获得的2D图像重建3D图像,各向同性体素大小为16 μm。使用Vgstudio Max 2.2软件对骨小梁和皮质骨结构进行定量分析。对于骨小梁特性,选择感兴趣体积(VOI),从干骺端生长板近端0.4 mm开始,向近端延伸2.4 mm。计算小梁显微结构指标,包括小梁骨矿物质密度(BMD)、每总体积的骨体积(BV/TV)、连接密度(Conn.D)、小梁数(Tb.N)以及小梁厚度(Tb.Th)。对于皮质骨的分析,选择另一个1.6 mm高度的股骨中骨VOI以获得皮质厚度(Ct.Th)。
1.3.7 骨组织形态学检查:采用TRAP染色检测大鼠骨组织成骨细胞数量,经脱水、石蜡包埋、切片后,用去离子水清洗切片,于37 ℃避光孵育1 h,显微镜下观察成骨细胞数量。将嵌入微镜阵列中的左股骨标本纵向切开至50 μm,使用荧光显微镜可视化钙黄绿素荧光染料标记。将股骨干骺端远端生长板近端1~3 mm区域定义为动态骨小梁组织形态测量分析的VOI。计算矿物沉积率(MAR)、骨形成率/骨表面(BFR/BS)和成骨细胞数量/骨表面(N.Ob/BS)。

2 结 果
2.1 三组大鼠NT-3和CGRP水平比较 见表1。脊柱骨折组NT-3和CGRP水平较对照组降低,神经干细胞组NT-3和CGRP水平较脊柱骨折组升高(均P<0.05)。
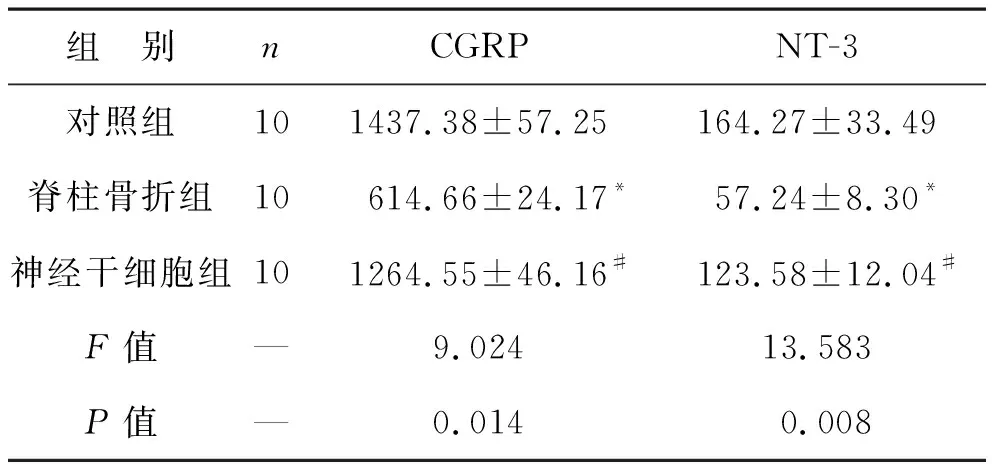
表1 三组大鼠NT-3和CGRP水平比较(μg/g)
2.2 三组大鼠Nestin、CGRP和NeuN蛋白相对表达量比较 见表2。脊柱骨折组Nestin蛋白表达较对照组升高,神经干细胞组Nestin蛋白表达较脊柱骨折组升高(P<0.05)。脊柱骨折组CGRP和NeuN蛋白表达较对照组降低,神经干细胞组CGRP和NeuN蛋白表达较脊柱骨折组升高(均P<0.05)。

表2 三组大鼠Nestin、CGRP和NeuN蛋白相对表达量比较
2.3 三组大鼠神经元存活情况比较 见表3。脊柱骨折组锥体外系、内锥体层和L1脊髓节段处神经元数量较对照组减少,神经干细胞组锥体外系、内锥体层和L1脊髓节段处神经元数量较脊柱骨折组增多(均P<0.05)。

表3 三组大鼠神经元存活情况比较
2.4 三组大鼠骨转换血清标志物水平比较 见表4。脊柱骨折组骨钙素和P1NP水平较对照组降低, TRAcP-5b和CTX-1水平较对照组升高(均P<0.05)。神经干细胞组骨钙素和P1NP水平较脊柱骨折组升高,TRAcP-5b和CTX-1水平较脊柱骨折组降低(均P<0.05)。

表4 三组大鼠骨转换血清标志物水平比较
2.5 三组大鼠骨骼显微结构指标比较 见表5。脊柱骨折组BMD、BV/TV、Tb.N、Tb.Th和Ct.Th较对照组减小,神经干细胞组BMD、BV/TV、Tb.N、Tb.Th和Ct.Th较脊柱骨折组增加(均P<0.05)。

表5 三组大鼠骨骼显微结构指标比较
2.6 三组大鼠骨组织形态指标比较 见表6。脊柱骨折组MAR、BFR/BS和N.Ob/BS较对照组降低,神经干细胞组MAR、BFR/BS和N.Ob/BS较脊柱骨折组升高(均P<0.05)。

表6 三组大鼠骨组织形态指标比较
3 讨 论
脊柱骨折是一种极其严重的神经损伤,可导致身体功能严重丧失[11-12]。然而,当前治疗方法的疗效在很大程度上受到限制。研究[13-15]表明,脊柱骨折后神经系统的功能恢复受原发性损伤和继发性细胞萎缩、坏死和凋亡导致的局部神经细胞丢失的影响,神经细胞特别是神经元和NSC的修复和再生对神经功能的恢复至关重要。无法替换受损或死亡的神经元被认为是严重阻碍CNS损伤疗法发展的主要原因之一。胎儿组织成功植入受伤的CNS表明神经元替代是CNS修复的一种有价值的策略。NSC是很好的候选者,可以在组织培养中进行克隆扩增,并为移植提供可再生的材料供应。NSC可合成多种神经营养因子、细胞黏附和细胞外基质分子[16-18]。
CGRP是广泛分布于外周和中枢神经系统,可促进神经再生,并参与SCI后修复过程。CGRP的持续表达与神经再生密切相关。该机制可能与其对神经系统血液供应的促进作用有关。目前,CGRP是已知最强的血管扩张物质。随着进一步的研究,它对骨代谢的调节作用正变得越来越清晰。相关研究证明,CGRP通过感觉神经大量分布在骨骼中,特别是在骨骺小梁骨中。据报道,CGRP由成骨细胞内源性表达。具有过度表达CGRP的成骨细胞的转基因小鼠的特点是骨形成速率增加和骨体积增加,这表明CGRP确实不仅通过神经途径,而且通过自分泌环作用于骨代谢。众所周知,NSC在SCI的修复中发挥着重要作用。Nestin是一种NSC特异性Ⅳ型中间丝蛋白,是NSC正确自我更新所必需的,并且与NSC密切相关。NSC生物标志物Nestin在活跃增殖的NSC中高度表达。Nestin的表达在成熟神经元和神经胶质细胞中减少,但在受损的神经组织中增加。因此,与对照组相比,在SCI模型大鼠中Nestin的表达升高。NeuN是一种小的可溶性蛋白,主要分布在神经元的细胞质和细胞核中。作为NSC的生物标志物,NeuN蛋白的表达水平表明了细胞的增殖能力。NT-3是重要的神经营养因子之一,可防止成熟CNS神经元的萎缩,促进脊髓损伤动物的皮质脊髓束轴突再生和后肢功能的恢复。本研究中发现,神经干细胞治疗可刺激Nestin、NeuN、NT-3和CGRP的表达,提示干细胞移植促进了神经元的再生。
由于脊髓不仅包含大量的神经元,而且还包含大量的上行和下行神经纤维,因此脊髓横断会导致所有神经纤维被切断[19-20],因此拥有神经纤维的神经元受到伤害。在本研究中,我们选择了一些具有代表性的区域来探索受损神经元的存活情况,发现在脊柱骨折大鼠的锥体系统、锥体外系和L1脊髓节段的神经元数量减少,而经过NSC治疗后得到增加,因此其可以促进移植的干细胞衍生神经元和脊髓神经元的存活。脊髓损伤患者的骨骼发生了深刻的变化,其特点是骨质流失迅速,骨折风险显著增加。研究表明,干细胞移植有可能成为一种有前途的治疗方法,可促进新鲜/延迟骨折愈合,且无明显不良反应。
本研究发现,NSC通过拯救SCI大鼠的成骨细胞和骨细胞介导的骨合成代谢来保持松质骨和皮质骨量、微结构。众所周知,SCI患者的骨小梁量显著减少,尤其是在股骨远端和胫骨近端。显微CT结果显示,SCI可导致小梁骨量和骨微结构的有害改变,包括小梁数量、厚度和连接性受损。同样,也有研究观察到SCI后动物的严重松质骨退化,而NSC治疗几乎可以将SCI大鼠的小梁数量、分离和体积分数恢复到对照组大鼠的水平。此外,由SCI引起的骨小梁连接性和厚度的恶化也被干细胞部分抑制。我们还发现,SCI诱导大鼠皮质骨变薄,这与之前的报道一致。NSC治疗部分减轻了SCI大鼠皮质厚度的恶化,揭示了骨骼机械完整性和断裂韧性的潜在改善。已知SCI后的骨丢失与骨代谢不平衡、骨形成减少和骨吸收加速有关。血清骨钙素和 P1NP 作为骨形成的两种敏感和可靠的生化标志物,在本研究中被发现在SCI大鼠中显著降低。另外,SCI大鼠血清TRACP-5b和CTX-1(两种特异性骨吸收生物标志物)增加。NSC几乎将SCI大鼠的血清骨钙素和 P1NP水平恢复到控制水平,支持干细胞诱导的强合成代谢作用。钙黄绿素双标记结果提供了更直接的证据,表明NSC治疗保留了SCI大鼠的骨形成。骨组织学结果表明,NSC除了提高SCI大鼠的骨形成率外,还增加了骨表面的成骨细胞数量。
综上所述,神经干细胞疗法能促进局部神经元中CGRP生成和神经元的存活,从而促进SCI大鼠骨折愈合和功能恢复。

