一氧化氮释放特性的多糖基生物材料在肺腺癌中的抗肿瘤效应
李德茂,孙慧杰,孟令雷,李德尚*
(1.邢台市人民医院,河北 054000;2.邢台医学高等专科学校,河北 054000)
肺癌目前是世界上病死率最高的恶性肿瘤之一,在诸多类型的肺癌中,肺腺癌是目前最常见的组织学类型,同时,也是引发肺癌相关死亡的主要类型之一。由于诊断前易发生转移性扩散,同时具有局部浸润的高发生率,符合外科手术适应条件的患者相对较少[1]。为提高肺腺癌患者的生存率,临床需要有效的药物和疗法。一氧化氮(NO)已被证实与多种肿瘤的转移和进展有关,NO还可以介导与肿瘤相关的多个过程,包括血管生成和细胞周期等。CS-NO在β-半乳糖酶存在下刺激响应释放NO,NO的释放率高达40%[2]。本研究表明,CS-NO在β-半乳糖酶刺激下释放的NO,可作为一种有效的外源性NO代偿,在肺腺癌的治疗中具有良好的潜力。
1 材料和方法
1.1 细胞培养 将H1975和HCC827细胞系细胞(国家实验细胞资源共享平台)分别置于RPMI1640和H-DMEM培养基中,添加10%胎牛血清和含5%CO2的湿润空气,在恒定37℃下培养。
1.2 药物和抗体CS-NO(实验室制备,白色粉末状保存于冰箱,使用时用蒸馏水配制成浓度为5 mg/ml的溶液);β-半乳糖苷酶(东恒华道生物科技有限责任公司);抗Ki67抗体(1∶100稀释,ab16667,Abcam plc,Cambridge,UK),抗caspase 3抗体(1∶100稀释,ab4051,Abcam plc,Cambridge,UK),抗MMP9抗体(1∶1000稀释,ab38898,Abcam plc,Cambridge,UK))。
1.3 克隆形成实验 用5 mg/ml的多糖基壳聚糖(CS)单独处理和CS-NO联合处理对数生长期内的H1975和HCC827细胞系细胞24 h,同时加入0.01 mg/ml β-半乳糖苷酶,H1975和HCC827细胞系细胞用0.25%胰蛋白酶消化并吹打成单个细胞,之后放入两倍胰酶体积的10%胎牛血清的培养液中稀释,然后种植在6孔板上,密度为每孔600个细胞,置37℃、5% CO2的湿润空气环境中培养生长14 d,期间每隔3 d进行换液并观察细胞状态。14 d后在室温下每孔加入1 ml 4%多聚甲醇固定30 min,再用1 ml 0.2%结晶紫染色20 min,之后采用PBS洗涤2次,每次5 min,去除多余液体晾干后拍摄照片。
1.4 CCK-8实验 将H1975和HCC827细胞系细胞按“1.3”项下方法制成悬浮液转移至离心管离心,1 000 r/min,离心3~5 min,弃上清,用1 ml含血清培养基重悬。使用细胞计数仪计数细胞,对细胞悬液进行稀释,稀释至50 000个/ml。取96孔板,每孔加入2 000个细胞,每组6个复孔。在37℃培养基中培养24 h,吸出各孔培养基,分别加入5 mg/ml的CS和CS-NO,同时加入0.01 mg/ml β-半乳糖苷酶,再次培养24 h后吸出各孔培养基,加入含10%CCK-8的培养基培养4 h,采用微板阅读器在570 nm处测量光学密度(OD)。
1.5细胞凋亡测定 将5 mg/ml CS和0.01 mg/ml β-半乳糖苷酶单独处理H1975和HCC827细胞24 h,与5 mg/ml CS-NO和0.01 mg/ml β-半乳糖苷酶联合处理的H1975和HCC827细胞24 h后,1 000 r/min离心3~5 min,弃上清。加入500 μl稀释的1×Annexin V Binding Buffer重悬,加入5 μl的Annexin V-FITC混匀后,避光室温孵育15 min,上机前5 min再加入5 μl的碘化丙啶(PI)染色,然后用流式细胞仪(BD)分析细胞。
1.6 Transwell实验Transwell过滤器的上表面涂有Matrigel基质。将5 mg/ml CS和CS-NO和0.01 mg/ml β-半乳糖苷酶分别处理过24 h的细胞悬浮在150 μl无血清培养基中,然后将其放入培养箱中,将培养箱放入含有800 μl完整培养基的24孔板中。培养24 h后,取出过滤器,用棉签小心去除上表面的基质凝胶。用4%多聚甲醛固定Transwell过滤器底部的细胞25 min,用0.2%结晶紫染色20 min,然后拍照,再用10%乙酸提取染料,并用波长为570 nm的微孔板读取器进行测量。通过Transwell分析,测定经CS-NO处理对细胞迁移和侵袭的影响。
1.7 小鼠肿瘤生长检测 本研究的动物伦理委员会已批准相关的小鼠实验操作,采用5周龄,体重18~22 g的BALB/c雌性裸鼠[由BeijingVitalRiverLaboratory Animal Technology Co Ltd提供,实验动物供应商的生产许可证编号SCXK(京)2016-0002]。喂食小鼠鼠粮和水,在20℃和60%湿度的无菌环境下培养,并维持光照时间和黑暗时间均为12 h。为了检测肿瘤生长,将HCC827细胞皮下注射到雌性无胸腺裸鼠的右侧腋窝,每只小鼠注入用100 μl生理盐水混合的5×106个细胞,所有小鼠均一次性瘤体内注射给药。在接种成功10 d肿瘤模型建成后给药,CS-NO组瘤内分别注射50 μl 5 mg/ml CS-NO和10 μl 0.01 mg/ml β-半乳糖苷酶;对照组瘤内分别注射5 mg/ml CS和10 μl 0.01 mg/ml β-半乳糖苷酶,每组的样本数均为4只。治疗周期为29 d,给药后每间隔3 d测量肿瘤体积。治疗结束后处死小鼠,分离肿瘤,拍照,称重并计算。
1.8 免疫组化 获得小鼠肺腺癌瘤组织并进行免疫染色。将肺腺癌瘤组织用10%的中性缓冲福尔马林固定24 h后进行石蜡包埋,之后将石蜡包埋的组织切片用二甲苯溶液浸泡10 min,再放入100%、95%、85%和75%乙醇中各5 min。将切片标本在PBS缓冲液中洗涤2次,每次2 min,在柠檬酸盐缓冲液中进行抗原修复并用3%H2O2灭活内源性过氧化物酶后,将切片用2%牛丝氨酸白蛋白在PBS中浸泡20 min,并与第一抗体一起孵化,在4℃环境下过夜。
次日,将切片室温放置1 h,用PBS缓冲液洗涤2次,每次2 min。之后,在室温下滴加IgG二级抗体,静置2 h。再用PBS缓冲液再次洗涤,滴加DAB染色液(用A液和B液预先配制),室温下染色约5~15 s。用水冲洗掉表面染料,然后用苏木精溶液染细胞核5~8 s,用水冲洗约2 min。最后用中性树胶封片后在显微镜下观察。
本实验主要研究小鼠肿瘤的阳性细胞相对百分比,即各组切片在相同大小的镜下视野内拍摄细胞图片,分别记录图片内阳性细胞个数。之后,使用较小数据除以较大数据,从而得出阳性细胞相对百分比,即:阳性细胞相对百分比=较小阳性细胞个数/较大阳性细胞个数×100%,同时默认较大数据的阳性细胞相对百分比为100%。
1.9 统计分析 采用GraphPad Prism 5软件进行计算分析,统计数据均料以±s表示,t检验用以显示两个样本平均值之间存在显著差异,P<0.05被认为是有显著意义。
2 结果
2.1 克隆形成实验CS疗法对HCC827和H1975细胞系细胞起到的生长抑制作用并不明显,HCC827细胞系细胞克隆数量平均值为(146.80±1.03),H1975细胞系细胞克隆数量平均值为(152.30±1.93);而CSNO疗法应用时,在以上两种肺腺癌细胞系中可观察到癌细胞生长显著降低,HCC827细胞系细胞克隆数量平均值为(61.00±1.47),H1975细胞系细胞克隆数量平均值为(74.25±1.93),两组的克隆形成结果存在统计学差异(P<0.05)。表明在采用CS-NO治疗后,肺腺癌细胞的增殖能力受到抑制,即抗癌细胞增殖能力得到了明显增强。见图1-2。

图1 CS组和CS-NO组细胞克隆数量
2.2 CCK-8实验 与CS处理相比,CS-NO应用在这些HCC827和H1975细胞系细胞中570 nm的OD值显著降低了,CS处理组的HCC827和H1975细胞570 nm OD值分别为(0.955 0±0.014 4)与(0.952 5±0.018 9),而CS-NO组的HCC827和H1975细胞OD值分别为(0.607 5±0.008 5)与(0.605 0±0.018 5),两组的OD值之间存在明显的统计学差异(P<0.05),表明CS-NO的应用可以有效的抑制癌细胞的增殖。见图3。
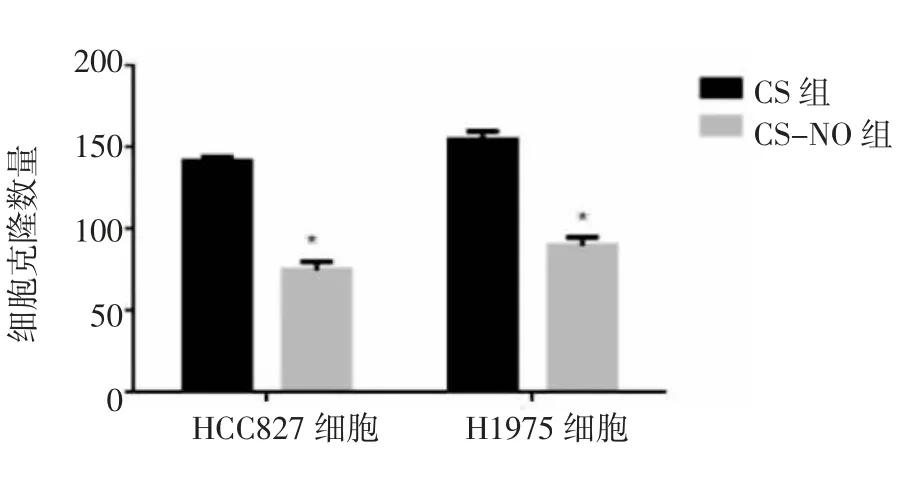
图2 两组对HCC827细胞和H1975细胞克隆数量的影响

图3 两组对HCC827细胞和H1975细胞OD值的影响
2.3 细胞凋亡测定 流式细胞术试验结果见图4。CS组处理的HCC827和H1975细胞系细胞的凋亡改变相对轻微,HCC827细胞凋亡率为5.44%,H1975细胞凋亡率为19.03%,然而,CS-NO治疗组的凋亡细胞百分比显著增加了,HCC827细胞凋亡率为31.60%,H1975细胞凋亡率为38.50%,两组的凋亡率存在统计学意义(P<0.05),见图5。以上试验结果表明,CSNO治疗对促进肺腺癌细胞的凋亡起到了积极作用。

图4 CS组和CS-NO组流式细胞术

图5 两组对HCC827细胞和H1975细胞的细胞凋亡率影响
2.4 Transwell实验Transwell试验结果发现,CSNO的使用降低了肺腺癌细胞的侵袭性,使通过Matrigel基质凝胶的细胞数量显著减少,见图6。CS治疗组的HCC827细胞通过数量平均值为(95.25±1.93),H1975细胞通过数量平均值为(112.80±3.04);而使用CS-NO的HCC827细胞通过数量平均值为(25.25±1.89),H1975细胞通过数量平均值为(26.25±2.06),两组数据存在统计学意义(P<0.05),见图7。以上实验结果表明,CS-NO治疗是抑制肺腺癌细胞侵袭的有效方法。
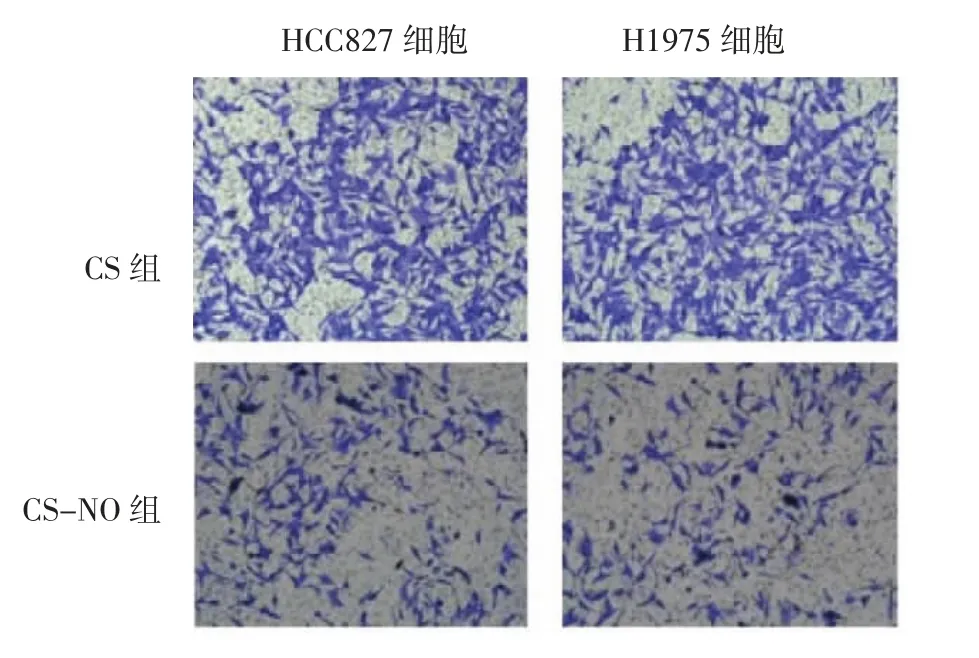
图6 两组HCC827细胞和H1975细胞通过Matrigel基质凝胶的细胞数量
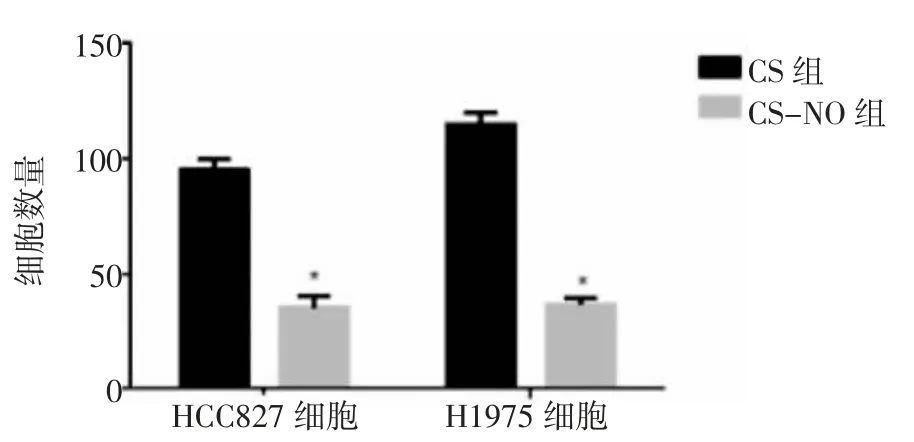
图7 两组对HCC827细胞和H1975细胞通过基质凝胶细胞数量的影响
2.5 小鼠肿瘤生长检测 本研究利用无胸腺裸鼠设立了CS组和CS-NO组。裸鼠皮下注射HCC827细胞,在接种成功14 d后每间隔3 d测量肿瘤体积。结果显示,采用CS-NO治疗的HCC827细胞生成的肿瘤生长更慢,见图8。而使用CS治疗则不会明显抑制肿瘤的生长,且在接种成功17 d后,两组小鼠肿瘤体积的差异逐渐增大,CS组的肿瘤体积增长速率明显高于CS-NO组。至第29日,CS治疗组的平均肿瘤体积为(474.80±11.38)mm3,而CS-NO治疗组的平均肿瘤体积为(245.80±3.35)mm3,其差异具有统计学意义(P<0.05),见图9。该实验结果表明,CS-NO治疗可以明显抑制HCC827肿瘤细胞在小鼠体内的生长,降低肿瘤细胞的增殖能力。

图8 两组小鼠肿瘤体积
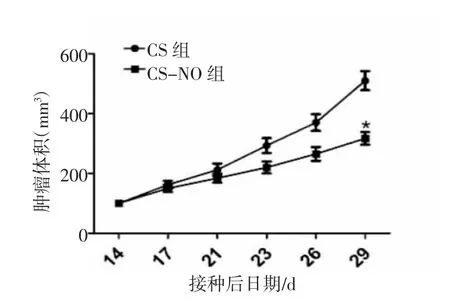
图9 两组小鼠肿瘤体积与时间的关系
2.6 小鼠肿瘤免疫组化 肿瘤组织的免疫组化分析显示,CS-NO组的Ki67阳性细胞相对百分比为(35.00±2.27)%,明显低于CS组的(95.00±1.87)%,而Ki67阳性表明细胞增殖能力较强,所以由上可知,两组癌细胞的增殖能力存在差异,CS-NO治疗组的癌细胞增殖能力明显弱于CS治疗组,见图10。此外,HE染色显示,CS-NO组小鼠肿瘤组织中caspase-3阳性细胞的相对百分比为(94.25±1.49)%,明显高于CS治疗组的(47.50±1.19)%。而作为细胞凋亡的标志物,caspase-3的高表达也表明了CS-NO应用可显著促进肿瘤细胞的凋亡,见图11。此外,与CS组相比,CS-NO组的MMP9阳性细胞相对百分比显著降低,CS组MMP9阳性细胞相对百分比为(97.75±0.75)%,而CS-NO组的MMP9阳性细胞相对百分比为(20.00±1.87)%。因为MMP9常作为验证肿瘤细胞侵袭性的标志物,所以这也表明了CS-NO对于抑制肿瘤细胞的侵袭性是有效的,见图12。以上全部结果均存在统计学差异(P<0.05),且综合上述免疫组化结果可知,CS-NO的应用在抑制肺腺细胞增殖、促进凋亡与降低侵袭性的方面是具有较为明显的效果的。

图10 两组小鼠肿瘤的Ki67阳性细胞相对百分比

图11 两组小鼠肿瘤的Caspase 3阳性细胞相对百分比
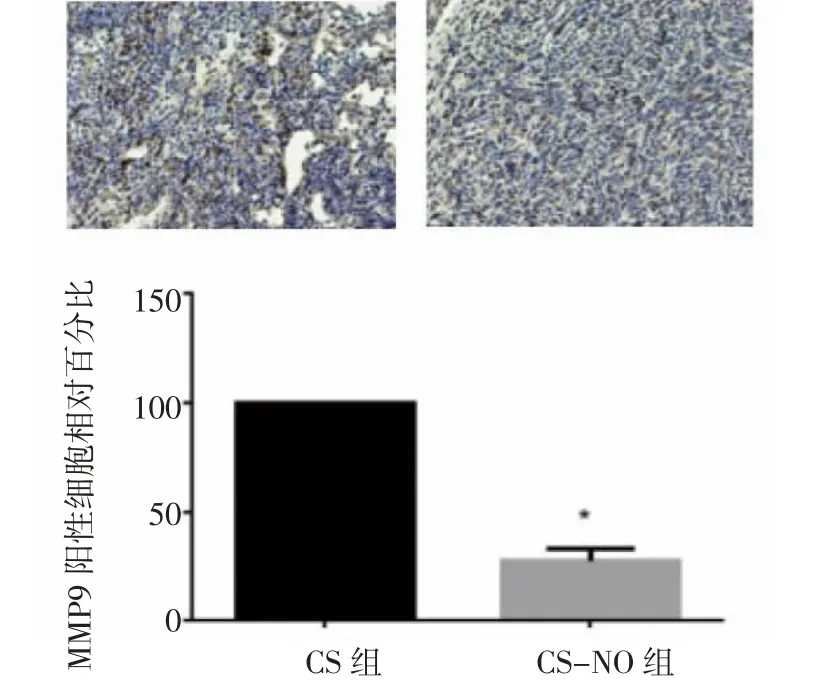
图12 两组小鼠肿瘤的MMP9阳性细胞相对百分比
3 讨论
3.1 肺腺癌的治疗背景与预后 肺癌是全球病死率最高的恶性肿瘤之一。美国每年约有234 000例肺癌新发病例被确诊,占所有癌症诊断的13%,而仅在2018年就有大约154 000名美国公民死于肺癌,约占美国所有癌症死亡人数的25%[3]。而在意大利,预计每年大约会有41 000例新确诊的肺癌病例[4]。虽然现代医学对于肺癌的治疗已经取得了显著的临床成效,治疗策略在过去几年中不断发展,但是不幸的是由于效率低下,各类型肺癌患者的平均5年生存率也仅为19%。而作为引发肺癌相关死亡的主要病理类型之一,预计到2030年,肺腺癌将成为肺癌相关死亡的第二大原因[5]。而且对于肺腺癌而言,现代医学已经知晓并运用成熟的化疗方案的治疗效果仍然是较为有限的[6],所以临床需要新的治疗途径来提高肺腺癌患者的5年生存率,进而试图提高肺腺癌患者的生活质量。
3.2 NO的抗肿瘤作用 一氧化氮(NO)是一种普遍存在于自然界中的水溶性气体,其在生理和病理过程中起着至关重要的作用[7],其在人体内是由一氧化氮合酶(NOS)内源性产生的,NOS是一种在不同类型细胞中均被认定存在的酶,可以调节抗炎反应[8]。NO可以诱导细胞缺氧,从而具有抑制DNA合成的作用[9]。此外,其可以通过上调p53 mRNA的表达水平,激活caspase调节凋亡相关蛋白,从而调节细胞凋亡[10]。
NO已被证实与多种肿瘤的转移和进展有关,参与了肿瘤发展的不同阶段,是调节肿瘤生长和转移的条件之一。与正常乳腺细胞相比,浸润性乳腺癌细胞的NOS活性下降,而且NOS的表达量与乳腺癌的不良预后呈负相关[11]。而流行病学研究表明,NO体内浓度等一系列风险因素与宫颈癌的发生发展相关[12]。NO体内浓度的下降导致宫颈组织中p53的表达水平降低,从而诱发宫颈癌[13]。同时,也有许多研究已经证实NOS活性下降可能导致了食管癌的发生、侵袭和转移[14]。
3.3 CS-NO的药理作用NO可以作为肿瘤治疗的新方向之一,来提高化疗的效率。而提高NO供体化合物的NO释放效率则是开发NO释放生物材料的另一个新挑战[15]。以往的研究已经提出了将NO供体与疏水性聚合物基质结合起来的方法,然而,这些简单的掺杂法往往会导致NO在局部区域内的积累或聚集过多等情况的发生,进而导致了NO供体分子从基质中快速扩散和浸出,使NO的治疗效率大打折扣。目前报道了一种具有NO释放特性的多糖基生物材料(CS-NO),有研究表明CS-NO和当前常规药物组合相比的优势在于,其可以增强这些常规药物的作用,如非甾体抗炎药和他汀类药物[14]。而且CS-NO在生理条件下具有化学稳定性,其NO释放行为完全由人体内的酶来催化控制,所以人体内的酶催化具有了开关作用,可按需释放NO[2]。因此,通过CS-NO植入物来增加外源性NO的补偿可能会显示出良好的治疗潜力。
3.4 CS-NO联合治疗的结果与意义 在此项研究中发现,CS-NO的应用可显著抑制肺腺癌细胞的增殖,诱导其凋亡,抑制肺腺癌细胞的侵袭,并可抑制小鼠体内肺腺癌肿瘤的生长。
克隆形成实验表明,CS-NO应用在HCC827和H1975两种肺腺癌细胞系中可观察到癌细胞数量增长效果显著降低。且为了进一步观察癌细胞的增殖情况进行了CCK-8实验,其结果显示CS-NO应用于这些细胞系细胞中可以显著降低570 nm的OD值,表明CS-NO应用后抗癌细胞增殖能力得到了增强。
细胞凋亡测定结果表明,CS-NO治疗组的凋亡细胞百分比与CS组相比显著增加,说明CS-NO治疗可促进肺腺癌细胞的凋亡。同时,本研究进行了Transwell实验,借以研究CS-NO治疗在肺腺癌细胞侵袭中的作用。Transwell实验发现,CS-NO的使用降低了通过Matrigel基质凝胶的肺腺癌细胞的侵袭性,细胞数量和570 nm的OD值都显著降低,表明CS-NO治疗明显降低了肺腺癌细胞的侵袭性。
小鼠肿瘤生长检测结果说明,CS-NO组的肿瘤体积抑制效果比CS组显著。而在免疫组化实验中发现:CS-NO组的Ki67阳性细胞相对百分比明显低于CS组,作为肿瘤细胞增殖能力的标志物,Ki67阳性细胞相对百分比下降表明肿瘤细胞增殖能力相应的降低;小鼠肿瘤组织中caspase-3阳性细胞的相对百分比高于CS组,而作为细胞凋亡的标志物,caspase-3的高表达也表明了CS-NO可显著促进肿瘤细胞的凋亡;CS-NO组的MMP9阳性细胞相对百分比显著降低,表明肿瘤的侵袭能力也受到明显抑制。这些发现表明CS-NO的应用在抑制肺腺细胞增殖和促进凋亡方面是有效的。所以,CS-NO可以作为新的治疗策略来提高肺癌患者生存率和生活质量。
3.5 实验的不足 本实验中对于CS-NO抑制肺腺癌细胞增殖并促进凋亡的具体机制目前尚未研究清楚。目前的研究结果表明CS-NO治疗对caspase-3的表达起到了增强作用,结合文献中[10,13]提示的NO可以通过上调p53的表达促进细胞凋亡的结论,故而推测CS-NO可能参与了细胞凋亡的调控,但如何共同调控癌细胞凋亡尚不清楚。本研究的研究表明,CS-NO治疗在抑制肺腺癌细胞的增殖和介导肺腺癌细胞的凋亡中起到重要作用,但目前如何实现这些效果的分子机制尚需进一步研究。

