皮质醇水平轨迹分析识别脓毒症新亚型
冷 斐,林世龙,韩 霏,钟 鸣,吴 威
复旦大学附属中山医院重症医学科,上海 200032
目前,脓毒症已成为全球性的重大疾病负担。最新的第3 版国际共识[1]将脓毒症定义为宿主对感染的反应失调而致的危及生命的器官功能障碍。动物实验和临床证据[2]表明,脓毒症与下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴的异常应答有关,机体可通过激活HPA轴引起皮质醇浓度升高来控制炎症反应,但随着疾病的进一步发展,肾上腺皮质功能紊乱,导致机体炎症反应失控。脓毒症患者皮质醇水平存在高度异质性,导致临床上很难依据其浓度对患者表型进行分组并进一步指导治疗。
虽然糖皮质激素是脓毒症的常规辅助治疗药物,但目前仍缺少坚实的证据来指导其合理应用[3]。群组轨迹建模(group-based trajectory modeling,GBTM)作为一种新的表型分组工具,可利用指标在时间维度上的变化进行潜在类别分析,成为重症领域的热点[4-6]。本研究旨在探讨能否根据脓毒症患者的血浆皮质醇水平轨迹划分新的脓毒症亚型,以指导诊治。
1 资料与方法
1.1 一般资料 回顾性分析2019 年3 月至2021年8 月于复旦大学附属中山医院重症医学科住院治疗的96 例成人脓毒症患者的病例资料。纳入标准:(1)符合美国与欧洲重症医学会联合发布的脓毒症 3.0 定义[1];(2)脓毒症起病 24 h 内;(3)预计ICU 住院时间超过3 d。排除标准:(1)既往长期使用皮质醇类药物;(2)既往存在激素分泌异常史;(3)入组后72 h 内因病情必须使用皮质醇类药物者。本研究通过复旦大学附属中山医院伦理委员会批准(B2021-501R),所有患者均知情并签署知情同意书。
1.2 治疗方法 患者收入ICU 后筛查病因,处理诱发脓毒症的原发病灶或感染部位,并启动脓毒症集束化治疗以积极改善患者一般情况。
1.3 观察指标 收集患者临床资料,包括年龄、性别、体质量指数、基础疾病情况、感染病灶等。在入组后的24 h 内完成相关实验室检查,并记录基线序贯器官衰竭评分(SOFA)和急性生理与慢性健康评分Ⅱ(APACHE Ⅱ)。患者入组后的首个晨8 时记为时间点T1,T1 后的首个下午4时记为时间点T2,次日晨8 时记为T3、下午4 时记为T4,第3 个晨8 时记为时间点T5,每个时间点抽取患者血液进行血浆皮质醇浓度检测。记录患者ICU 住院时间、总住院时间、机械通气时间、28 d死亡率和90 d 死亡率等。对所有数据收集过程进行严格的质量控制,由1 名医师录入数据,另一名医师进行数据校对,确保数据完整和准确。
1.4 统计学处理 采用SPSS 22.0 分析数据,采用Kolmogorov-Smirnova 进行正态性检验,符合正态分布的计量资料以x±s 表示,组间比较采用两独立样本t 检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U 检验。计数资料以n(%)表示,组间比较采用检验。采用 Graphpad Prism 8.0 绘制 Kaplan-Meier 生存曲线。基于患者皮质醇水平时序数据的轨迹特点,采用生长混合模型(growth mixture modeling,GMM)方法对脓毒症患者进行分类,以贝叶斯信息 准 则(Bayesian information criterion,BIC)[7]确定分组的个数。采用R 语言3.6 版本“LCMM”工具包[8]完成轨迹分析。检验水准(α)为0.05。
2 结 果
2.1 一般资料分析 结果(表1)显示:96 例脓毒症患者中位年龄68 岁,以男性患者为主(66 例,68.8%)。诱发脓毒症的原发病以腹部感染为主(80例,83.3%);合并症以肿瘤居多(61.5%),特别是肠道肿瘤(破裂引发腹膜炎)。入组患者平均SOFA 评分为7 分。
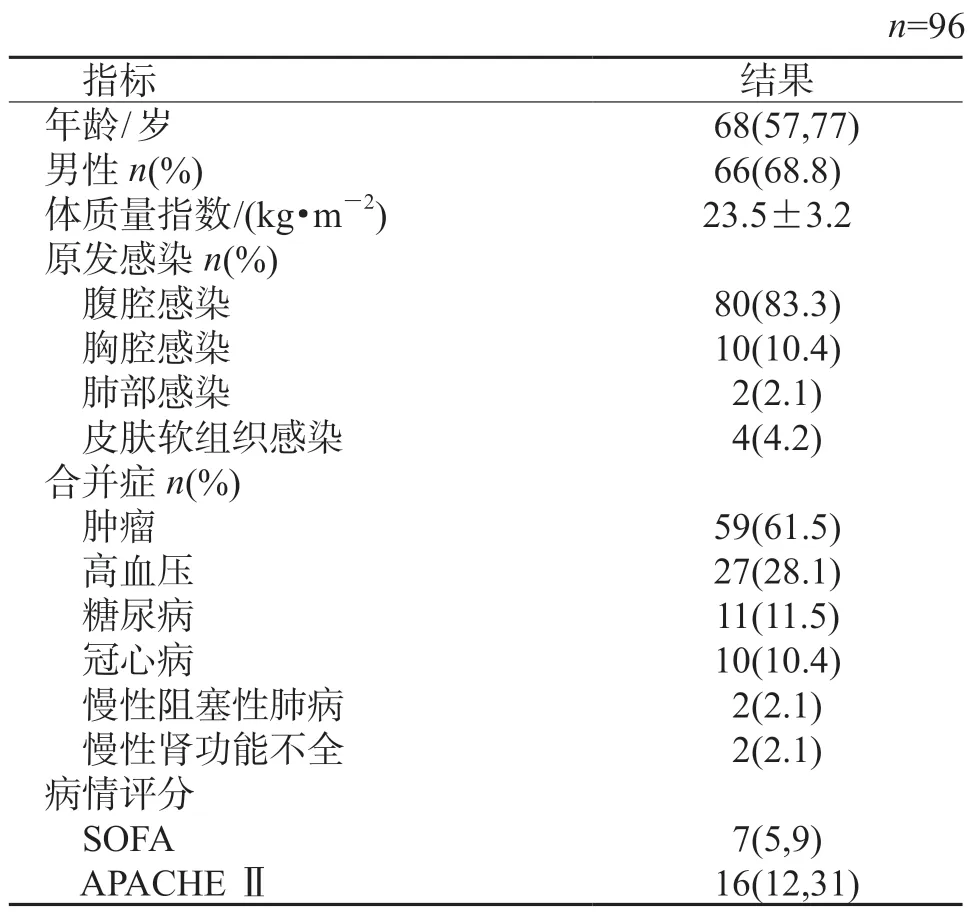
表1 脓毒症患者的一般资料分析
2.2 皮质醇水平轨迹及潜在类别分组 对患者入组后T1 至T5 时间点的血浆皮质醇浓度变化进行GBTM 分析,结果(图1)显示:根据皮质醇水平轨迹可将患者分为2 组,即皮质醇水平由较高浓度逐渐回落组(回落组,n=33)和皮质醇水平在相对正常范围内波动且波动较为稳定组(稳定组,n=63)。
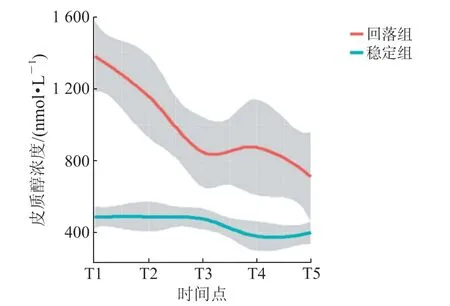
图1 脓毒症患者皮质醇水平轨迹分析
2.3 回落组和稳定组的临床资料比较 结果(表2)显示:回落组患者入组时SOFA 评分及APACHEⅡ评分高于稳定组(P<0.01)。回落组患者28 d死亡率(42.4% vs 17.4%,P=0.008)和 90 d 死亡率(45.5% vs 22.2%,P=0.019)较稳定组更高。回落组患者淋巴细胞计数低于稳定组(P=0.006),IL-8、IL-10 等高于稳定组(P<0.05)。
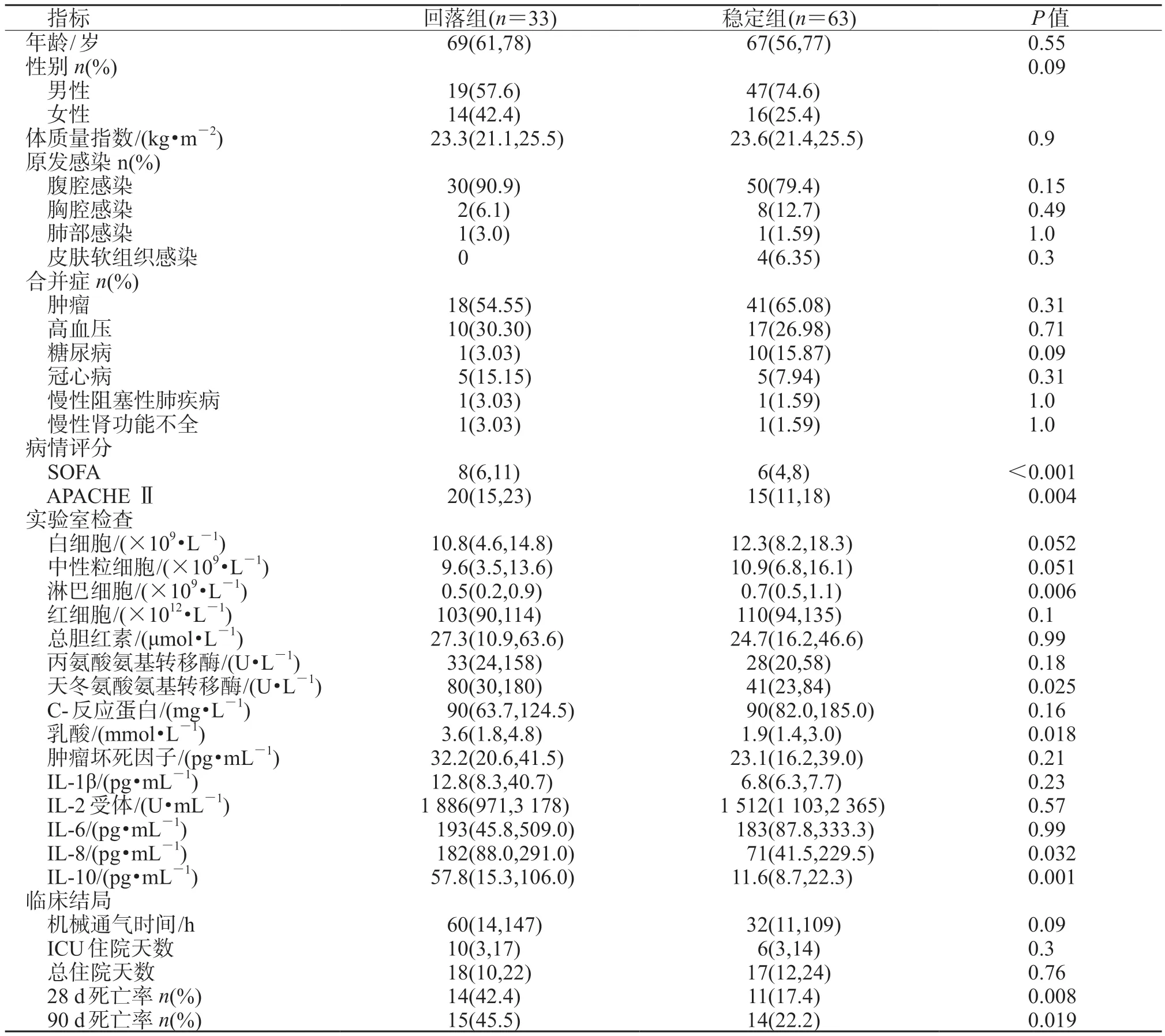
表2 不同皮质醇水平轨迹患者情况对比
2.3 生存曲线分析 Kaplan-Meier 生存曲线(图2)显示:回落组和稳定组28 d 和90 d 累计生存率差异均有统计学意义(P=0.007、P=0.01)。
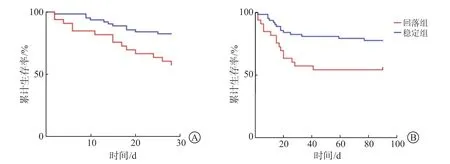
图2 2 组患者28 d(A)和90 d(B)Kaplan-Meier 生存曲线
3 讨 论
脓毒症是一种高异质性综合征,患者的诱因及病理生理表现各异,难以用固定模式治疗[9]。而临床亚表型的识别可能有助于指导个性化治疗。本研究使用的GBTM 是有限混合建模的一种专门应用[10]。该方法通过分析纵向数据,评估可能与每组亚型轨迹曲线相关的因子,用于识别某项具有特定轨迹的变量,并将相关群体分组[11]。近年来,Bhavani 等[4]通过分析感染患者体温的变化轨迹得出不同的感染亚型,各亚型间有不同的基础生理状态及临床结局。进一步研究[5]发现,不同体温变化轨迹患者的免疫应答不同。国内Wang等[6]发现,不同液体平衡纵向轨迹患者间死亡率及肾脏不良事件发生率差异有统计学意义。上述结果表明,针对脓毒症患者较为复杂的干扰因素,利用变量纵向数据轨迹,而不是单个时间点的数值,可能更有助于有效区分亚型。
既往关于使用激素治疗脓毒症的研究较多,但结论不一。Rochwerg 等[12]在 2018 年发表的系统性回顾研究中提出,用激素治疗严重脓毒症患者能小幅度降低死亡率。2019 年一项纳入9 564例脓毒症患者的系统性回顾研究[13]发现,激素治疗与 28 d 死亡率降低相关(RR=0.90,95%CI 0.82~0.98)。然而,近期一项纳入12 304 例脓毒症患者的系统性回顾研究[14]结果显示,采用激素治疗与否患者的28 d 和长期死亡率差异无统计学意义。有研究[15]发现,脓毒症休克患者基线血浆总皮质醇及游离皮质醇浓度较健康对照组明显升高,但在病程中,激素水平变化趋势不一致,同时患者对促肾上腺皮质激素的刺激反应也不同。该结果提示,类似研究得出相左结论的原因可能为不同脓毒症患者对炎症损伤的免疫应答不同,导致其对激素治疗反应表现出异质性。
本研究通过分析脓毒症患者的血皮质醇水平轨迹将患者区分为回落组和稳定组。回落组基线的血皮质醇浓度明显超出正常范围上限,虽在较短时间内迅速下降,但总体仍高于稳定组,临床上表现为病情更严重(SOFA 和APACHE Ⅱ评分较高);同时,IL-8、IL-10 等细胞因子水平亦较高,可能提示更强烈的炎症反应。回落组患者的28 d 及90 d 死亡率显著高于稳定组。
本研究存在一定局限性:(1)作为一项回顾性观察研究,其结果无法解释皮质醇水平轨迹与临床结局之间的因果关系;(2)样本量较小,同时未能完全排除其他干扰因素,仍需进一步的研究证实。
综上所述,本研究发现脓毒症患者2 种新的皮质醇水平轨迹表型亚组,提示不同患者对炎症损伤的免疫反应不同,为预测和识别脓毒症患者的不同亚型提供了新方向。
利益冲突:所有作者声明不存在利益冲突。

