残留结节出现影像学进展的多灶性磨玻璃样/贴壁型肺腺癌患者的临床特征与预后分析
李 钊,许 可,秦琳琳,赵晓刚
同济大学附属上海市肺科医院胸外科,上海 200433
随着肺癌筛查计划与低剂量CT 胸部检查的普及,多灶性磨玻璃结节(ground glass nodule,GGN)的诊断率呈上升趋势[1-2]。这类患者的肺部结节具有明显的磨玻璃样或贴壁型(ground glass/lepidic, GG/L)生长成分。经手术切除的肺结节病理表现为以贴壁为主型的早期肺腺癌,如 原 位 腺 癌(adenocarcinoma in situ, AIS)、 微浸 润 性 腺 癌(minimally invasive adenocarcinoma,MIA)、贴壁为主型肺腺癌(lepidic predominant adenocarcinoma, LPA)。2016 年国际肺癌研究学会(International Association for the Study of Lung Cancer, IASLC)共识[3]将这类疾病命名为多灶性GG/L 肺腺癌。由于该类患者病灶通常分散在双肺,且无法同期切除所有病灶,可能保留一部分结节密切随访。
多灶性GG/L 肺腺癌是一种特殊的肺腺癌,相比于同时性多原发性肺癌(synchronous multiple primary lung cancer, sMPLC),其具有治疗疗效好,复发、转移风险低的预后特征[4]。但其术式选择与切除范围缺乏统一的指导意见,同时缺乏大样本量的高质量回顾性研究[5]。上海市肺科医院针对磨玻璃结节早期肺腺癌制定的诊疗共识[6]提出,对多灶性肺结节的处理应遵循“主病灶(dominant tumor, DT) 优 先, 兼 顾 次 要 病 灶(secondary nodule, SN)”的原则。但 DT 与 SN 的相对位置存在多种模式,手术方案需经综合评估后决定。在无法完整切除所有病灶的患者中,约8.0%的残留结节可能在随访过程中发生变化[7],如大小增加、实性成分出现[8]。残留结节有无影像学进展人群的临床特征是否具有差异,需要进一步探究。Gao等[9]于2017 年回顾分析了小样本、多种族的多灶性GG/L 肺腺癌患者的临床特征。但该研究对手术方法缺乏细致分析,且未纳入因残留结节接受外科治疗的患者。
因此,本研究回顾性纳入单中心、大样本量有残留结节的多灶性GG/L 肺腺癌患者群体,分析残留结节有进展的亚组人群的临床特征与生存预后,以期为该类特殊人群的治疗模式与管理策略的制订提供参考。
1 资料与方法
1.1 研究对象 回顾性选择2016 年2 月至2019年9 月在同济大学附属上海市肺科医院胸外科接受诊治的有残留结节的多灶性GG/L 肺腺癌患者1 622 例。在术前胸部 CT 影像上,多灶性 GGN 包括病灶直径最大(≥1 cm)、影像学侵袭性具有优势的DT,至少有1 个纯磨玻璃结节。本研究经同济大学附属上海市肺科医院伦理委员会批准(K22-302),所有患者均知情并签署知情同意书。
1.2 纳入与排除标准 (1)胸部CT 影像学诊断为多发性肺结节并接受肿瘤切除手术患者;(2)通过病理报告确认病理类型为AIS、MIA、LPA 患者;(3)根据DT 病理诊断排除病理类型为非贴壁型(腺管型、乳头型、实性、微乳头型)、鳞状细胞癌、神经内分泌肿瘤、肉瘤样癌、其他未分类的肿瘤患者;(4)根据IASLC制定的多灶性GG/L 肺腺癌的临床与病理诊断标准[3],确定为多灶性GG/L 肺腺癌患者。复核患者术前、术后CT 影像。患者纳入排除流程见图1。

图1 有残留结节的多灶性GG/L 肺腺癌患者的纳入排除流程图
1.3 观察指标 收集基线资料(性别、年龄、吸烟史、DT 大小、DT 影像学表现等)、手术相关资料(DT 切除方式、整体手术方式、手术切除范围)。记录患者生存状态(死亡、截断)、总体生存时间(OS);OS 为最后1 次手术日期至随访死亡或最后1 次随访时间间隔。
1.4 随访方式 随访起点为患者第1 次手术时间;对于残留结节有影像学进展的患者,随访终点为通过胸部CT 影像学确认残留结节出现影像学进展。患者定期在胸外科门诊进行术后监测,包括胸部CT、血清肿瘤标志物检测和腹部超声检查。每年进行1 次骨扫描和脑部磁共振检查。随访频率为前 2 年每 3 个月 1 次,第 3 年每 6 个月 1 次,以后每年1 次。对于随访患者的再次干预原则:如果第1 次手术未切除的残留结节持续增大,实性成分出现、增大,外科医生在综合评估患者心肺功能后予以手术切除。将在3~6 个月内无门诊随访记录或无CT 影像记录的患者视为随访不规律,不纳入生存分析。
1.5 统 计 学 处 理 采 用 SPSS 25.0 和 R 4.2.0“MatchIt”包进行统计学分析。按照患者的性别、年龄、吸烟史、DT 切除后的病灶大小、DT 术前影像中有无实性成分等基线特征,采用倾向评分匹配(propensity score matching)方法,按照 1 ∶ 3比例匹配残留结节有进展与无进展的患者。使用Kaplan-Meier 分析法评估患者OS。连续变量以x±s 表示,组间比较采用Wilcoxon 秩和检验;分类型变量以n(%)表示,组间比较采用检验。检验水准(α)为0.05。
2 结 果
2.1 一般资料分析 1 622 例患者人口学基线特征:较年轻(≤65 岁,80.2%),女性(1 093 例,67.4%)、不吸烟者(1 456 例,89.8%)居多。多数(84.0%)患者因肺癌筛查发现肺部多灶性GGN而接受诊治。CT 影像学表现以GGN 为主型居多(74.7%)。
结果(表1)显示:与有进展组相比,匹配前无进展组的DT 最大径更大、无实性成分为主者占比更高,差异有统计学意义(P<0.01)。第1 次手术切除DT 及部分可切除的SN 后,平均随访时间为(35.51±11.29)个月(95%CI 33.74~37.29)。其中,有159 例(9.8%)患者残留结节出现了影像学进展(图2)。匹配后,2 组人群年龄、性别、吸烟史、DT 最大径及影像学表现差异均无统计学意义。

图2 多灶性GG/L 肺腺癌典型病例肺部CT 影像学特征
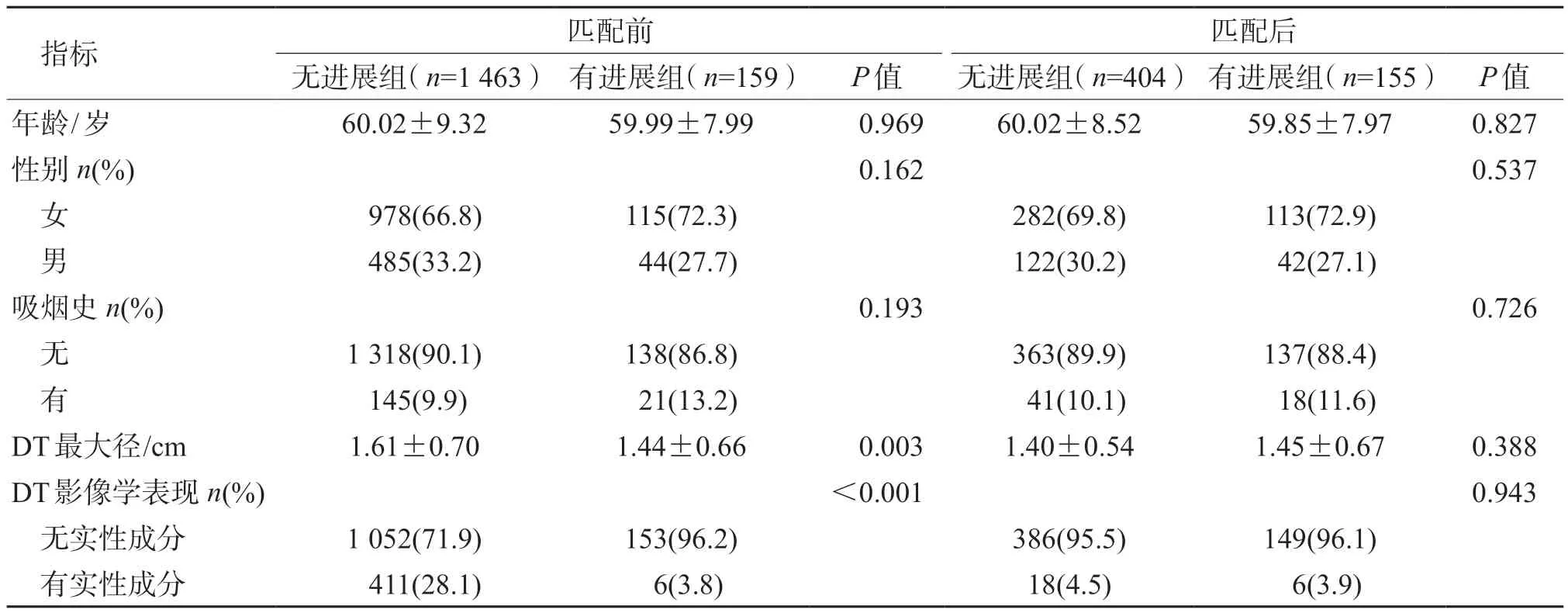
表1 残留结节有进展与无进展患者1 ∶3 倾向性评分匹配前、后的人口基线特征比较
患者女,78 岁,2015 年10 月发现双肺多发性磨玻璃结节,其中最大者(DT,1.59 cm×1.22 cm)位于左下肺,CT值-354.6 HU;右上肺见一微小磨玻璃结节(RN,最大径0.5 cm),CT 值-656.6 HU (A)。行左下肺叶切除术,术后病理提示DT 为浸润性肺腺癌(贴壁型为主)。2018 年5 月随访时发现右上肺RN 较前明显进展,1.26 cm×1.09 cm,CT 值-359.8 HU(B);经综合评估后行右上肺叶切除术,术后病理提示其为浸润性肺腺癌,贴壁型为主。
2.2 DT 肿瘤病理及基因特征 结果(表2)显示:559 例 多 灶 性 GG/L 肺 腺 癌 的 DT 以 LPA 居多(398 例,71.2%),MIA 和AIS 分别有 113 例(20.2%)和48 例(8.6%);残留结节有进展组与无进展组的DT 病理类型差异无统计学意义(P=0.478)。表皮生长因子受体(epidermal growth factor receptor,EGFR)突变基因以 L858R突变型表达占比最多(41.5%,232/559),19Del突变型占23.4%(131/559),其他类型占6.6%(37/559)。残留结节有进展与无进展组EGFR 突变基因均以L858R 为主,各突变基因亚型占比差异无统计学意义(P=0.597)。
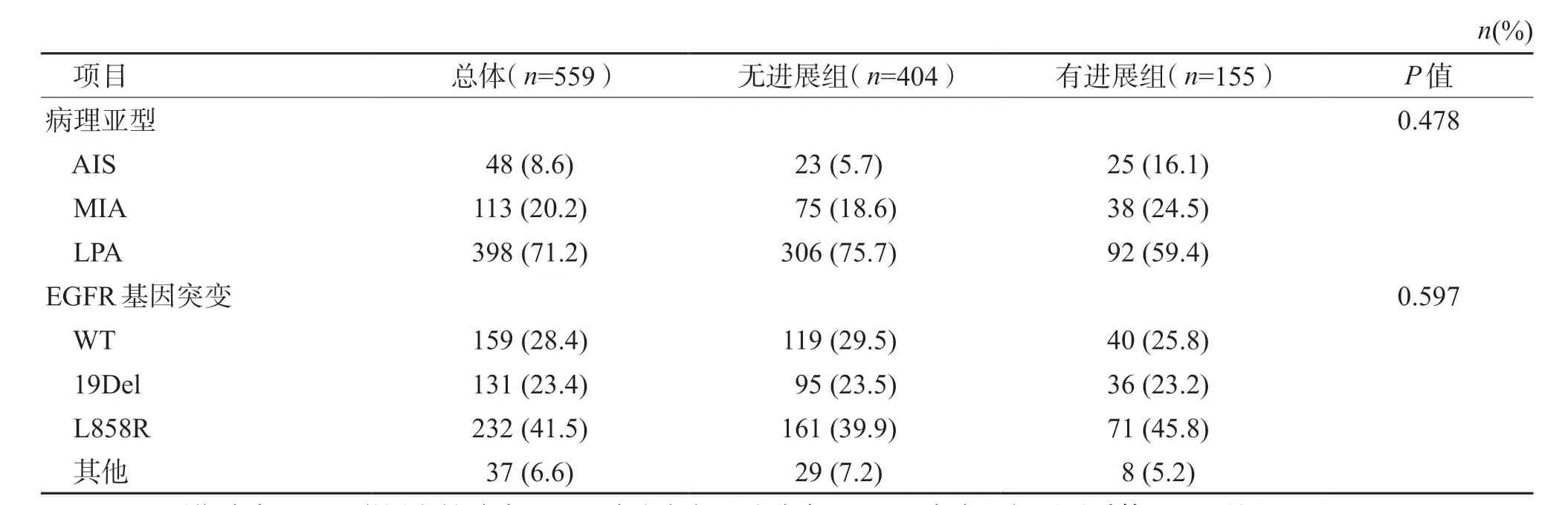
表2 残留结节无进展组与进展组患者的DT 病理及突变基因特征的比较
2.3 手术治疗 结果(表3)显示:559 例多灶性GG/L 肺腺癌患者中,DT 主要分布在右上肺(217例,38.8%)、左上肺(138 例,24.7%)。DT 的切除方式主要为肺叶切除术(320 例,57.2%),亚肺叶切除以肺段切除居多(176 例,31.5%)。多数手术切除为单一肺叶(350 例,62.6%)切除。DT 与SN 位于同一肺叶者有423 例(75.7%),手术方式以肺叶切除为主(280 例,66.2%);DT与SN 位于同侧不同肺叶者有150 例(26.8%),手术方式以肺叶联合亚肺叶切除为主(84 例,56.0%),联合亚肺叶切除占44.0%;DT 与SN 位于不同侧者有43 例(7.7%),手术方式以联合亚肺叶切除为主(23 例,53.5%),肺叶联合亚肺叶切除占46.5%。
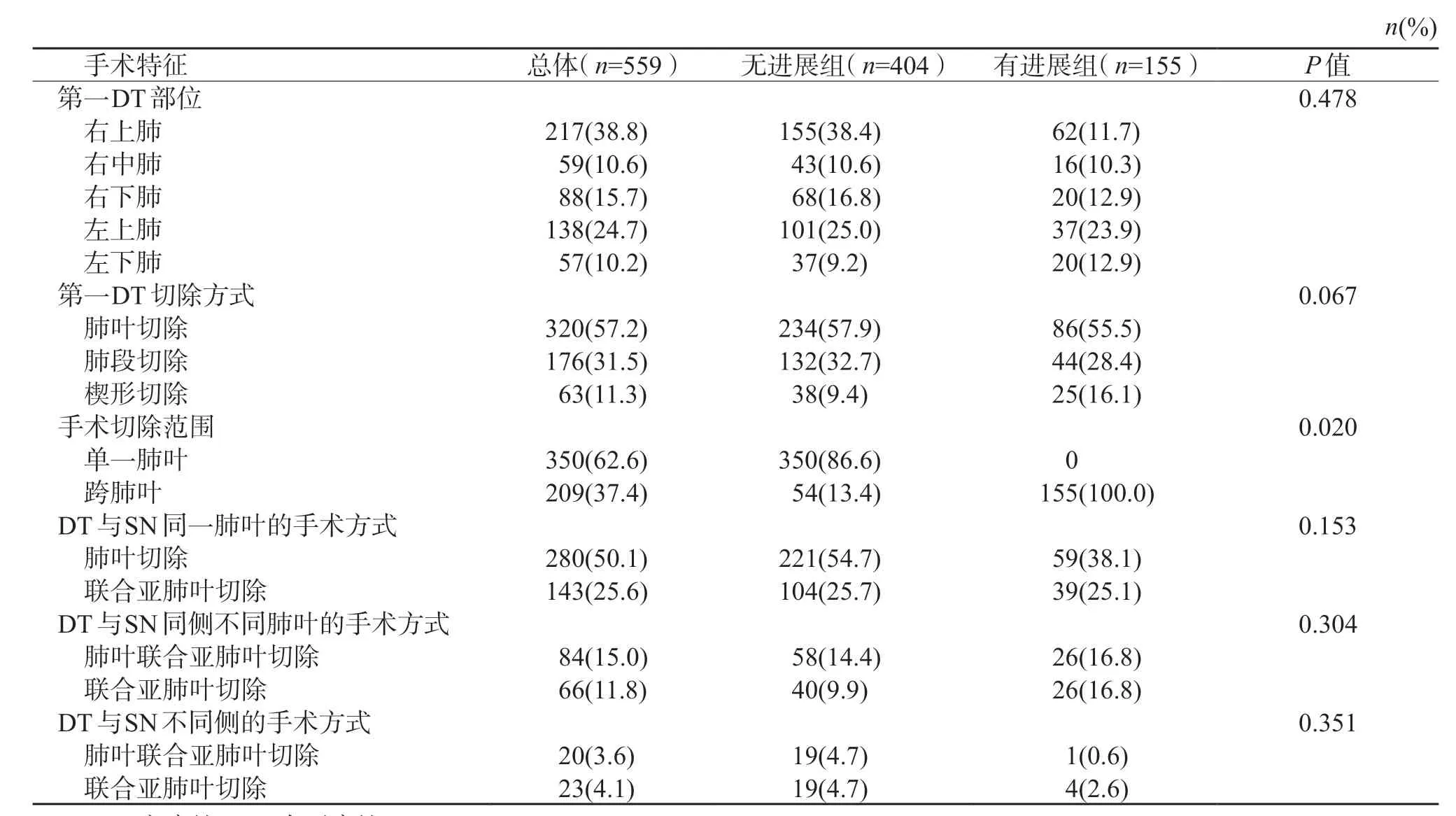
表3 2 组患者的第1 次手术方式特征比较
2 组患者接受DT 解剖性肺切除术(肺叶、肺段、楔形切除)的比例相仿;进展组患者的手术切除范围均为跨2~3 个肺叶,肺叶切除范围与无进展组差异有统计学意义(P<0.05)。DT 与SN 位于同肺叶、同侧不同肺叶或不同侧肺时,残留结节有进展组与非进展组患者第1 次接受的手术方式差异均无统计学意义。
2.4 生存分析 结果(图3)显示:559 例多灶性GG/L 肺腺癌患者的5 年OS 率为98.5%。进展组2次手术后有4 例患者局部复发,2 组人群的5 年OS率差异无统计学意义(97.5% vs 100%,P=0.122);手术切除范围在单一肺叶的亚组患者与切除范围跨2~3 个肺叶的亚组患者的5 年OS 率差异无统计学意义(98.9% vs 99.3%,P=0.794)。
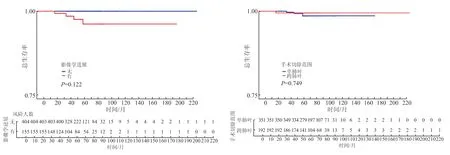
图3 多灶性GG/L 肺腺癌患者的5 年OS 率
3 讨 论
本研究发现,多灶性GG/L 肺腺癌患者的人群特征为年龄≤65 岁、女性、不吸烟者偏多。在影像学表现上,多发病灶以GGN 为主型居多,病理类型以LPA 居多,提示GGN 表型与肺腺癌病理分类相关。有研究[10]证明,多灶性GGN 手术切除的病灶多为腺癌或癌前病变(98.9%)。多灶性GG/L肺腺癌呈惰性生长,约75%的GGN 病灶不具有潜在侵袭性[11]。既往研究[12]证明,腺癌贴壁为主型的生长模式与无淋巴结受累是sMPLC 的独立有利预后因素。因此,此类人群接受外科治疗的预后很好[4,13]。
本研究中,残留结节有进展与无进展组患者DT 病理亚型、EGFR 突变基因表达差异均无统计学意义;进展组切除范围较大(跨肺叶),由于该因素与DT 与SN 的相对位置有关,将其与手术方式进行整合,发现两组手术方式差异无统计学意义。究其原因:(1)多灶性GG/L 肺腺癌各病灶之间相对独立,即每个病灶在肿瘤发生起源上互不影响[14-15]。因此,探讨残留结节进展相关风险因素时,除分析患者临床特征外,也应寻找流行病学病因,分析患者风险暴露相关遗传变异因素[16];(2)手术方式可能通过术后并发症、围术期死亡率来影响生存,但其不影响残留结节的影像学、病理亚型的变化。既往研究[9,17]提示,肺切除程度可能影响多发性肺腺癌患者的生存[17],但与残留结节进展或进展相关干预无关[9]。
本中心对多灶性GG/L 肺腺癌的首要策略是根治性切除DT。DT 的大小与病理亚型决定了患者最高的T 分期,是预后独立影响因素[7]。因此,本研究中DT 的切除方式以解剖性肺切除为主,其中超过50%为肺叶切除、肺段切除占31.5%。而肺段切除为最大径≤2 cm、实性成分占比(CTR)>0.5 的周围型肺癌的标准术式[18],因此本中心对于影像学特征为最大径≤2 cm、CTR≤0.5 的DT,积极采取肺段切除术。解剖性切除方式对肿瘤学结局影响也较小。另外,外科手术的整体设计需要考虑DT 与SN 的相对位置。在外科手术策略上,一项全球范围调查研究[19]发现,81%的外科医生倾向行手术切除,手术方式以肺叶切除术(针对DT)联合肺段切除术(针对SN)为主。本研究中,DT 与SN 位于同一肺叶时,以单一肺叶切除为主(66.2%),这样可避免在单一肺叶范围内行联合亚肺叶切除导致切缘不足和局部复发增加的风险。DT 与SN 位于同侧不同肺叶时,建议选择肺叶联合亚肺叶切除或者联合亚肺叶切除。在对DT行根治性解剖性切除后,由于SN 在不同肺叶上,有足够的切除范围,保证切缘超过2 cm 条件下选择亚肺叶切除可以减少肺功能损失,提高术后生活质量,也避免了左全肺切除的发生[17,20]。当 DT 与SN 位于不同侧时,手术方式与DT 与SN 同侧不同肺叶的情况相同,但切除DT 或SN 的优先性应综合考虑患者的估计术后肺功能、各肺叶通气灌注比值与手术难易程度,评估手术过程中对侧肺单肺机械通气压力和患者耐受性后决定[21]。
另外,本研究生存分析发现,多灶性GG/L肺腺癌的患者接受外科治疗的预后良好,5 年OS 率达98.5%,这与其影像学表现以GGN 为主型、病理亚型为贴壁型肺腺癌密切相关。有研究[12]表明,GGN 与贴壁为主型病理成分均是该类患者预后较好的相关因素。本研究中2 组患者的5年 OS 率相似(97.5% vs 100%,P=0.122),说明无论残留结节有无影像学进展可能都不影响患者的预后,与既往研究[9,12]观点一致。虽然残留结节影像学表现为实性成分增加或大小增长(可能与中低分化的浸润性成分发展有关),但该亚组患者在接受第2 次手术后依然能获得95%以上的5 年生存期。该结论说明:(1)对于多灶性GG/L 肺腺癌患者,如果存在无法完整切除的残留结节,外科医生应严格把握手术指征,对残留结节进行术后密切随访;(2)残留结节出现影像学进展后,有可能发展为浸润性程度更高的肿瘤,可考虑进行第2 次手术切除,该类患者应中断随访,积极接受后续外科治疗,以获得良好预后。
本研究存在一定局限性:(1)为回顾性研究,患者的筛选与纳入可能受研究类型的限制而存在选择性偏移。采用PSM 方法对残留结节有无进展亚组人群的基线特征进行平衡,但可能导致病例纳入不完全。(2)缺乏残留结节进展后接受手术切除患者的术后肺功能、生活质量及经济效益相关数据,无法综合评估纳入患者的其他临床结局,有待进一步研究。
综上所述,本研究发现多灶性GG/L 肺腺癌患者的临床特征与sMPLC 相似,但整体预后较好。在手术策略上应遵循优先解剖性切除DT,联合亚肺叶切除SN 的原则,综合选择治疗方案。而且,残留结节有无进展以及进展后接受第2 次手术切除并不影响患者的预后。当残留结节发现影像学进展后需要评估再次手术治疗的指征。
利益冲突:所有作者声明不存在利益冲突。

