外周血中性粒细胞/淋巴细胞比值和血小板/淋巴细胞比值预测前列腺癌去势治疗后的病情进展
罗后宙,陈国强
三亚中心医院(海南省第三人民医院)泌尿外科,海南 三亚 572000
前列腺癌(prostate cancer,PC)是男性恶性肿瘤中发病率第一的癌症[1],我国PC发病率约9/10万,并呈逐年上升趋势[2]。PC在早期无明显特殊不适,随着病情进展患者出现排尿困难、尿频、血尿、骨痛等症状,确诊时多已处于晚期。对于丧失手术机会的晚期PC 患者,雄激素剥夺疗法(也称为去势治疗)是其一线治疗方案。该疗法虽可抑制PC 癌细胞生长[3],但几乎所有患者都将在18~24 个月的内分泌治疗期间进展成为去势抵抗性前列腺癌(castration⁃resistant prostate cancer,CRPC)[4],越早出现去势抵抗的患者往往预后更差、生存时间更短[5]。因此,预估去势治疗反应性、延长患者生存时间成为研究人员关注的首要问题。
免疫功能与癌症机制息息相关,中性粒细胞/淋巴细胞比值(neutrophil⁃to⁃lymphocyte ratio,NLR)和血小板/淋巴细胞比值(platelet⁃to⁃lymphocyte radio,PLR)等免疫指标已被证实与食管癌、肺癌、乳腺癌等多种癌症的预后和治疗反应性有关[6-8]。Martínez等[9]报道PLR和NLR可预测CRPC患者阿比特龙的治疗反应性,提示免疫指标或可为预测PC预后带来一定信息。接受去势治疗的PC 患者治疗反应性欠佳时即发展成CRPC,据此,本研究探讨NLR、PLR与去势治疗1 年内发展为CRPC 的关系,以期发现NLP、PLR在预测CRPC上的价值。
1 对象和方法
1.1 对象
纳入2017年5月—2020年5月收治于三亚中心医院(海南省第三人民医院)的170 例PC 患者作研究对象,纳入标准:①处于局部进展期和转移性PC的T2~T4 期患者[4],年龄>20 岁;②已签署知情同意书;③去势治疗的初治患者。排除标准:①合并其他肿瘤、免疫系统疾病及心、肝、肾等重要器官功能不全,不配合治疗者;②其他原因死亡者;③伴有隐睾、单侧睾丸等先天缺陷;④伴有急性或慢性感染性疾病、全身炎症性疾病。将随访期间进展成CRPC 的患者纳入进展组,其余纳入稳定组。本研究已由三亚中心医院(海南省第三人民医院)伦理委员会审核通过(批准号:KY20180516006)。
1.2 方法
1.2.1 研究方案
比较两组基线一般资料[年龄、分期、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)、Gleason 评分等]和实验室检查结果[PLR、NLR、前列腺特异性抗原(prostate specific antigen,PSA)、血红蛋白(hemoglobin,Hb)等]。应用单因素分析和多因素Logistic 回归分析法分析患者进展成CRPC的相关因素,并绘制受试者工作特征(receiver operating characteristic,ROC)曲线评估NLR 和PLR对患者1年内发生CRPC的预测效能。
1.2.2 治疗方案
所有患者治疗方式统一,均接受药物去势联合抗雄激素治疗,内分泌治疗失败后行二线内分泌治疗,二线内分泌治疗失败后行化疗或对症治疗。药物去势方案:戈舍瑞林注射液(国药准字X19990231,Astra Zeneca 公司,英国)皮下注射,3.6 mg/次,每28 d注射1次。抗雄激素方案:比卡鲁胺片(国药准字J20150050,Astra Zeneca公司,英国)口服,50 mg/次,1次/d。对患者实施为期1年的随访,首次治疗1个月后随访1 次,此后每3 个月复诊1 次,若无特殊情况随访以门诊或电话的形式进行。以患者发生CRPC或死亡作为终点事件,CRPC定义为:血清睾酮达到去势水平,连续3 次测量观察到PSA 持续上升或影像学进展[4]。
1.2.3 检测免疫相关指标
记录患者入组时NLR、PLR、单核细胞/淋巴细胞比值(monocyte⁃to⁃lymphocyte ratio,MLR)。取患者5 mL 空腹静脉血全血置于乙二胺四乙酸抗凝管中保存,通过应用美国Beckman 全自动生化分析仪和VSC技术获得NLR、PLR、MLR值。
1.2.4 检测PSA
入组和每次复诊时取患者空腹静脉血5 mL,3 000 r/min 离心10 min,离心半径16 cm,取上清液置于-80 ℃冰箱中保存待检。采用免疫化学发光法和全自动化学发光免疫分析仪检测血清PSA 水平,试剂盒购自北京北方生物技术研究所有限公司。比较两组不同PSA 基线水平段(<20 ng/mL、20~100 ng/mL、>100 ng/mL)[10]的例数分布。将一线内分泌治疗过程中患者的PSA 水平最低值计作PSA nadir,以所有患者PSA nadir 中位数为界,比较两组不同PSA nadir水平段(<中位数和≥中位数)的例数分布。
1.3 统计学方法
采用SPSS 25.0 统计学软件分析。计量资料采用均数±标准差()表示,组间比较采用两独立样本t检验;计数资料用例(百分比)[(n)%]表示,应用χ2检验;比较组间等级资料差异采用秩和检验;应用多因素Logistic 回归分析法分析患者进展至CRPC的相关因素;应用ROC曲线评估NLR和PLR对患者1 年内发生CRPC 的预测效能,De Long 法比较曲线下面积(area under the curve,AUC)差异,利用ROC曲线获取NLR和PLR的截点(cut⁃off值);P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
截至2021年5月30日,排除14例失访及2例其他原因死亡患者后,剩余154 例中44 例纳入进展组,110例纳入稳定组,两组各有32例、10例患者于随访期间因PC 死亡;最终纳入患者的平均年龄为(71.97±6.02)岁,Gleason 评分<8分者共83例,≥8分者71例,远处转移103例。
两组Gleason 评分、T 分期、N 分期例数分布比较,差异均有统计学意义(P<0.05);两组其余指标比较差异均无统计学意义(P>0.05,表1)。
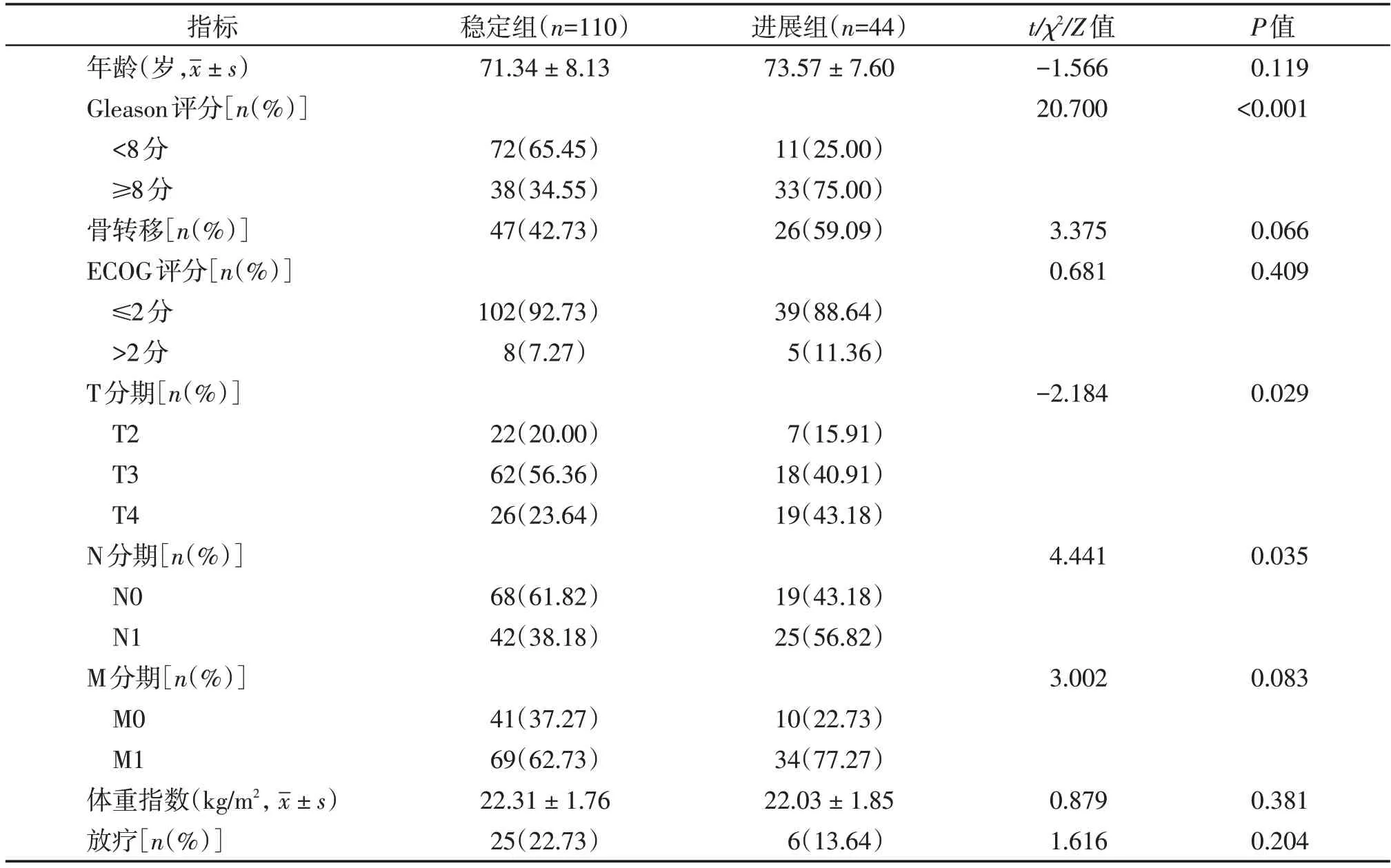
表1 两组一般资料比较Table 1 Comparison of general information between the two groups
2.2 两组实验室检查结果比较
进展组NLR 和PLR 高于稳定组(P<0.05),两组不同水平PSA 和PSA nadir 例数分布比较差异有统计学意义(P<0.05);两组其余指标比较差异均无统计学意义(P>0.05,表2)。
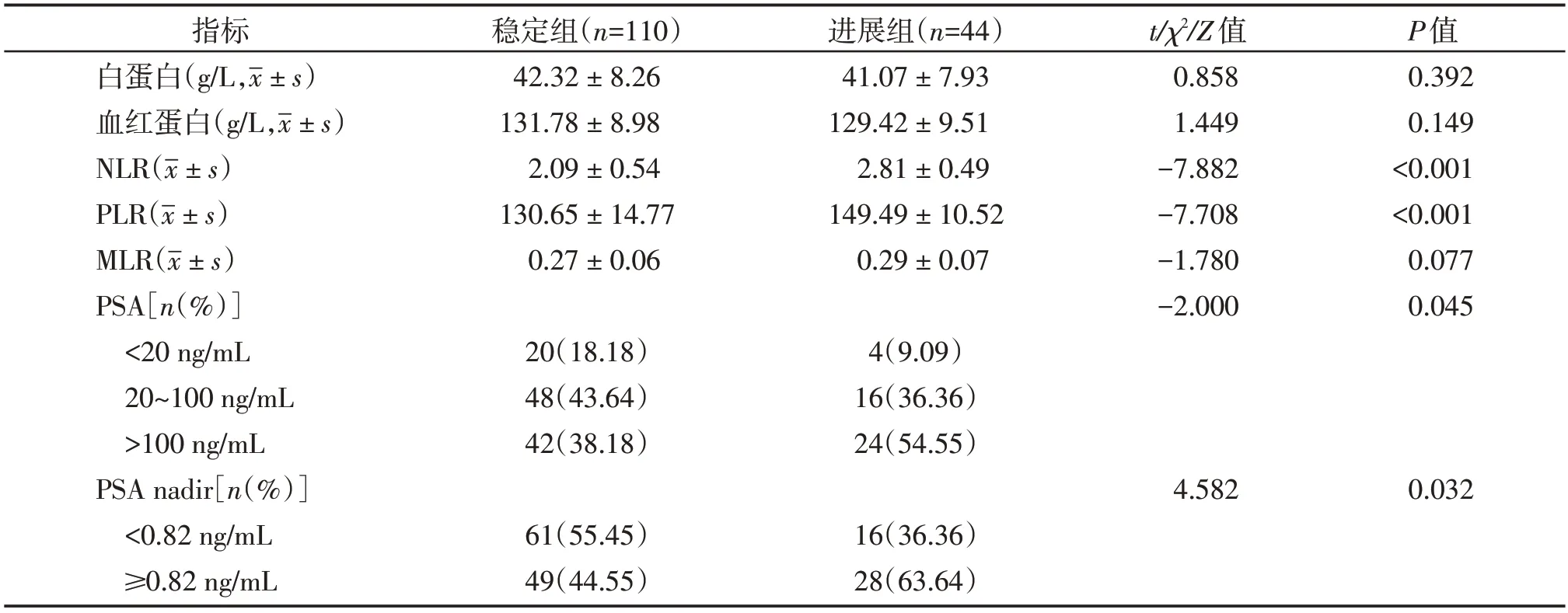
表2 两组实验室检查结果比较Table 2 Comparison of laboratory test results between the two groups
2.3 不同NLR和PLR值患者1年内生存情况比较
以所有患者NLR值中位数2.234将患者分为高NLR组和低NLR组(各77例),再以所有患者PLR值中位数135.822 将患者分为高PLR 组和低PLR 组(各77例);观察到低NLR组患者1年累积死亡率低于高NLR 组(log rankχ2=5.094,P=0.024);低PLR 组患者1 年累积死亡率低于高PLR 组(log⁃rankχ2=9.931,P=0.002,图1)。
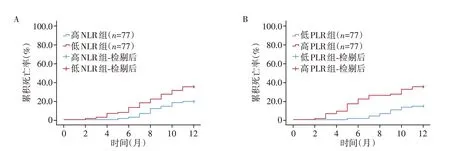
图1 不同NLR值患者和不同PLR值患者1年累积死亡率Figure 1 Cumulative 1⁃year mortality in patients with different NLR or with different PLR
2.4 两组进展至CRPC 相关因素的多因素Logistic回归分析
Gleason 评分≥8 分(OR=3.998,P=0.034)、PLR(OR=1.156,P<0.001)、NLR(OR=13.844,P<0.001)、T4 分期(OR=16.252,P=0.048)为进展至CRPC的独立危险因素,赋值情况见表3,结果见表4。
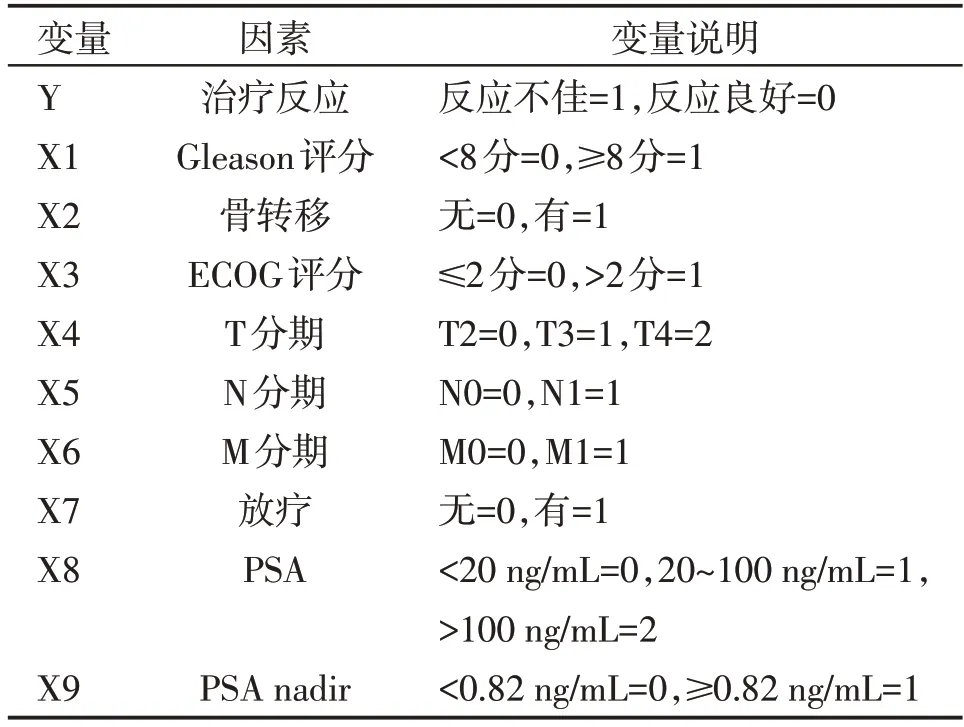
表3 赋值情况说明Table 3 Description of the assignment

表4 两组进展至CRPC相关因素的多因素Logistic回归分析结果Table 4 Multivariate logistic regression analysis results of the factors associated with CRPC progresion
2.5 NLR和PLR对PC患者1年内发生CRPC的预测效能
ROC曲线示,NLR和PLR预测PC患者1年内发生CRPC 的AUC 分别为0.845 和0.865,两者AUC 值比较差异无统计学意义(Z=0.420,P=0.675,图1,表5)。

表5 NLR 和PLR 预测PC患者1年内发生CRPC 的AUCTable 5 AUC of NLR and PLR predicting the occurrence of CRPC in PC patients within 1 year
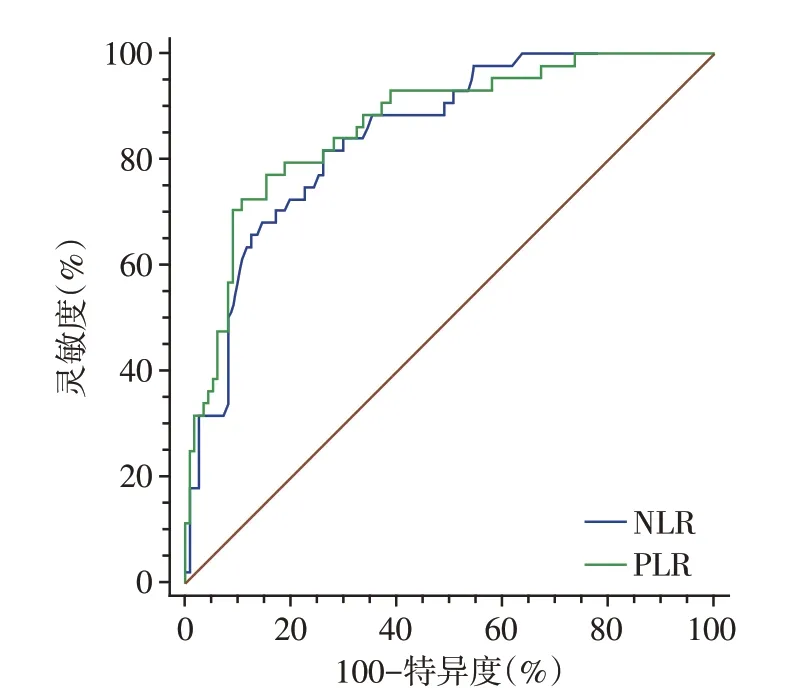
图1 NLR 和PLR 预测PC 患者1 年内发生CRPC 的ROC曲线Figure 1 ROC curves of NLR and PLR predicting the occurrence of CRPC in PC patients within 1 year
3 讨论
PC 是男性泌尿生殖系统最常见的恶性肿瘤之一,日益成为男性的健康威胁。雄激素剥夺治疗能减少雄激素对癌细胞的促进作用,但不能阻止PC向CRPC 进展,患者一旦进入CRPC,预后不尽人意[11]。因此,寻找影响去势治疗反应性的相关因素成为困扰医生的一大难题。近年来有研究表明NLR 与PC进展和预后相关[12],提示免疫相关指标可能预测患者预后和治疗反应性。本研究基于此,探讨接受雄激素剥夺治疗的PC 患者免疫相关指标与进展至CRPC之间的关联。
众所周知,肿瘤的分化程度和分期与预后息息相关[13]。本研究中,两组Gleason 评分、T 分期、N 分期例数分布比较,差异均有统计学意义;两组PSA和PSA nadir例数分布比较差异有统计学意义;Glea⁃son评分≥8分和T4分期为进展至CRPC的独立危险因素。PC 患者T 分期和Gleason 评分与进展至CRPC 相关,T 分期和Gleason 评分较高的患者肿瘤进展越严重,这种效应可能与变化了的肿瘤细胞间质炎症因子通路有关[14],详细机制还需更多研究证实。本研究未观察到PSA和PSA nadir与CRPC的相关性,但江绍钦等[15]报道Gleason评分、最低PSA值、PSA 到达最低值时间是PC 去势治疗后出现CRPC的独立危险因素,与本研究结果不同,可能是由于该研究随访时间为6~92个月,而本研究限定随访时间为1年所致。
免疫状态影响着肿瘤细胞的代谢活动,NLR 和PLR 等免疫指标已被证实与多种肿瘤预后相关[16]。本研究观察到低NLR组患者1年累积死亡率低于高NLR 组,低PLR 组患者1 年累积死亡率低于高PLR组,PLR和NLR为进展至CRPC的独立危险因素;二者预测1 年内发生CRPC 的AUC 分别为0.845 和0.865。PC 肿瘤细胞能分泌大量细胞因子,引起炎症反应,造成中性粒细胞、淋巴细胞、血小板数量改变[17]。Kwon 等[18]报道中性粒细胞又可分泌大量炎症因子,促进肿瘤扩散,并能分泌中性粒细胞明胶酶相关载脂蛋白和多种生长因子促进PC 癌细胞的增殖。而淋巴细胞参与了肿瘤细胞的凋亡过程,但中性粒细胞可抑制淋巴细胞对肿瘤的细胞毒性作用,进一步推动了癌症进展。Sun 等[19]报道NLR 和PLR值升高与PC进展相关,NLR还与总生存率和无病生存率有关,NLR越高无病生存率越差。该结论一定程度上支持了本研究中NLR 和PLR 与预后相关的观点,但与本文终点事件的选取上有所区别。陈一鸣等[20]报道,在PC 患者中,高PLR 组和高NLR组未发生CRPC的生存时间分别低于低PLR组和低NLR 组,PLR≥115.0 和NLR≥2.3 是早期发生CRPC的独立危险因素。即使该研究与本研究在随访时长上不同,但二者得出了相似的结论。本研究还观察到PLR和NLR对患者1年内发生CRPC的预测效能良好,提示免疫指标有助于初步筛查出CRPC 高风险患者,对拟定治疗方案意义重大。此外,本文存在不足之处,研究对象仅纳入药物去势治疗的PC患者,有待丰富研究内容以挖掘手术去势治疗患者免疫相关指标与发生CRPC的关系。
综上,药物去势治疗的PC 患者NLR 和PLR 基线值与早期进展为CRPC 有关,免疫相关指标可为预测此类患者发生CRPC提供一定参考。

