吸入CDDO⁃NO对野百合碱诱导的大鼠肺动脉高压的作用
伍雪橙,李 南,黄 文,周淑兰,周 宏,黄张建,孔 辉,解卫平*
1南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029;2中国药科大学新药研究中心天然药物活性组分与药效国家重点实验室,江苏 南京 210009
肺动脉高压(pulmonary arterial hypertension,PAH)是一种以肺血管重构和肺血管负荷进行性增加为特征的病理生理状态,可致右心室肥厚和重构,最终导致患者右心衰竭和死亡[1]。与PAH 相关的经典信号通路包括内皮素途径,一氧化氮(nitric oxide,NO)途径和前列环素途径[2]。PAH 病理生理机制复杂,目前指南推荐大多数PAH患者初治联合用药[3]。然而,这些靶向药物费用较高,存在一定不良反应,且随疗程延长疗效逐渐减弱。因此,探索治疗PAH的新策略,延长患者生存期、改善预后,已成为目前亟待解决的重要问题。
NO是一种重要的血管内皮源性舒张因子。NO进入细胞后通过激活鸟苷酸环化酶⁃环磷酸鸟苷⁃蛋白激酶G途径,使胞内Ca2+浓度降低,引起肺动脉平滑肌舒张,从而降低肺动脉压力[4-5]。然而,外源性吸入NO在治疗PAH中应用受限,其半衰期短,治疗窗窄,可导致高铁血红蛋白血症等不良反应[6]。NO供体,包括硝酸甘油、单硝酸异山梨酯(isosorbide 5⁃mononitrate,ISMN)和硝普钠等,由于其对体循环降压作用明显,也不适用于PAH 的治疗[7]。但研究发现,以吸入方式使用NO供体,则可选择性舒张肺血管,可能具有治疗PAH的潜力[8]。
齐墩果酸是一种从油橄榄叶子中提取的具有抗炎、镇静、抗肿瘤作用的三萜类化合物,可用于治疗肝损伤、肝纤维化等疾病[9]。2⁃氰基⁃3,12⁃二氧齐墩果烷⁃1,9(11)⁃二烯⁃28⁃酸甲酯(bardoxolone methyl,CDDO⁃Me),即甲基巴多索隆,是一种半合成齐墩果酸衍生物。CDDO⁃Me 具有抗氧化应激及抗炎性损伤的作用。一方面,CDDO⁃Me 促进核因子E2 相关因子2(nuclear factor erythroid 2⁃related factor 2,Nrf2)向核内转位,后者结合抗氧化反应元件(anti⁃oxidant response element,ARE),诱导多个抗氧化基因转录,翻译出醌氧化还原酶(NADPH dehydroge⁃nase quinone 1,NQO⁃1)、血红素加氧酶1(heme⁃oxy⁃genase⁃1,HO⁃1)等蛋白,发挥抗氧化应激效应;另一方面,CDDO⁃Me减少核因子⁃κB(nuclear factor kappa⁃B,NF⁃κB)向核内移位,降低下游炎症因子表达,发挥抗炎、抗纤维化作用[10-11]。因此,CDDO⁃Me 通过活化Nrf2 及抑制NF⁃κB,减轻氧化应激及炎症对肺血管的损伤,可能具有抑制肺血管重构的作用。
本课题组与中国药科大学合作,基于CDDO⁃Me及ISMN 化学结构特点合成一种新型NO 供体型CDDO⁃Me 衍生物CDDO⁃NO(a novel hybrid from CDDO⁃Me and NO donor isosorbide 5⁃mononitrate)。在肺内CDDO⁃NO 可经酯酶水解缓慢释放NO 分子和CDDO⁃Me,理论上具有同时舒张肺血管、抑制血管重构的双重效应。本研究通过建立野百合碱(monocrotaline,MCT)诱导的大鼠PAH模型,研究吸入CDDO⁃NO 对PAH 大鼠肺血管重构的作用,并比较其与母体化合物CDDO⁃Me 的效应,为治疗PAH开发针对多靶点的新型化合物。
1 材料和方法
1.1 材料
清洁级雄性SD 大鼠36 只,体重(270±20)g,由上海斯莱克实验动物有限责任公司提供,本实验所有操作经南京医科大学实验动物福利伦理审查委员会许可(伦理编号:IACUC⁃2106004)。CDDO⁃NO和CDDO⁃Me 由中国药科大学天然药物国家重点实验室提供。MCT(Sigma 公司,美国),苏木素伊红(hematoxylin⁃eosin,HE)染色试剂盒(上海碧云天生物技术有限公司),抗α⁃平滑肌肌动蛋白(α⁃smooth muscle actin,α⁃SMA)抗体(Abcam公司,英国),马松三色染色(Masson trichrome staining,MTS)试剂盒(北京索莱宝科技有限公司),口鼻暴露式雾化吸入装置(Scireq公司,加拿大)。
1.2 方法
1.2.1 建立MCT诱导的大鼠PAH模型和给药方案
SD 大鼠36 只,自适应1 周后随机分为6 组(每组6 只):①对照组(Con 组);②MCT 组;③MCT+10 μg/kg CDDO⁃NO 组(MCT+10NO 组);④MCT+30 μ g/kg CDDO⁃NO 组(MCT+30NO 组);⑤MCT+7 μg/kg CDDO⁃Me组(MCT+7Me组);⑥MCT+21 μg/kg CDDO⁃Me 组(MCT+21Me 组)。其中③和⑤组属低剂量药物组,④和⑥组属高剂量药物组。Con 组腹腔注射生理盐水1 mL,其余各组均给予60 mg/kg MCT 腹腔注射1次造模,药物治疗各组在MCT 注射1 h 后通过口鼻暴露式雾化吸入装置给药。后每日雾化吸入给药,共28 d。
1.2.2 右心导管测定大鼠右心室收缩压(right ven⁃tricular systolic pressure,RVSP)
大鼠腹腔注射2%戊巴比妥钠(60 mg/kg)充分麻醉后仰卧位固定,颈前区作一2~3 cm 切口,钝性分离颈部皮下组织并剥离颈外及颈内静脉,选择颈外或颈总静脉剪一V 型切口,微型导管连接压力传感器(TSD104A 压力换能器,BIOPAC Systems 公司,美国),经静脉切口送入上腔静脉,根据16通道生理信号记录分析仪(MP100,BIOPAC Systems,美国)上显示的波形变化判断导管位置,当导管到达右心室后记录RVSP。
1.2.3 测定右心肥厚指数(right ventricular hypertro⁃phy index,RVHI)及右室/体重比(RV⁃to⁃body weight ratio,RV/BW)
RVSP 测定完毕后收集大鼠心脏组织,沿室间隔边缘游离出右心室(right ventricle,RV)及左心室+室间隔(left ventricle+septum,LV+S)。滤纸吸干水分后分别称量RV 和LV+S,计算RV/(LV+S)比值,即为RVHI。隔日称量大鼠体重,计算大鼠第29 天的RV/BW。
1.2.4 HE 染色检测肺小动脉中膜层厚度(pulmo⁃nary artery medial thickness,PAMT)
收集大鼠肺组织,置于4%多聚甲醛中固定24 h后石蜡包埋,制成5 μm切片后进行HE染色,于光学显微镜下(×400)观察肺小动脉形态学改变。每个样本拍摄20个直径30~100 μm的小动脉,选取血管长轴和短轴并用Image Pro Plus 6.0软件分别测量其内径和外径,计算PAMT=[(外径-内径)/外径]×100%。
1.2.5 HE 染色检测心肌细胞横截面积(cross⁃sec⁃tional area,CSA)
收集右心组织后置于4%多聚甲醛固定,常规石蜡包埋切片后行HE 染色,置于光学显微镜下(×400)观察右心室心肌细胞横截面,采用Image J软件随机统计20个心肌细胞的CSA。
1.2.6 Masson 三色染色测定肺小动脉外膜胶原纤维沉积百分比
肺组织石蜡切片均按Masson 三色染色试剂盒步骤说明进行操作。光镜下(×400)随机选取15~20 个肺小动脉,Image Pro Plus 6.0 软件统计胶原纤维沉积(蓝色)面积与总面积的比值,评估肺小动脉外膜纤维化程度。
1.2.7 α⁃SMA 免疫组织化学染色测定肺小动脉肌化程度
石蜡切片脱蜡水化,抗原修复液微波修复,3%双氧水浸泡15 min 灭活过氧化物酶,5%BSA 封闭30 min,滴加1∶200的α⁃SMA 一抗工作液于玻片上,4 ℃孵育过夜,二抗1∶2 000孵育1 h,二氨基联苯胺显色10 min后自来水冲洗,苏木素快速染色10~30 s,自来水冲洗,脱水透明后中性树胶封片。光学显微镜下观察(×400),根据肺小动脉α⁃SMA阳性表达部分(棕黄色)占血管周径的比例,将其分为非肌化(<25%)、部分肌化(25%~75%)和完全肌化(>75%)3种类型的血管,统计各类型血管所占百分比。
1.3 统计学方法
数据分析及作图采用GraphPad Prism 6.0 软件。所有数据以均数±标准差()表示。单因素多个样本均数比较采用单因素方差分析,组间比较使用LSD 法。两因素多个样本均数比较采用双因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CDDO⁃NO 对MCT 诱导的PAH 大鼠体重增长、RVSP、RVHI和RV/BW的影响
大鼠体重监测结果显示:与Con组相比,MCT造模可使大鼠体重增长显著减少,差异有统计学意义(P<0.05,图1A)。与MCT 组相比,低剂量药物组(MCT+10NO 组和MCT+7Me 组)可改善大鼠体重增长(P<0.05,图1A),而高剂量组(MCT+30NO 组和MCT+21Me 组)对其体重增长无显著改善作用(P>0.05)。
RVSP 是间接反映肺动脉压力的重要指标。右心导管测定结果显示MCT组RVSP较Con组显著升高(P<0.05,图1B)。与MCT 组相比,CDDO⁃NO 和CDDO⁃Me均可显著降低RVSP(P<0.05),其中同一给药的高剂量组RVSP较低剂量组有下降趋势,但差异无统计学意义(P>0.05)。CDDO⁃NO组与其同等剂量的CDDO⁃Me组相比,差异亦无统计学意义(P>0.05)。
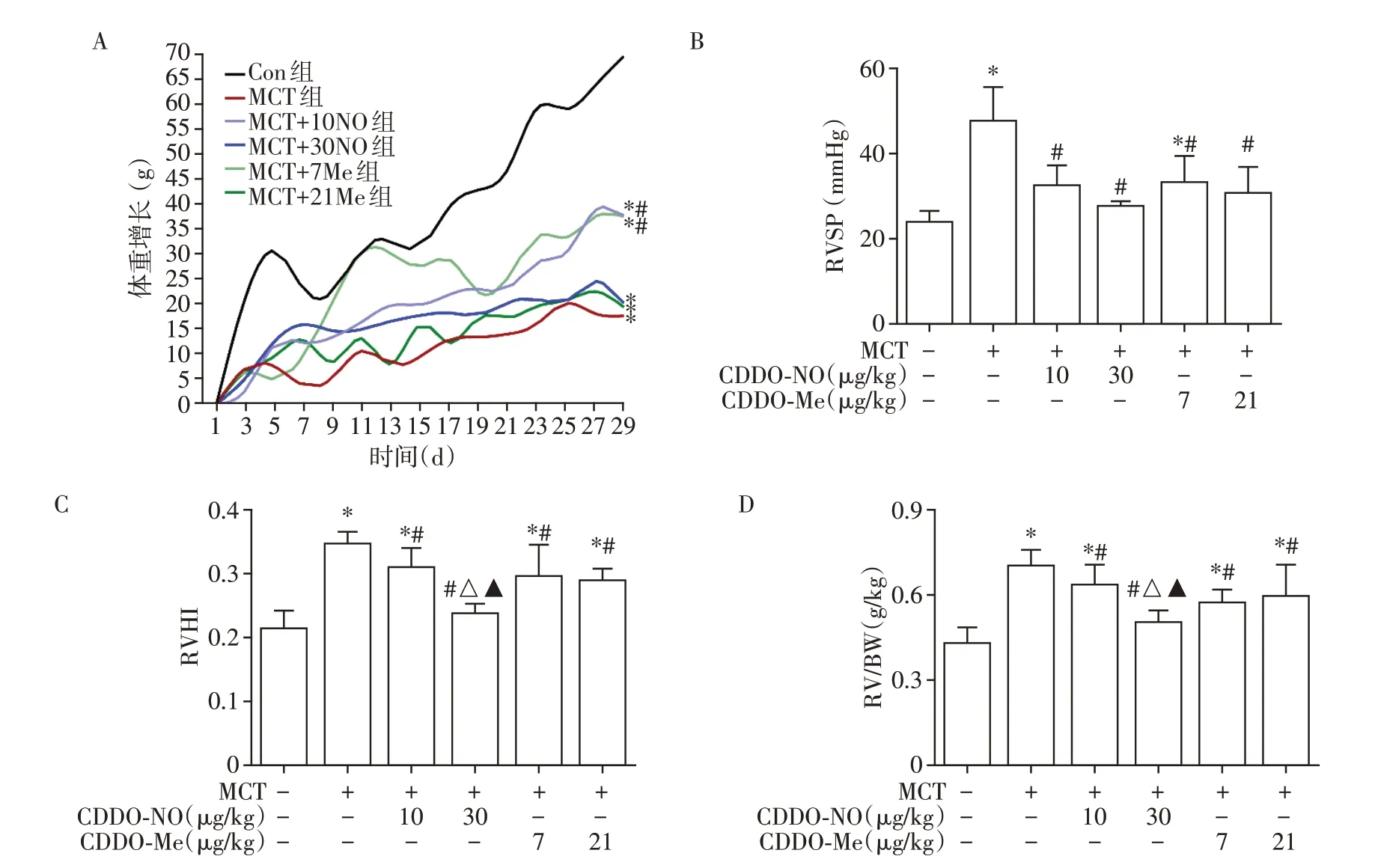
图1 CDDO⁃NO对MCT诱导的PAH大鼠体重增长、RVSP、RVHI和RV/BW的影响Figure 1 Effects of CDDO⁃NO on weight gain,RVSP,RVHI and RV/BW in MCT⁃induced PAH rats
RVHI 和RV/BW 均是反映右室肥厚程度的指标。结果表明与Con 组相比,MCT 组大鼠RVHI 和RV/BW 升高(P<0.05,图1C、D)。与MCT 组相比,CDDO⁃NO和CDDO⁃Me可降低大鼠RVHI和RV/BW(P<0.05,图1C、D)。同一药物高低剂量比较发现,MCT+30NO组的RVHI和RV/BW较MCT+10NO组显著降低(P<0.05),CDDO⁃Me组间右室重构指标差异无统计学意义(P>0.05)。比较不同药物同等剂量组发现,低剂量CDDO⁃NO 和CDDO⁃Me 组间效应差异无显著统计学意义(P>0.05),而MCT+30NO组抑制右室重构作用显著强于MCT+21Me组(P<0.05)。
2.2 CDDO⁃NO对MCT诱导的PAH大鼠PAMT的影响
因结果2.1 表明高剂量药物组(MCT+30NO 组和MCT+21Me 组)在改善血流动力学和右室重构指标方面分别优于其对应低剂量组(MCT+10NO 组和MCT+7Me组),故后续研究对Con组、MCT组、MCT+30NO组和MCT+21Me组进行病理学形态分析。HE染色显示Con 组血管壁薄,厚度均匀一致(图2A)。与Con组相比,MCT组管壁厚度不均,中膜层明显增厚,差异有统计学意义(P<0.05,图2B)。与MCT组相比,MCT+30NO 组PAMT 明显下降(P<0.05,图2B)。与MCT+21Me 组相比,MCT+30NO 组降低PAMT效果更加明显(P<0.05,图2B)。

图2 CDDO⁃NO对MCT诱导的PAH大鼠肺小动脉中膜层厚度的影响Figure 2 Effects of CDDO⁃NO on pulmonary arterial medial wall thickness in MCT⁃induced PAH rats
2.3 CDDO⁃NO 对MCT 诱导的PAH 大鼠右心室心肌肥大的影响
心肌细胞CSA 分析显示,Con 组心肌细胞排列规则,形态一致,大小均一(图3A)。与Con组相比,MCT组细胞排列紊乱,形态不规整,胞核增大,CSA增大,差异有统计学意义(P<0.05,图3B)。与MCT组相比,MCT+30NO组和MCT+21Me组心肌细胞肥大均有所改善,CSA显著降低,但MCT+30NO组降低CSA的效果显著优于MCT+21Me组(P<0.05,图3B)。

图3 CDDO⁃NO对MCT诱导的PAH大鼠右心室心肌细胞肥大的影响Figure 3 Effects of CDDO⁃NO on right ventricular cardiomyocyte hypertrophy in MCT⁃induced PAH rats
2.4 CDDO⁃NO 对MCT 诱导的PAH 大鼠肺小动脉外膜胶原沉积的影响
如图4A所示,光镜下Con组肺小动脉外膜胶原(蓝色)沉积少。MCT组较Con组胶原沉积面积增加(P<0.05,图4B)。与MCT组相比,MCT+30NO组及MCT+21Me组小动脉外膜纤维化程度得到明显改善(P<0.05,图4B),且MCT+30NO 组改善效果较MCT+21Me组更佳(P<0.05,图4B)。
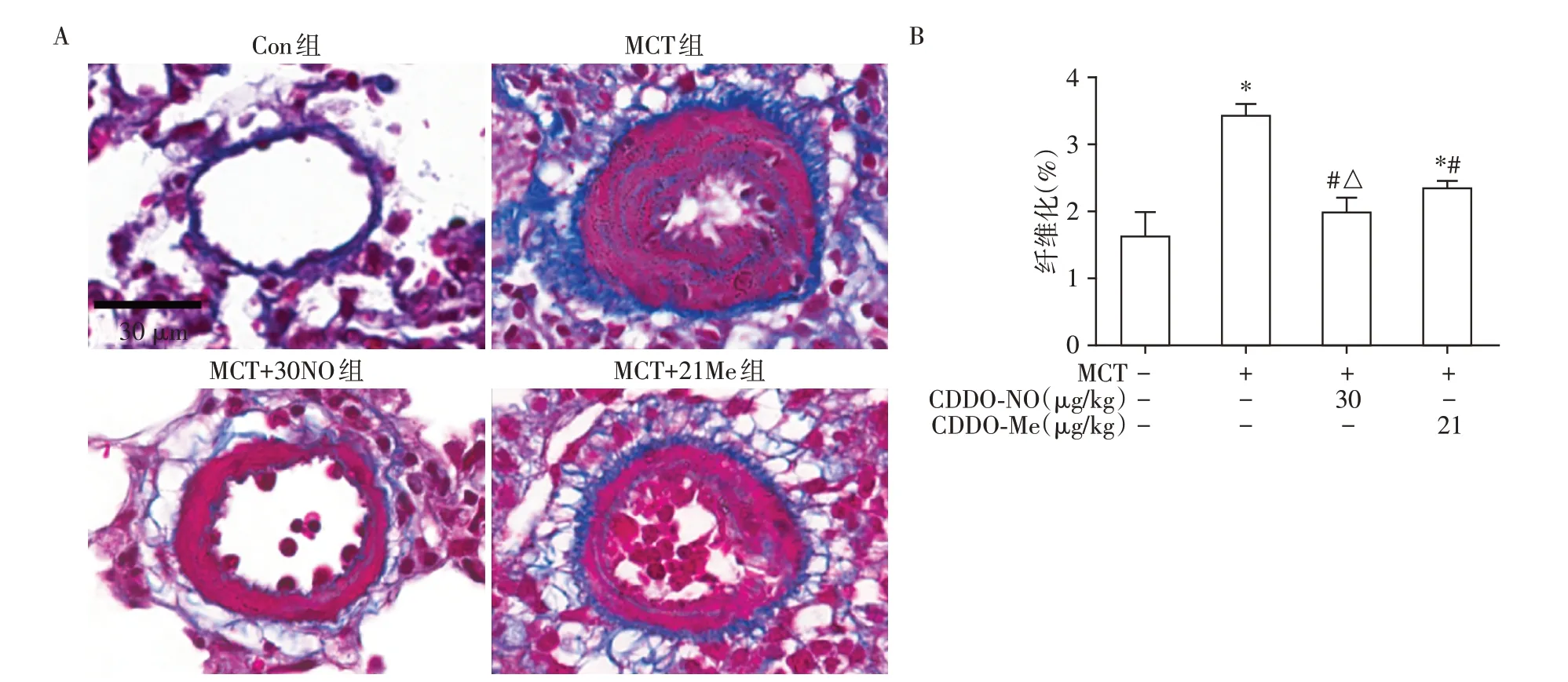
图4 CDDO⁃NO对MCT诱导PAH大鼠肺小动脉外膜胶原沉积的影响Figure 4 Effects of CDDO⁃NO on collagen deposition of pulmonary artery in MCT⁃induced PAH rats
2.5 CDDO⁃NO 对MCT 诱导PAH 大鼠肺小动脉肌化程度的影响
如图5A 所示,Con 组α⁃SMA 阳性部分面积少,肺小动脉以非肌化血管为主。与Con 组相比,MCT组以完全肌化型血管为主,差异有统计学意义(P<0.05,图5B)。与MCT组相比,MCT+30NO组给药治疗可明显降低完全肌化血管比例,增加非肌化和部分肌化血管比例(P<0.05,图5B)。与MCT+21Me组相比,MCT+30NO 组完全肌化血管显著减少(P<0.05,图5B)。

图5 CDDO⁃NO对MCT诱导PAH大鼠肺小动脉肌化程度的影响Figure 5 Effects of CDDO⁃NO on muscularization of pulmonary artery in MCT⁃induced PAH rats
3 讨论
肺血管重构是PAH的基本病理特点,即内膜增生、中膜肥厚、外膜增厚伴胶原过度沉积和周围炎性细胞浸润等[12],主要累及直径50~500 μm 的毛细血管前血管[1],这些病理改变引起管腔狭窄甚至血管闭塞,从而升高肺动脉压力。同时,右心室后负荷随之增加,随PAH进展,出现心肌肥厚、心室扩张和心肌纤维化等病理改变。CDDO⁃Me 作为一种合成类齐墩果酸衍生物,可通过活化Nrf2、抑制NF⁃κB发挥抗氧化和抗炎作用。吸入NO供体作为局部应用手段,具有选择性舒张肺血管、降低肺动脉压的潜力。本课题组与中国药科大学合作,基于ISMN和CDDO⁃Me 结构特点,合成一种新型NO 供体型CDDO⁃Me衍生物CDDO⁃NO。本课题组前期研究已发现,气道滴入CDDO⁃NO 在肺内的总代谢时间(约12 h)是CDDO⁃Me 气道给药(约6 h)的2倍[13-14]。同时,CDDO⁃NO 雾化给药后,未在大鼠血浆中检测到CDDO⁃NO,而是检测到CDDO⁃Me,提示CDDO⁃NO已在肺组织代谢,表明CDDO⁃NO 经雾化给药后靶向输送至肺组织,对肺循环选择性较好。在MCT诱导的大鼠PAH模型中,发现吸入单一小剂量CDDO⁃NO(3 μg/kg)即可降低MCT诱导PAH大鼠的肺动脉压力,抑制肺小动脉重构和心肌纤维化,且3 μg/kg CDDO⁃NO 治疗效果优于单用2.1 μg/kg CDDO⁃Me、单用0.78 μg/kg ISMN 和联用2.1 μg/kg CDDO⁃Me +0.78 μg/kg ISMN[13-14]。此外,CDDO⁃NO 还可通过抑制NADPH氧化酶4,减少肺小动脉周围细胞增殖和巨噬细胞浸润,降低氧化应激水平。但本课题组前期基于小剂量CDDO⁃NO 的研究无法完全揭示CDDO⁃NO用于治疗PAH的安全性和药效剂量范围。因此,本研究进一步提高CDDO⁃NO剂量,确认该化合物用于PAH大鼠的安全性及治疗学效应,发现吸入10、30 μg/kg CDDO⁃NO和7、21 μg/kg CDDO⁃Me均可剂量依赖性地降低大鼠RVSP和RVHI,减轻中膜肥厚和肌化,减少外膜胶原沉积,抑制心肌肥大,且CDDO⁃NO(30 μg/kg)效果优于母体化合物CDDO⁃Me(21 μg/kg)。4种剂量化合物均不减少MCT模型大鼠体重增长,提示10、30 μg/kg CDDO⁃NO 和7、21 μg/kg CDDO⁃Me对PAH模型大鼠总体安全。
CDDO⁃Me 是有效的Nrf2 激活剂和NF⁃κB 抑制剂。目前,已完成CDDO⁃Me 治疗PAH 的Ⅱ期临床试验(NCT02036970),发现口服CDDO⁃Me可有效改善PAH 患者活动耐力,提高6 min 行距离[15]。氧化应激是PAH发病的关键因素之一,Nrf2⁃ARE是重要的抗氧化应激通路。Dianat等[16]研究发现MCT诱导的大鼠PAH 模型中肺组织氧化应激标志物水平升高,抗氧化基因1(oxidation resistance 1,OXR1)和Nrf2 基因表达显著降低,连续腹腔注射藏红花素21 d后可通过提高肺内OXR1和Nrf2表达增强肺组织抗氧化能力,抑制肺血管重构。HIV 感染患者可并发PAH,Simenauer等[17]研究发现HIV转录反式激活因子(HIV transactivator of transcription,Tat)与其密切相关。HIV 感染细胞分泌高水平Tat 至外周循环并被周围细胞内化,在胞内诱发促氧化环境。在人原代肺动脉内皮细胞中即使存在强效Nrf2 激活剂PB125,Tat 仍可显著抑制Nrf2⁃ARE 通路,降低下游NQO⁃1、HO⁃1等抗氧化蛋白表达,增加活性氧、硝基酪氨酸生成,表明HIV Tat 通过抑制Nrf2⁃ARE 通路增加细胞氧化应激负荷。以上研究均提示Nrf2通路在PAH 发病机制中具有重要作用。NF⁃κB 是许多炎症因子表达的关键转录因子,参与调节免疫、炎症反应。NF⁃κB 活化控制着超500 个基因的表达,而其中大部分在失调时对人体有害[18]。Hong等[19]分别对MCT 和SU5416/缺氧诱导的PAH 大鼠肺组织进行单细胞测序,发现在两种模型中广泛存在NF⁃κB、TNF⁃α信号上调,提示NF⁃κB通路在PAH发生发展中发挥重要作用。本研究发现吸入CDDO⁃Me 可 降 低MCT 诱 导PAH 大 鼠的RVSP、RVHI 和RV/BW,抑制肺血管和右心室重构,Nrf2 和NF⁃κB通路在其中的作用有待进一步研究证实。
肺动脉内皮细胞NO调控失衡可导致平滑肌张力增加和血管重构,促进PAH 发生发展。然而NO是一把双刃剑,它既可舒张肺血管、抑制血栓形成、抑制平滑肌细胞增殖和迁移[20],也可与活性氧结合产生活性氮,当其产生超过机体自我调节能力时,可使蛋白质硝化、脂质过氧化、抑制细胞呼吸链介导细胞死亡[21]。因此,直接吸入NO 治疗PAH 治疗窗窄,难以应用于临床。然而,吸入NO 供体,如雾化吸入硝酸甘油等[8],对肺循环选择性较好,具有治疗PAH的潜力。
本课题组与中国药科大学共同研发了NO供体型CDDO⁃Me衍生物CDDO⁃NO,在肺内CDDO⁃NO被分解为CDDO⁃Me和ISMN,CDDO⁃Me在局部发挥抗炎、抗氧化和抗纤维化作用而抑制肺血管重构,ISMN释出NO 选择性舒张肺血管。因此,CDDO⁃NO具有抑制血管重构和舒张肺血管的双重效应。本研究发现,吸入CDDO⁃NO减轻MCT诱导的PAH大鼠肺血管重构和右心室肥厚,且CDDO⁃NO(30 μg/kg)治疗效应优于对应剂量的母体化合物CDDO⁃Me(21 μg/kg)。然而,CDDO⁃NO对Nrf2和NF⁃κB通路的具体分子生物学效应,以及是否存在其他治疗学机制,仍需进一步研究。
综上所述,本研究结果表明吸入CDDO⁃NO 可通过抑制肺血管重构减轻MCT诱导的大鼠PAH,效果优于母体化合物CDDO⁃Me。在下一步研究中,仍需进一步探索CDDO⁃NO 相关作用的具体分子生物学机制,有望为治疗PAH 提供既可雾化吸入给药、又能联合多靶点治疗的新型化合物。

