伴随基因突变/扩增在肺癌患者中的变化及其临床意义
潘 雪,高春峰,邢玉斐,钟安媛,周 童,张增利,施敏骅
苏州大学附属第二医院呼吸与危重症医学科,江苏 苏州 215004
2021年美国癌症协会数据报告,肺癌仍是目前人类死亡率最高(男性22%,女性22%)的肿瘤[1]。肺癌的恶性程度较高,病情进展较快,超过70%的患者在确诊时已出现局部或远隔器官的转移,失去了手术治疗的最佳时机[2]。表皮生长因子受体⁃酪氨酸激酶抑制剂(epidermal growth factor receptor⁃tyrosine kinase inhibitor,EGFR⁃TKI)已成为表皮生长因子受体(epidermal growth factor receptor,EGFR)基因敏感突变患者的一线标准治疗,建议初诊非小细胞肺癌患者完善新一代基因测序(next⁃generation sequencing technology,NGS)检测[3]。NGS 检测除了可为患者选择合适的靶向治疗外,还可以预测疗效,发现耐药机制,同时能发现新的基因突变类型,为靶向药物研发提供依据[4]。本研究回顾性分析经NGS检测的71例肺癌患者的基因检测数据,并进一步分析其临床意义。
1 对象和方法
1.1 对象
纳入苏州大学附属第二医院2015 年12 月—2020年7月入组的肺癌患者,依据气管镜、电子计算机断层扫描(computed tomography,CT)引导下经皮肺穿刺、胸腔积液病理结果明确诊断。患者或家属均已签署书面知情同意书,本研究已经苏州大学附属第二医院伦理委员会审批[(2013)伦审科研第(K11)号]通过。
纳入标准:①组织学或细胞学确诊的肺癌患者;②年龄≥18岁。排除标准:①同时有其他恶性肿瘤;②存在可能影响随访和短期生存的其他严重疾病;③既往服用过EGFR⁃TKI 等靶向药物、免疫药物;④既往接受过化疗、放疗或其他治疗。共纳入71例患者(132份标本)。
1.2 标本收集及患者随访
1.2.1 检测标本
肿瘤组织来源为气管镜下活检组织标本、肺穿刺活检组织标本,循环肿瘤DNA(circulating tumor deoxyribo nucleic acid,ctDNA)检测标本为外周血液、胸腔积液、脑脊液。
1.2.2 标本收集
血液、胸腔积液、脑脊液标本:收集患者用药前和耐药后全血(8 mL)或胸腔积液(8 mL)或脑脊液(3 mL),保存于streck管,并于管壁标记患者姓名及样品号,15~35 ℃条件下运输,72 h内运送至实验室。4 ℃条件下,1 590g离心10 min,收集上清至15 mL离心管,4 ℃条件下16 000g离心10 min,再次收集上清至新的15 mL离心管。封口膜封口后干冰运输。
石蜡组织标本:收集患者肿瘤组织切片,要求恶性肿瘤细胞占比≥10%,坏死组织区域≤50%,标本编号标记规范清晰,石蜡组织标本切片厚度5 μm(防脱玻片),切片时摊片即可,无需烤片处理,取6 周以内的石蜡切片,每组切片15 张,常温或2~8 ℃运输。
1.2.3 检测方法
采用NGS检测技术(广州燃石医学检验所有限公司:Illumina 公司检测平台,美国)捕获与肿瘤发生发展高度相关基因的全部外显子,包括腺瘤性结肠息肉(adenomatous polyposis coli,APC)、乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)、细胞周期依赖性激酶抑制基因2A(cyclin⁃dependent kinase inhibitor 2A gene,CDKN2A)等,及与肺癌个性化治疗相关或高频突变基因的重要外显子及部分内含子区域,包括间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、鼠类肉瘤病毒癌基因同源物B1(v⁃raf murine sarcoma viral onco⁃gene homolog B1,BRAF)、细胞周期蛋白E1(cyclin E1,CCNE1)等,进行1 000×高深度测序,以测量上述基因中出现的低频及超低频的来自肿瘤的DNA突变、重排、拷贝数增加等。
1.2.4 生存随访
通过门诊或电话随访,于2016 年1 月开始,每个月随访1次,直至患者死亡或研究结束。随访截至2020年11月30日,患者在随访截止时间仍未死亡,则按截尾数据处理。中位随访时间28.5个月。随访率为95%,3例失访。总生存期(overall survival,OS)定义为患者治疗开始至患者死亡或末次随访的时间,中位OS定义为生存率为50%时所对应的生存时间。
1.3 统计学方法
采用GraphPad Prism7.0 统计软件进行统计分析。定性资料采用例数和率描述;符合正态分布的定量资料,采用均数±标准差()表示;非正态分布资料,采用中位数(四分位数)[M(P25,P75)]表示,两组间比较采用Mann⁃WhitneyU检验,多组间比较采用Kruskal⁃Wallis 检验,配对设计资料采用Wil⁃coxon 符号秩和检验。采用Kaplan⁃Meier 法绘制生存曲线图,比较采用Log⁃rank 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般临床资料
本研究共入组71 例患者,共132 份标本,检测标本类型包括血液(67 份)、肿瘤组织(48 份)、胸腔积液(15 份)、脑脊液(2 份)。71 例患者均为初诊患者,其中男性32 例、女性39 例;年龄(65±11)岁,年龄范围36~85岁;其中Ⅰ期患者2例,Ⅱ期患者3例,Ⅲ期患者3 例,Ⅳ期患者63 例;吸烟患者23 例;腺癌患者62 例,鳞状细胞癌患者7 例,小细胞肺癌患者2 例。所有检测标本EGFR 突变阳性率39.4%(52/132)。所有检测标本除EGFR 突变之外,另外可检测到前5位基因突变/扩增分别是肿瘤蛋白p53(tumor suppressor protein p53,TP53)、鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)、表皮生长因子受体2(human epithelial growth factor receptor 2,ERBB2)、视网膜母细胞瘤基因1(retino⁃blastoma 1,RB1)、肝细胞生长因子酪氨酸激酶受体(hepatocyte growth factor receptor,MET)。
2.2 初诊肺癌患者血液伴随基因状态
共入组初诊肺癌患者血液标本50例,基于血浆ctDNA NGS 检测结果显示,EGFR 突变阳性率34%(17/50),除EGFR 突变之外,所检测标本还可检测到79 种基因突变/扩增,共出现123 次伴随基因突变/扩增,人均2.46次/例(123次/50例),伴随基因突变/扩增频数≥2 次的见图1,伴随基因突变/扩增频数为1 次的共有60 种基因,伴随基因突变/扩增(除EGFR 外)与患者临床分期、吸烟、年龄、性别、病理类型均无关(均P>0.05,表1)。
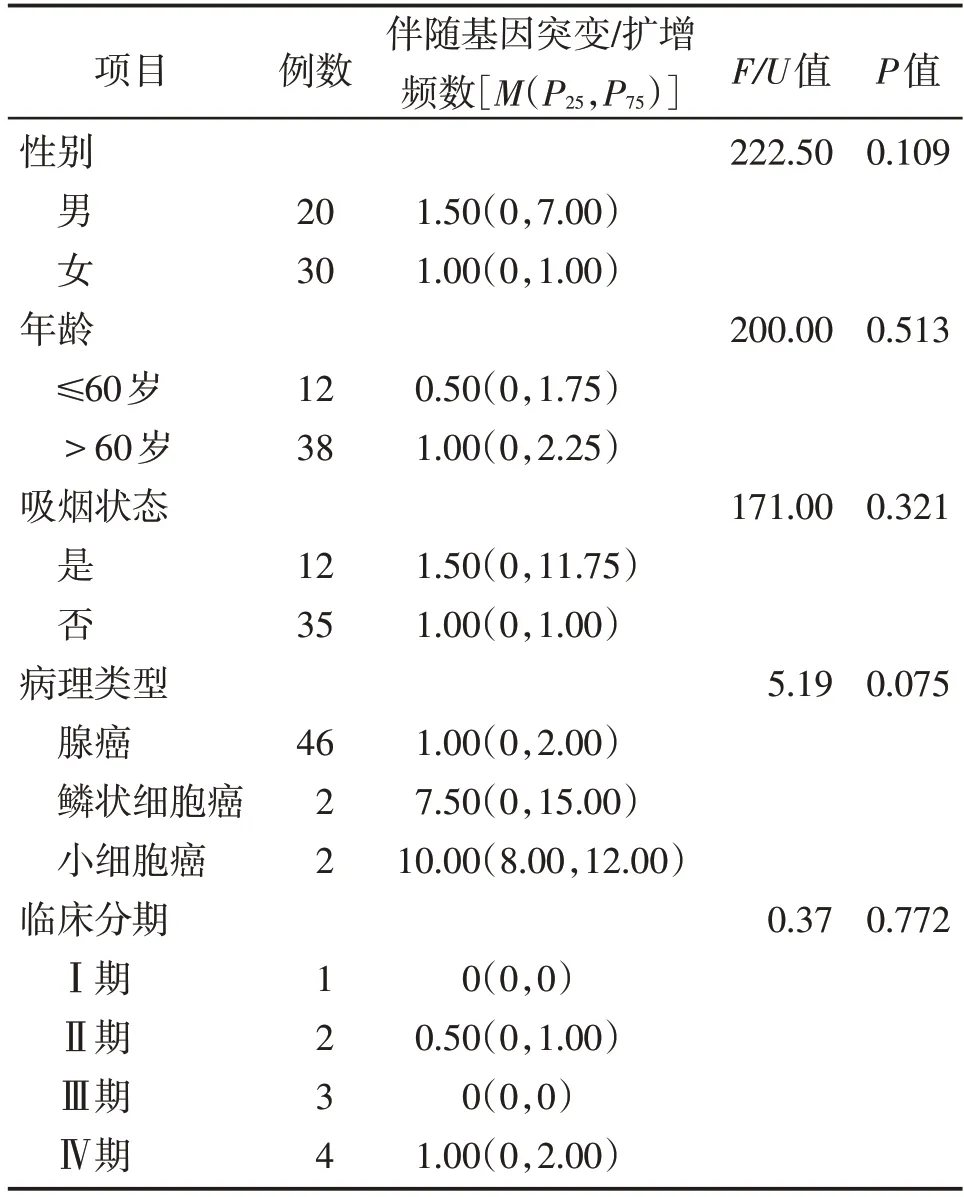
表1 50例初诊肺癌患者血液标本伴随基因突变/扩增频数与临床病理特征的关系Table 1 Correlation between frequency of associated gene mutation/amplification and clinicopatho⁃logical features in blood samples of 50 newly diagnosed lung cancer patients
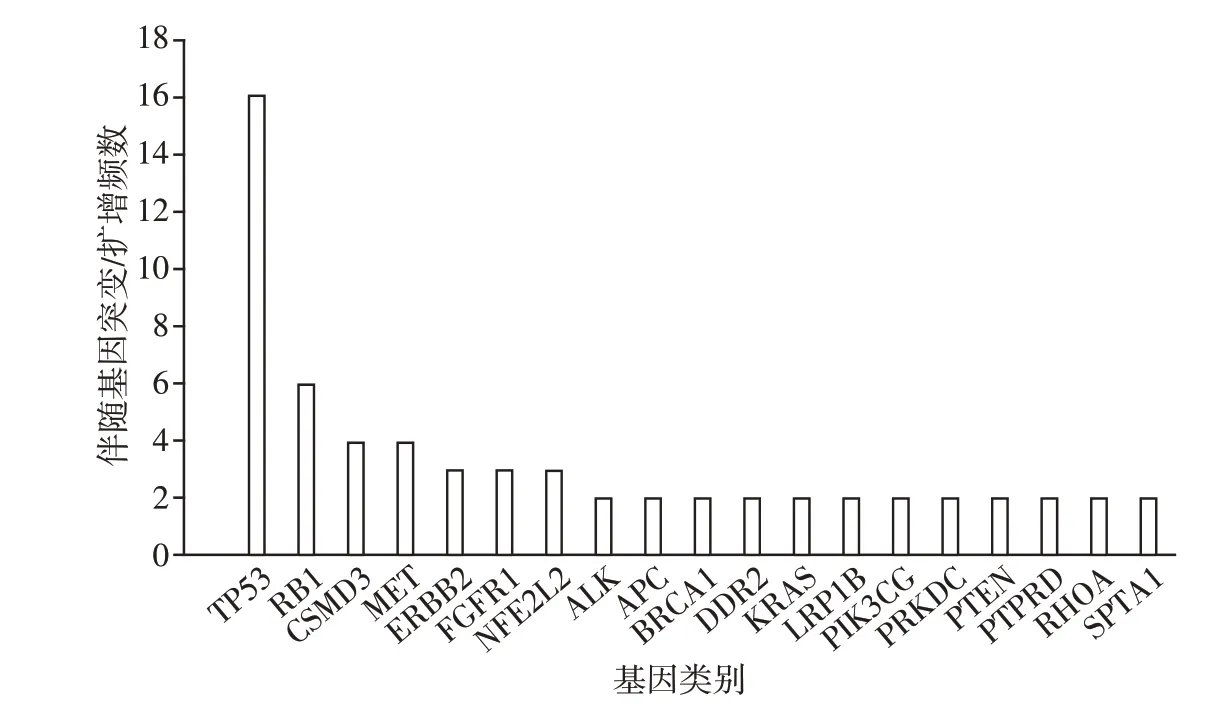
图1 50例初诊肺癌患者血液标本伴随基因突变/扩增频数分布图Figure 1 Frequency distribution of gene mutation/amplification in blood samples from 50 newly diagnosed lung cancer patients
除EGFR 突变之外,初诊肺癌患者血液标本中伴随基因TP53突变频数最高,因此针对此基因做进一步生存分析。入组Ⅳ期肺癌患者血液标本40例,TP53阳性患者中位OS为66个月,TP53阴性患者中位OS 为47 个月,两组生存曲线差异无统计学意义(χ2=0.321,P=0.571,图2)。
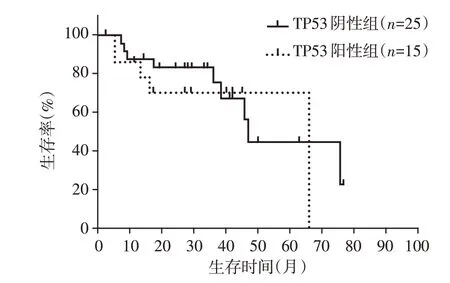
图2 肺癌患者血液标本伴随基因TP53阳性和阴性患者生存曲线的比较Figure 2 Comparison of survival curves between patients with TP53 positive and negative concomitant gene in blood samples of lung cancer patients
2.3 初诊肺癌患者肿瘤组织伴随基因状态
共入组初诊肺癌患者肿瘤组织46 例,EGFR 突变阳性率50%(23/46),除EGFR 突变之外,所检测标本还可检测到160 种基因突变/扩增,所有标本共出现285 次伴随基因突变/扩增,人均6.20 次/例(285 次/46 例),伴随基因突变/扩增频数≥2 次的见图3,伴随基因突变/扩增频数为1 次的共有107 种,伴随基因突变/扩增(除EGFR 外)与患者临床分期、年龄均无关(均P>0.05),与吸烟状态、性别、病理类型均有关(均P<0.05,表2)。
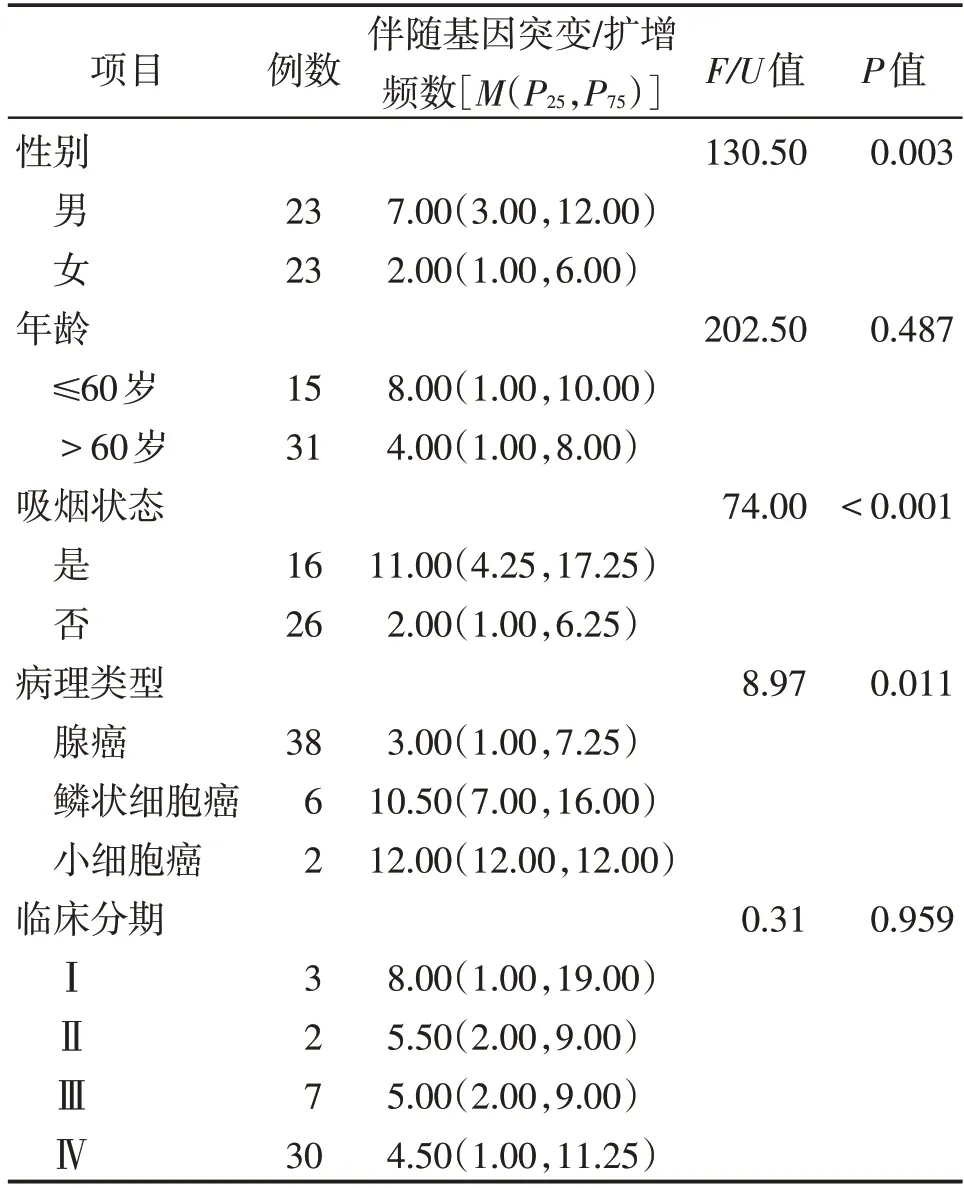
表2 46例初诊肺癌患者肿瘤组织标本伴随基因突变/扩增频数与临床病理特征的关系Table 2 Correlation between frequency of associated gene mutation/amplification and clinicopatho⁃logical features in tumor tissue samples of 46 newly diagnosed lung cancer patients
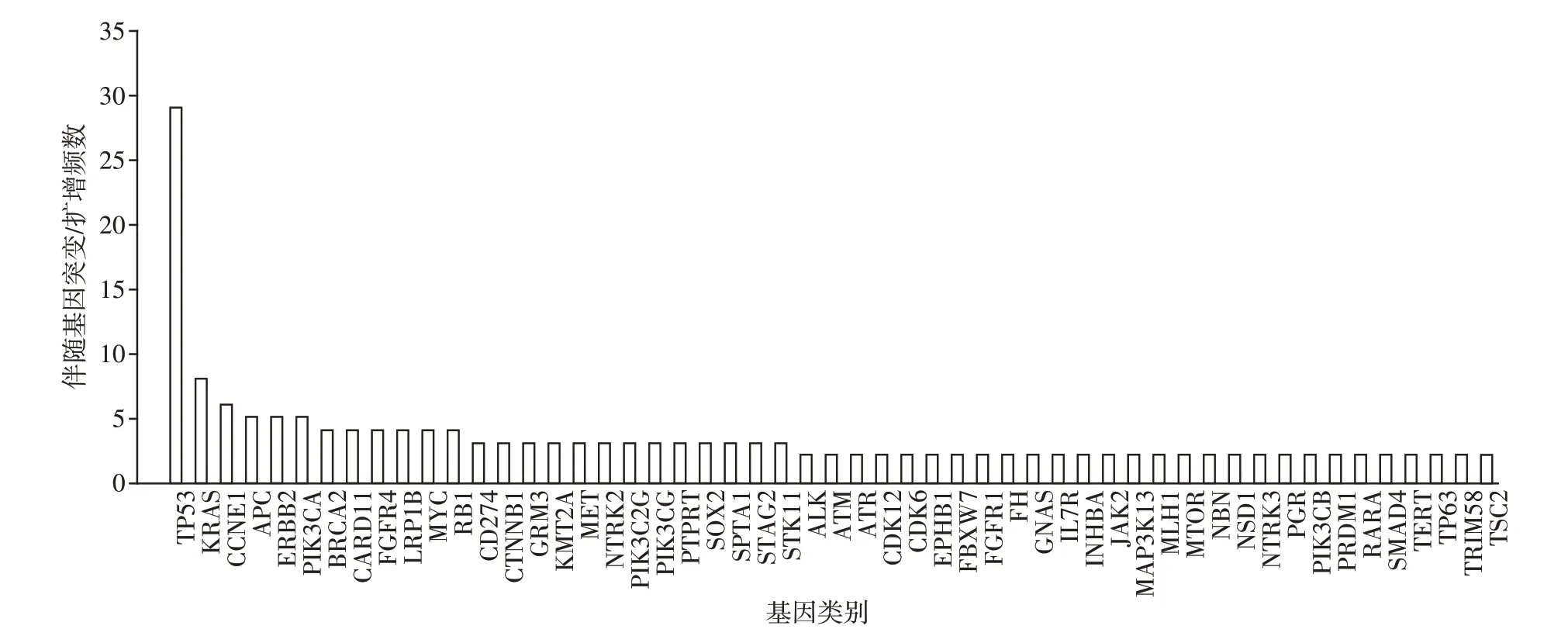
图3 46例初诊肺癌患者肿瘤组织标本伴随基因突变/扩增频数分布图Figure 3 Frequency distribution of gene mutation/amplification in tumor tissue samples from 46 newly diagnosed lung can⁃cer patients
除EGFR 突变之外,初诊肺癌患者肿瘤组织标本中伴随基因TP53出现突变频数最高,因此针对此基因做进一步生存分析,入组Ⅳ期肺癌患者肿瘤组织标本25 例,TP53 阳性患者中位OS 未达到,TP53阴性患者中位OS为38.5个月,两组生存曲线间差异无统计学意义(χ2=0.309,P=0.579,图4)。
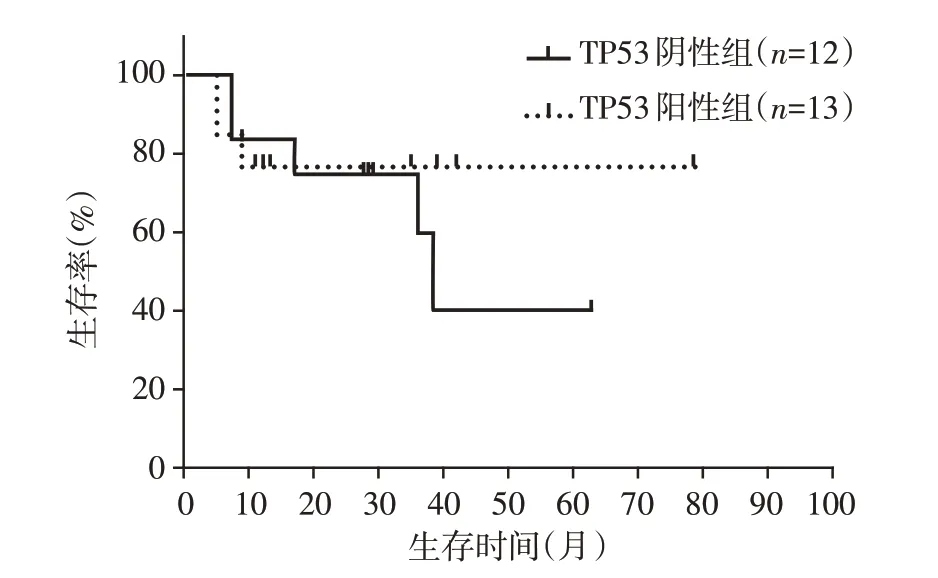
图4 肺癌患者肿瘤组织标本伴随基因TP53阳性和阴性患者生存曲线的比较Figure 4 Comparison of survival curves between patients with TP53 positive and negative concomitant gene in tumor tissue samples of lung cancer patients
2.4 同时进行肿瘤组织和血液标本配对检测的患者伴随基因状态
共入组25 例,初诊肿瘤组织中基因突变/扩增频数[3(1,8)]高于同一患者的血液组[3(0,1)],两者之间差异有统计学意义(W=-150,P=0.001);动态监测抗肿瘤治疗前后的17例患者,其中使用EGFR⁃TKI 治疗9 例,间变性淋巴瘤激酶抑制剂(anaplastic lymphoma kinase inhibitor,ALK⁃TKI)治疗3 例,化疗5 例,抗肿瘤治疗前后两组伴随基因突变/扩增频数相比[1(0,2)vs.1(0,3)],差异无统计学意义(W=-3,P=0.916)。
3 讨论
全面的分子生物学检测信息可为肺癌患者方案选择、预后判断以及临床试验入组提供依据。准确获取患者基因的突变状态,有助于筛选更加合适的治疗人群,精准地指导临床个体化治疗,为肿瘤诊断、治疗方案选择、预后监控等提供重要信息[5]。以EGFR 为例,与标准化疗方案相比,EGFR 敏感突变型晚期非小细胞肺癌患者使用小分子靶向药物EGFR⁃TKI 治疗,极大地提高了该患者群的临床疗效(客观缓解率、无进展生存期、总生存时间)及生命质量[6]。但仍有20%~30%的EGFR 敏感基因突变的患者出现原发性耐药或快速进展,可能是由于EGFR 突变合并其他伴随基因突变,导致下游或旁路信号通路激活[7]。BENEFIT 研究是一项单臂、多中心、前瞻性、大型Ⅱ期临床试验(CTONG1405;NCT02282267),2014 年12 月—2016 年1 月,共纳入中国15个中心的426例Ⅳ期肺腺癌患者,其中391例具有组织和血液样本,188 例患者血液EGFR 突变阳性并接受吉非替尼治疗(250 mg/d),在180 例具有基线NGS 数据的EGFR 突变患者中,仅存在EGFR 敏感突变患者,无进展生存期可达13.2个月,EGFR敏感突变合并TP53 突变患者,无进展生存期为9.3 个月,伴随其他基因突变亚组患者,无进展生存期仅为5.5个月[8]。
正常情况下TP53可以控制细胞循环周期、调节转录、DNA复制和诱导细胞程序性死亡及抗血管生成。TP53突变几乎在所有人类癌症中均有发生,是最常见的突变基因之一,在肺鳞状细胞癌患者中甚至高达80%[9-10]。TP53突变可激活T细胞介导的免疫反应,可能成为免疫治疗疗效的潜在预测因子[11]。本研究发现,伴随基因TP53 突变与否与生存率无关,可能与本研究入组患者多为使用靶向药物治疗患者,且免疫治疗患者相对较少有关,后续有待进一步增大样本量进行统计学分析。在肺癌患者组织标本中行生存分析时,TP53 阳性患者中位OS 未达到,考虑可能与随访时间仍较短,且样本量不足有关,后续有待进一步增大样本量行统计学分析。
本研究共入组初诊肺癌患者血液标本50例,除EGFR 突变之外,所检测标本还可检测到79 种基因突变/扩增,共出现123 次伴随基因突变/扩增;本研究入组初诊肺癌患者肿瘤组织46例,除EGFR 突变之外,所检测标本还可检测到160 种基因突变/扩增,所有标本共出现285 次伴随基因突变/扩增,同一患者肿瘤组织标本中伴随基因突变/扩增频数高于血液标本,原因可能是肿瘤患者体内ctDNA 的含量低、半衰期短、需要高灵敏度的检测技术进行基因检测[12]。另外,需考虑肿瘤存在异质性,肿瘤组织检测反映肿瘤局部基因水平状态,基于ctDNA 的基因检测更能反映患者的整体状态,并允许实时监测,可作为肿瘤组织基因检测的补充[13]。
本研究针对抗肿瘤治疗前后的17 例患者进行基因检测结果分析,发现抗肿瘤治疗前和抗肿瘤治疗后两组伴随基因突变/扩增频数相比,差异无统计学意义,原因可能为入组病例较少,且各组患者一线治疗方案有所差异,不同的治疗方案可能导致基因突变/扩增发生改变,后续将进一步扩大样本量,同时针对不同临床标本及不同治疗方案的患者分别进行统计分析。另外,本研究入组胸腔积液、脑脊液病例以及病理类型为鳞状细胞癌、小细胞癌病例均较少,后续应尽可能扩大样本量。本研究为单中心研究,期待有更多的随机对照研究进一步探索伴随基因异常对患者预后的影响。
肺癌患者抗肿瘤治疗前即存在多种伴随基因突变/扩增,有吸烟史、男性患者具有较高水平的伴随基因突变/扩增频数,伴随基因突变/扩增频数的改变不能提示患者病情进展,随着靶向治疗和免疫治疗逐渐在肿瘤治疗中占据主导地位,基因测序技术具有极大的发展前景。肺癌是一个多基因参与的复杂病变过程,采用多标本、多基因的平行、动态检测有助于反映肺癌驱动基因全貌,更全面评估肿瘤的耐药机制,对临床具有指导意义。

