索拉非尼联合TACE对肝癌患者的免疫功能及甲胎蛋白水平的影响
魏晓岑
肝癌为消化系统常见肿瘤,其发病原因复杂,多与遗传因素、病毒感染等有关。肝癌发病初期并无特异性表现,多数患者确诊时已处于中晚期,无法进行手术根治[1-2]。肝动脉栓塞化疗(TACE)为中晚期肝癌患者的主要治疗手段,虽疗效显著,但不良反应高发,降低患者的免疫功能,不利于预后[3]。因此,在给予肝癌患者TACE 治疗的同时联合其他抗肿瘤药物有利于整体治疗效果的提高。索拉非尼为临床常用的靶向抗肿瘤药物。本研究对索拉非尼联合TACE 在肝癌患者中的治疗效果予以分析,现报道如下。
1 资料与方法
1.1 一般资料 选取2014 年1 月-2021 年1 月莱西市人民医院收治的80 例肝癌患者。纳入标准:(1)符合原发性肝癌诊断标准;(2)存在手术适应证;(3)可测量病灶≥1 个;(4)预计生存期>3 个月。排除标准:(1)伴有肝脏癌栓、肝外转移、肝性脑病;(2)伴有凝血功能及免疫功能障碍;(3)肿瘤已侵犯胆囊、门静脉等;(4)伴有重要脏器功能异常;(5)伴有其他恶性肿瘤;(6)伴有精神意识严重障碍;(7)临床资料不全。使用随机数字表法将患者分为观察组(n=40)及对照组(n=40)。所有患者及家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法 对照组行单一TACE 治疗。消毒铺巾后,使用利多卡因对患者进行局部麻醉。麻醉效果满意后,经皮右侧股动脉穿刺,将导管鞘置入,随后将TACE 导管经导管鞘插入肝动脉,行肝动脉造影,将病灶供血血管予以明确。随后注入0.25 g 氟尿嘧啶(生产厂家:天津金耀药业有限公司,批准文号:国药准字H12020959,规格:10 mL︰0.25 g)、40 mg 注射用盐酸表阿霉素[ 生产厂家:辉瑞制药(无锡)有限公司,批准文号:国药准字H20000496,规格:10 mg)及7~20 mL 碘化油注射液(生产厂家:烟台鲁银药业有限公司,批准文号:国药准字H37022398,规格:10 mL)三者混合而成的乳剂,做栓塞处理。若栓塞不理想,则使用直径为300~500 µm 的空白微球栓塞。术中予10 mg地塞米松磷酸钠注射液(生产厂家:遂成药业股份有限公司,批准文号:国药准字H41021255,规格:1 mL︰5 mg)、5 mg 盐酸托烷司琼注射液[生产厂家:山西振东制药股份有限公司,批准文号:国药准字H20052476,规格:5 mL︰5.64 mg(相当于托烷司琼5 mg)]推注,术毕后将导管拔出,穿刺点处常规加压包扎。观察组行索拉非尼联合TACE治疗。TACE 方法与对照组相同。口服甲苯磺酸索拉非尼片(生产厂家:Bayer AG,注册证号:国药准字HJ20160201,规格:0.2 g),0.4 g/次,2 次/d。于TACE 术后3~5 d 开始服用。服药后,患者若出现毒副反应,则减少药物剂量至0.2 g/次,2 次/d。连续用药12 周。随访时间为治疗后12 个月。
1.3 观察指标与判定标准
1.3.1 近、远期疗效 近期疗效:于治疗12 周后,应用实体瘤疗效评价标准(RECIST)对两组的近期疗效进行评价。疗效级别为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。客观有效率(ORR)=(CR+PR)/总例数×100%。疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。远期疗效:为期12 个月的随访结束后,总结计算两组的6、12 个月生存率。
1.3.2 免疫功能指标 于治疗前及治疗12 周后采集空腹静脉血3 mL,离心处理后取上清液,使用流式细胞仪检检测T 淋巴细胞亚群(荧光标记单克隆抗体购自Beckman-Coulter 公司),检测CD3+、CD4+、CD8+,CD4+/CD8+水平。
1.3.3 甲胎蛋白(AFP)及血管内皮生长因子(VEGF) 于治疗前及治疗12 周后采集空腹静脉血3 mL,使用ELISA 测定VEGF 水平。使用化学发光法测定AFP 水平,试剂盒及仪器均购自美国罗氏公司。
1.3.4 肝功能指标 于治疗前及治疗12 周后采集空腹静脉血3 mL,离心处理后取上清液,使用深圳迈瑞BS-260 全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、总胆红素(TBIL)。
1.4 统计学处理 采用SPSS 22.0 软件对所得数据进行统计分析,计量资料用()表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
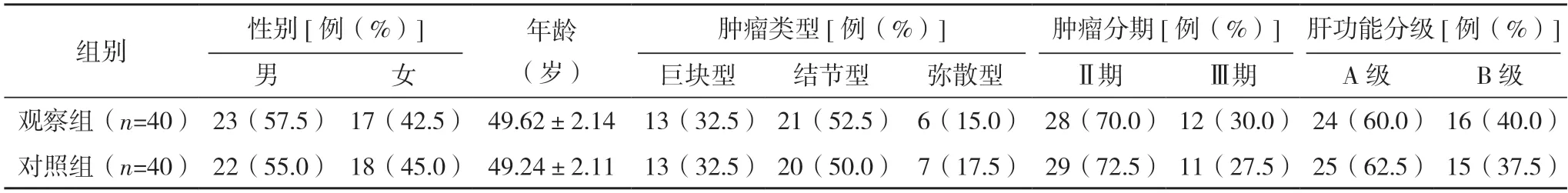
表1 两组一般资料比较
2.2 两组近期疗效比较 观察组ORR 及DCR 均高于对照组,差异均有统计学意义(P<0.05),见表2。
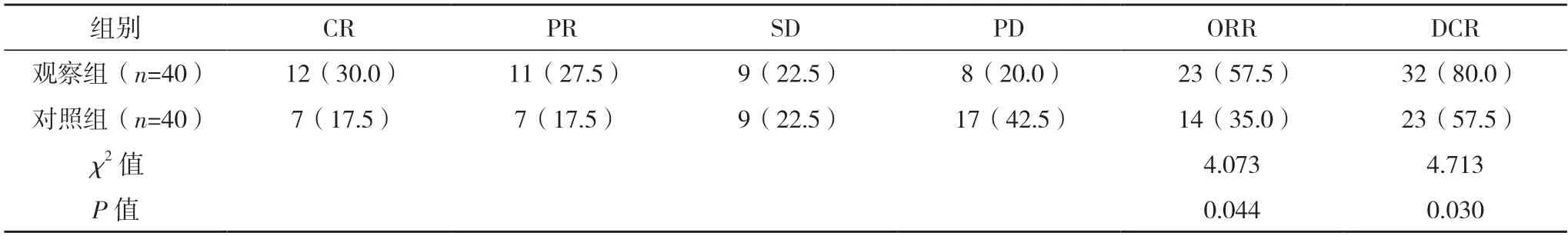
表2 两组近期疗效比较[例(%)]
2.3 两组远期疗效比较 两组6 个月生存均为40 例,生存率均为100%,两组比较差异无统计学意义(P>0.05);对照组12 个月生存30 例,生存率为75.0%,观察组12 个月生存37 例,生存率为92.5%。观察组12 个月生存率高于对照组,差异有统计学意义(χ2=4.501,P=0.034)。
2.4 两组免疫功能指标比较 治疗前,两组的CD3+、CD4+、CD4+/CD8+、CD8+比较,差异均无统计学意义(P>0.05);治疗后,两组CD3+、CD4+、CD4+/CD8+均高于治疗前,CD8+均低于治疗前,观察组均优于对照组(P<0.05)。见表3。
表3 两组免疫功能指标比较()

表3 两组免疫功能指标比较()
*与治疗前比较,P<0.05。
2.5 两组AFP 及VEGF 水平比较 治疗前,两组AFP 及VEGF 水平比较,差异均无统计学意义(P>0.05);治疗后,两组AFP 及VEGF 水平均低于治疗前,且观察组均低于对照组(P<0.05)。见表4。
表4 两组AFP及VEGF水平比较[µg/L,()]

表4 两组AFP及VEGF水平比较[µg/L,()]
*与治疗前比较,P<0.05。
2.6 两组肝功能指标比较 治疗前,两组的ALT、ALB、TBIL 水平比较,差异均无统计学意义(P>0.05);治疗后,两组ALT 及TBIL 均高于治疗前,ALB 低于治疗前,且观察组均优于对照组(P<0.05)。见表5。
表5 两组肝功能指标比较()
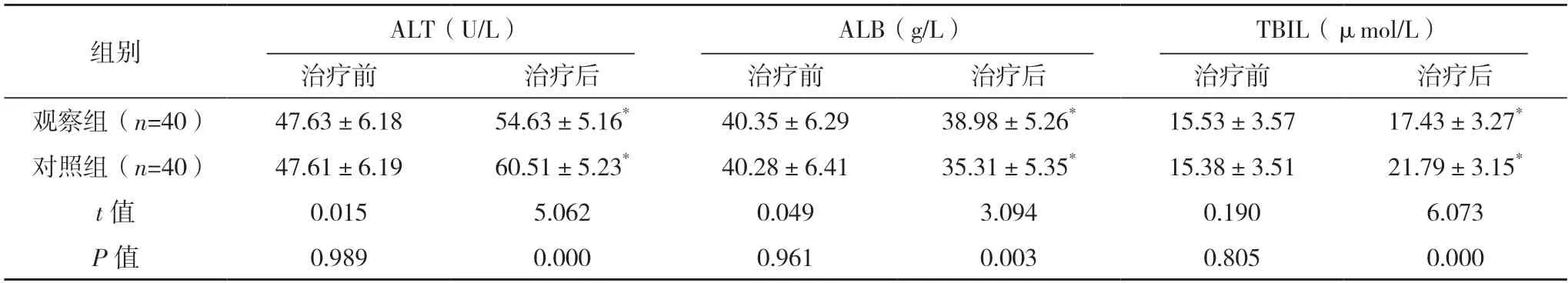
表5 两组肝功能指标比较()
*与治疗前比较,P<0.05。
3 讨论
TACE 在肝癌治疗中具有创伤小、可重复、疗效优异等优势,可抑制肿瘤生长,但单独使用效果不佳,且患者接受TACE 后复发率较高[4-5]。因此,临床应用TACE 治疗肝癌需与其他抗肿瘤药物联用[6-7]。索拉非尼为一种分子靶向药物,在肿瘤细胞异常表达通路中具有显著作用,对肿瘤细胞生长产生抑制以促进其凋零,临床效果优异[8-10]。
免疫细胞是机体免疫应答发挥作用的重要载体。T 细胞亚群是重要的免疫细胞群,由该细胞群介导的免疫反应可杀伤肿瘤细胞、控制肿瘤生长[11-12]。CD3+代表着细胞免疫的总体水平,可细分为CD4+和CD8+,CD4+/CD8+降低是免疫抑制的重要标志[13-14]。本研究结果显示,接受TACE 联合索拉非尼治疗的肝癌患者的CD3+、CD4+、CD4+/CD8+水平较治疗前升高,CD8+较治疗前降低,且优于接受单一TACE 治疗的患者,提示索拉菲尼可改善肝癌患者的免疫抑制状态,增强患者的免疫功能。
AFP 为典型的肝癌肿瘤标志物,在原发性肝癌患者体内表达量较高,但经治疗后可见显著下降,其水平直观反映治疗效果[15-16]。肝癌是一种血管丰富的实体瘤,其发展与血管形成之间存在正相关关系[17]。多种组分共同促进血管生成,VEGF 则为其中之一。VEGF 为一种血管生成诱导因子,诱导力较强[18]。本研究结果显示,接受TACE 联合索拉非尼治疗的肝癌患者的AFP 及VEGF 水平均较治疗前降低,且优于接受单一TACE 治疗的患者,提示索拉非尼可显著抑制肝癌的发生发展,阻碍肿瘤血管的生成。
TBIL、ALT 可对人体肝功能进行直观反映,当肝功能受损时,机体内的TBIL、ALT 表达量会显著增加,同时导致ALB 下降[19-20]。本研究结果显示,接受TACE 联合索拉非尼治疗的肝癌患者的ALT 及TBIL 水平较治疗前升高,但低于单一TACE 治疗组;ALB 较治疗前降低,但高于单一TACE 治疗组。提示索拉非尼可在TACE 治疗后缓解患者肝功能损伤,加速患者营养恢复。
综上所述,索拉非尼联合TACE 可增强肝癌患者免疫功能,降低AFP 及VEGF 水平,减缓肝功能损伤,提高远期生存率,效果优异。

